| ○ Таблица №1 ○ Характеристика аминокислоты | |
| Общее | |
| Тривиальное название | Лизин (Lysin) |
| Трехбуквенное обозначение | Лиз, Lys |
| Однобуквенное обозначение | K |
| Название по IUPAC | 2,6-диаминогексановая кислота (2,6-Diaminohexanoic acid) |
| Брутто-формула | C6H14N2O2 |
| Физические свойства | |
| Молярная масса (г/моль) | 146,1876 C 49,3 %, H 9,65 %, N 19,16 %, O 21,89 % |
| Т.плав | 224°C |
| Растворимость в воде | 642 г/л при 20°C 780 г/л при 30°C |
| pKa | 2,15 (карбоксильная группа) 9,16 (амино группа) 10,67 (радикальная группа) |
| Изоэлектрическая точка | 9,74 |
| Классификация | |
| PubChem | 866 - DL-Lysine 5962 - L-lysine |
| Некоторые биохимические особенности | |
| Кодоны | AAA, AAG |
| Синтез у человека | Незаменимая аминокислота |
| Встречаемость у позвоночных | 7,2% |
| Кристаллография | |
| Параметры ячейки кристаллической решетки | L-lysine : a = 7,492 Å b = 13,320 Å c = 5,879 Å α = 90,00 ° β = 97,79 ° γ = 90,00 °5 |
| Оптические свойства | |
| Оптическое вращение | +14,6 |
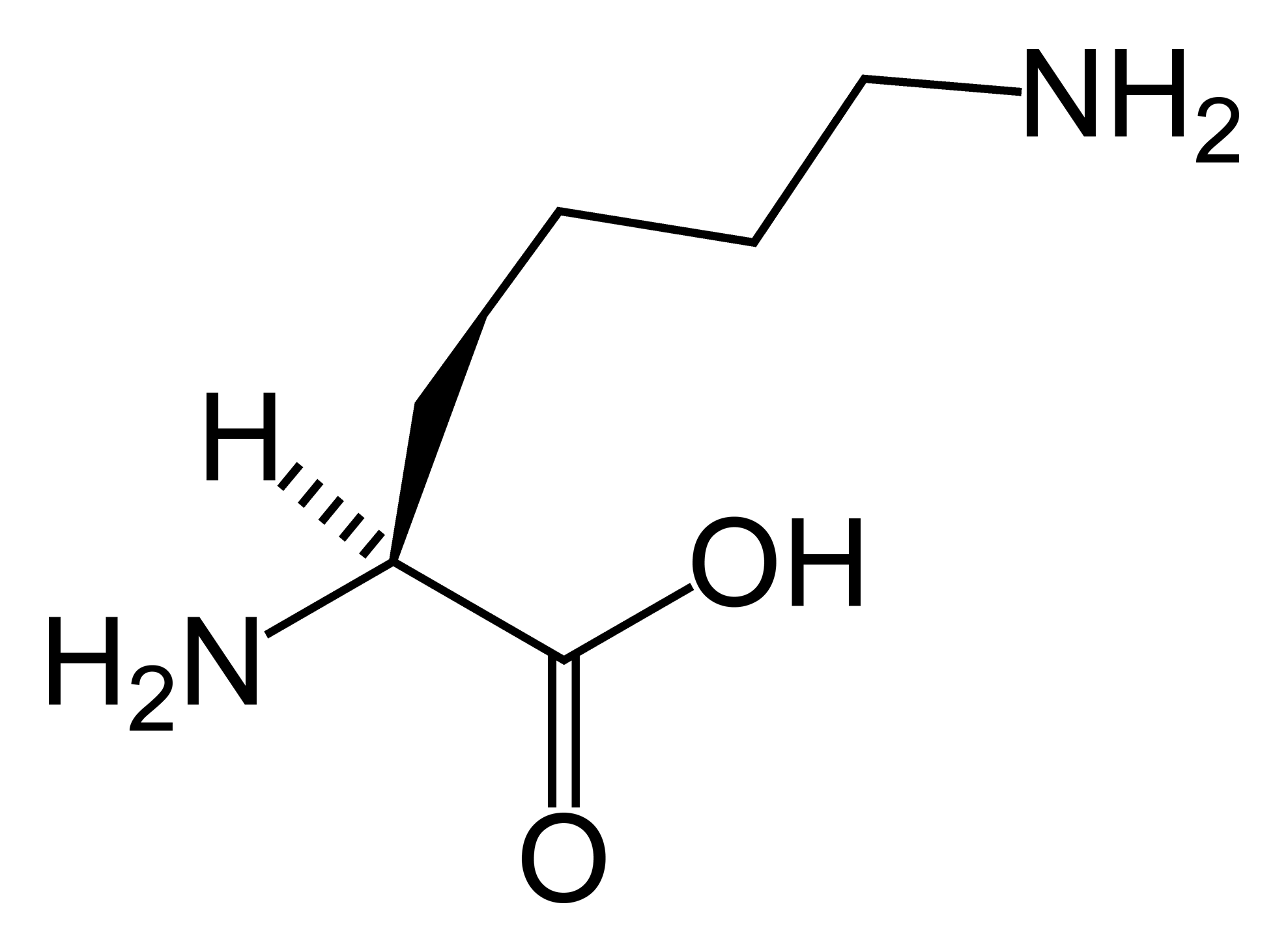
|
| Рис. 1 [6] LYS |
Апплет 1
Названия атомов
Апплет 2
Заряженные формы
История
Выделен впервые из казеина Э.Дрекселем в 1889 году [1].
Синтез
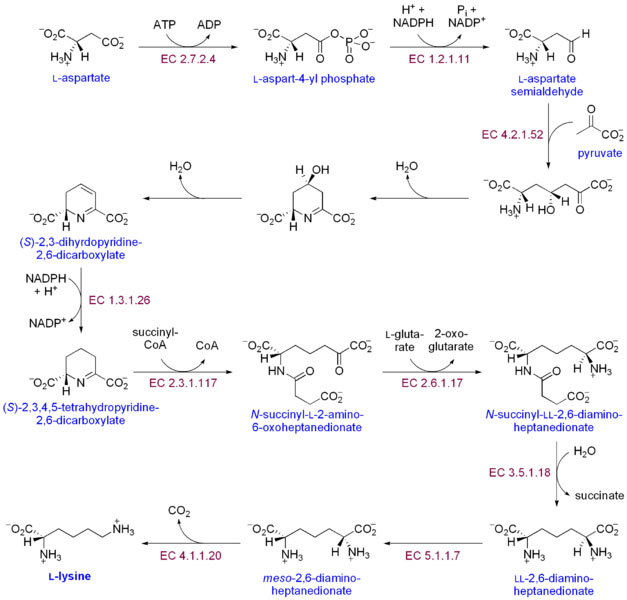
|
| Рис. 2 [2] Синтез Lys |
Синтезируется растениями и большинством бактерий из аспартата (Рис. 2) L-аспартат сначала преобразуется в L-аспартил-4-фосфат с помощью аспартокиназа (или аспартаткиназу). АТФ необходим в качестве источника энергии для этого шага. b-аспартат полуальдегид дегидрогеназа преобразовывает это в бета-аспартил-4-полуальдегида (или бета-аспартат-4-полуальдегида). Энергия от НАДФН используется в этом преобразовании. 4-гидрокси-тетрагидродипиколинат синтазы добавляет пируват группу к бета-аспартил-4-полуальдегида, а молекула воды удаляется. Это приводит к циклизации и приводит к (2S, 4S)-4-гидрокси-2,3,4,5-тетрагидродипиколинат. Этот продукт восстанавливают до 2,3,4,5-тетрагидродипиколинат (или Δ1-пиперидин-2,6-дикарбоксилат, на рисунке: (S) -2,3,4,5-тетрагидропиридин-2,6-дикарбоновой кислоты) от 4-гидрокси-тетрагидродипиколинат-редуктазы. Эта реакция потребляет молекулу NADPH и выпускает вторую молекулу воды. тетрагидродипиколинат N-ацетилтрансфераза открывает это кольцо и приводит к N-сукцинил-L-2-амино-6-оксогептандионат (или N-ацил-2-амино-6-оксимелат). Две молекулы воды и один ацил-CoA-редуктазы (сукцинил-КоА) фермент используют в этой реакции. N-сукцинил-L-2-амино-6-oxoheptanedionate превращается в N-сукцинил-LL-2,6-диаминогептандионат (N-ацил-2,6-диаминопимелатдегидрогеназу). Эта реакция катализируется ферментом сукцинил диаминопимелатдегидрогеназу аминотрансферазы. Молекула глутаминовой кислоты в этой реакции используют и oxoacid образуется в качестве побочного продукта. N-сукцинил-LL-2,6-диаминогептандионат (N-ацил-2,6-диаминопимелатдегидрогеназу) превращают в LL-2,6-диаминогептандионат (L, L-2,6-диаминопимелатдегидрогеназу) путем сукцинил диаминопимелатдегидрогеназу desuccinylase (acyldiaminopimelate deacylase ). Молекула воды расходуется в этой реакции, и сукцинат образуется побочный продукт. LL-2,6-diaminoheptanedionate преобразуется диаминопимелатдегидрогеназу эпимеразы в мезо-2,6-диамино-heptanedionate (мезо-2,6-диаминопимелатдегидрогеназу). И, наконец, мезо-2,6-диамино-heptanedionate превращается в L-лизина с помощью диаминопимелатдекарбоксилазы.
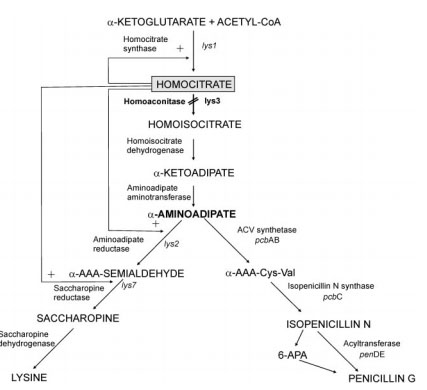
|
| Рис. 3 [2] Синтез Lys |
Грибы, эвгленовые и прокариоты рода Thermus
используют другой способ биосинтеза – альфа-аминоадипатный путь. (Рис. 3)
Гомоцитрат первоначально синтезируется из ацетил-КоА и 2-оксоглутарата
гомоцитрат-синтазой. Это затем преобразуется в гомоаконитат гомоаконитазой, а затем гомоизоцитрат
гомоизоцитрат дегидрогеназой. Атом азота добавляют из глутамата амиоадипат аминотрансферазы с
образованием альфа-аминоадипата, из которого этот путь получил свое название.
Это затем восстанавливают аминоадипат редуктазы через ацил-фермент интермидиат к полуальдегиду.
Реакция с глутаматом одним классом сахаропин дегидрогеназы дает
сахаропин, который затем расщепляется с помощью второго класса сахаропин дегидрогеназы
с получением лизина и оксоглутарата.
Роль в составе белков
Апплет 3
Тип контактов
На Апплете 3 последовательно показываются: 1. Солевой мостик с радикалом аспартата 2. Солевой мостик с радикалом глутамата 3. Водородная связь с кислородам остова (глутамата) 4. Гидрофобное взаимодействие длинной углеводородной части радикала лизина с ДНК 5. Взаимодействие положительно заряженного конца радикала лизина с отрицательно заряженными фосфатными группами ДНК Существует 2 способа взаимоодействия лизина с ДНК: гидрофобное взаимодействие (у лизина длинная углеводродная часть радикала), взаимодействие положительно заряженной амино группы с отрицательно заряженными фосфатами ДНК. Благодаря таким свойствам лизин очень часто встречается в белках, взаимодействующих с ДНК, таких как транскрипционные факторы, гистоны и др. Например, транскрипционный фактор MEF2A (на его основе приведен контакт лизина с ДНК в Апплете 3)
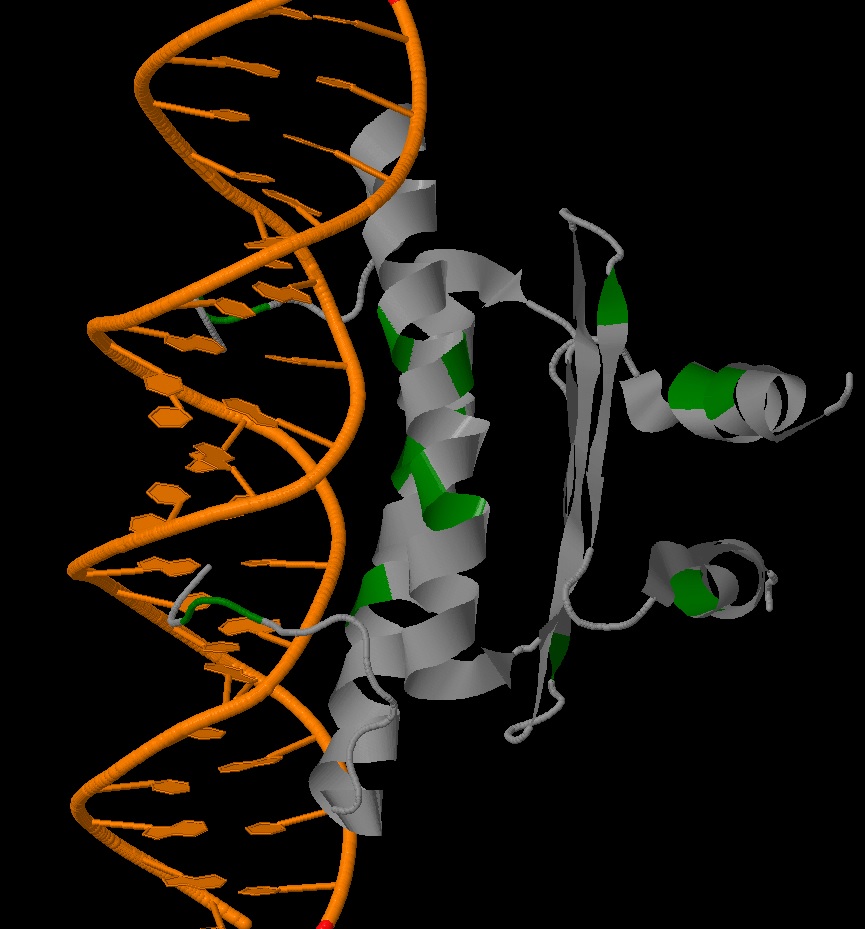
|
| Рис. 4 [2] Транскрипционный фактор MEF2A, взаимодействующий с ДНК. Зеленым выделены лизины |
MEF2 белок относится к группе транскрипционных факторов, которые играют ключевую роль в миогенезе и морфогенезе миоцитов. Он специфически связывается с консервативной последовательностью A-T богатых участках большинства мышце-специфичных генов, в том числе генов, которые кодируют основные миогенные белки спираль-петля-спираль. В последнее время было показано, что MEF2 белки также играют важную роль в регуляции клеточной судьбы в других типах клеток, в том числе влияют на выживаемость нейрональных клеток. Этот белок состоит из 2-х доменов: MADS-box и MEF2S домен. Узнавание и специфичность обеспечиваются взаимодействием MADS-box и обеих малой и большой бороздками ДНК. Как видно на Рис. 4 в петлях, взаимодействующих в ДНК, на самых концах находятся лизины, как раз обеспечивающие это взаимодействие. Также лизин играет роль в обеспечени смены пула белков клетки.Убиквитин-протеасомный путь (УПП) является основным клеточный механизм для регулируемого протеолиза, и его специфика обеспечивается универсальность убиквитиновой системы. Убиквитиновые сигналы генерируются посредством ковалентного присоединения С-концевой глицина убиквитина к специфическому остатку лизина в белковом субстрате с помощью процесса, известного как убиквитилирования. Универсальность убиквитиновой системы достигается за счет способности убиквитина взаимодействовать с субстратами в качестве одного фрагмента (Моно-убиквитин) или нескольких фрагментов (различные типы поли-убиквитиновых цепей). Поли-убиквитиновые цепи, как правило, связаны с помощью любого из семи остатков лизина (Lys6, Lys11, Lys27, Lys29, Lys33, Lys48, и Lys63) или N-концевой остаток метионина убиквитина.
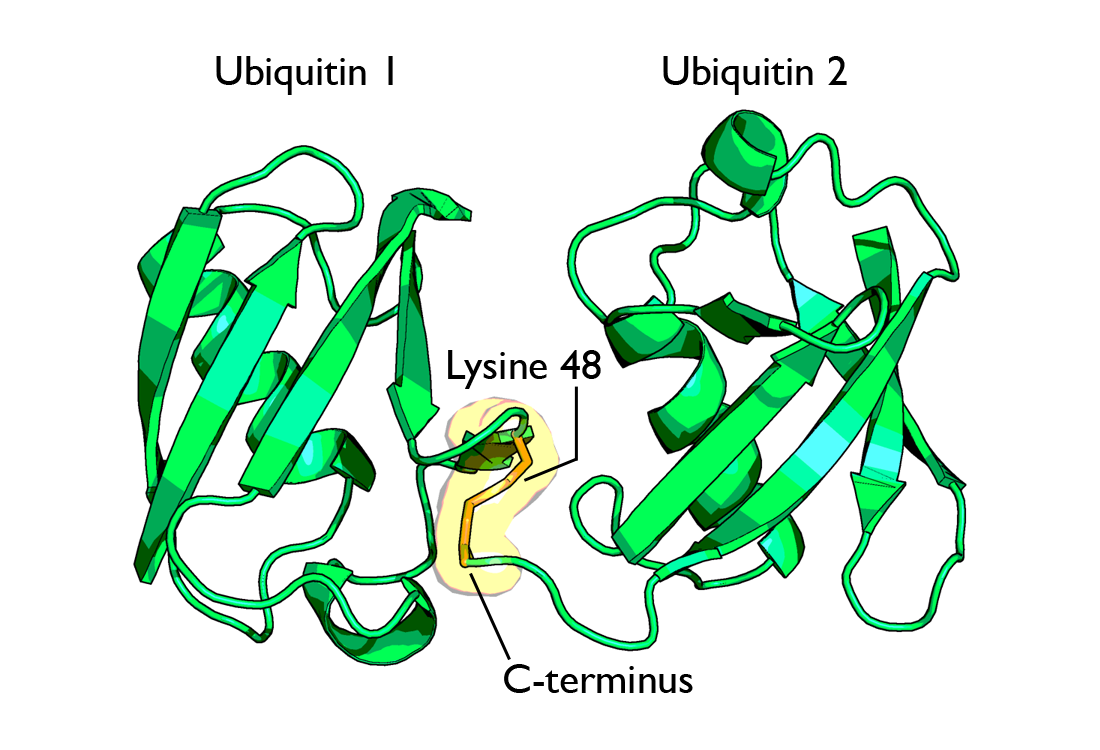
|
|
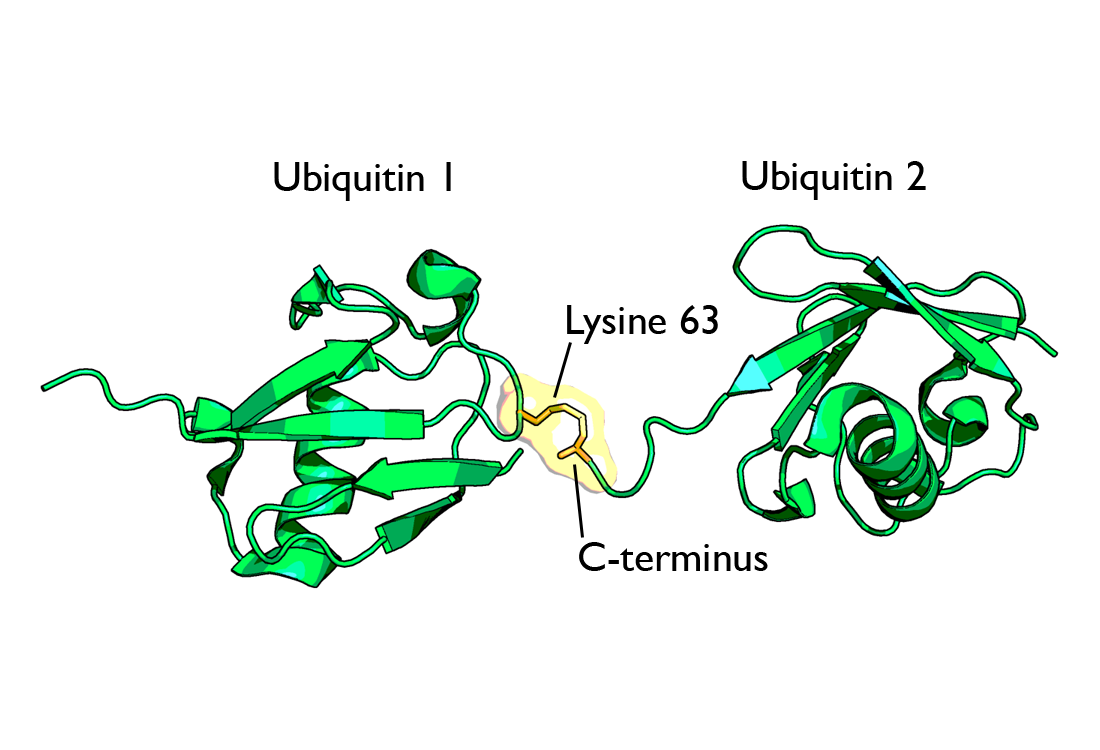
| Рис. 5 [1] Диаграмма диубиквитина, образованного присоединением C-концевого остатка глицина к остатку lys48(слева) и lys63(справа). Оранжевым цветом обозначена связь между двумя убиквитиновыми цепочками. | |
Полиубиквитиновые цепочки, образованные связями различных типов, оказывают
специфичное влияние на белки, к которым присоединены эти цепочки.
Специфика этого влияния обусловлена различиями в конформации белковых цепочек (Рис. 5).
Полиубиквитиновые цепочки, образованные связями через остатки лизина в положениях K29
и K33,[18] K63 и N-терминальные цепочки, по большей части, имеют линейную структуру,
известную как "цепочки открытой конформации" (open-conformation chains). Цепочки,
образованные связями через остатки лизина в положениях K6, K11 и K48, образуют закрытую
конформацию (closed conformations). Молекулы убиквитина в линейных цепочках не взаимодействуют
друг с другом, за исключением соединяющих их ковалентных изопептидных связей.
Напротив, цепочки с закрытой конформацией имеют на своей поверхности остатки аминокислот,
способные взаимодействовать друг с другом. При изменении конформации полиубиквитиновых цепочек
одни части молекул убиквитина выставляются наружу, а другие скрываются внутри глобул, поэтому
различные связи распознаются белками, специфичные по отношению к уникальным топологиям,
характерным для данных связей. Белки, связывающие убиквитин, имеют убиквитин-связывающие домены
(Ubiquitin Binding Domains (UBDs). Расстояния между отдельными субъединицами убиквитина
в цепочках, образованных связями через лизин-48 и в цепочках, связанных через лизин-63,
отличаются друг от друга. UBD-домены белков, связывающихся с убиквитином, используют эти различия
за счет более коротких спейсеров между взаимодействующих с убиквитином мотивов,
связывающихся с лизин-48-связанными (компактными) полиубиквитиновыми цепочками, и более
длинных спейсеров для лизин-63-связанных цепочек. Механизмы, участвующие в распознавании
полиубиквитиновых цепочек, могут также различаться между линейными цепочками, связанными через
лизин-63, и линейными N-терминальными цепочками, о чём свидетельствует тот факт, что линейные
N-терминальные цепочки могут индуцировать протеасомальную деградацию белков-субстратов.
Среди различных поли-убиквитиновых цепей, lys48-связанные известны
как стандартные сигналы деградациии белка. Однако, другие поли-убиквитиновые цепи также участвуют в
протеасомной деградации. Например, lys11-связанные убиквитиновые цепи регулируют ход клетоного
цикла, способствуя деградации митотических белков 26S протеасомой.
|
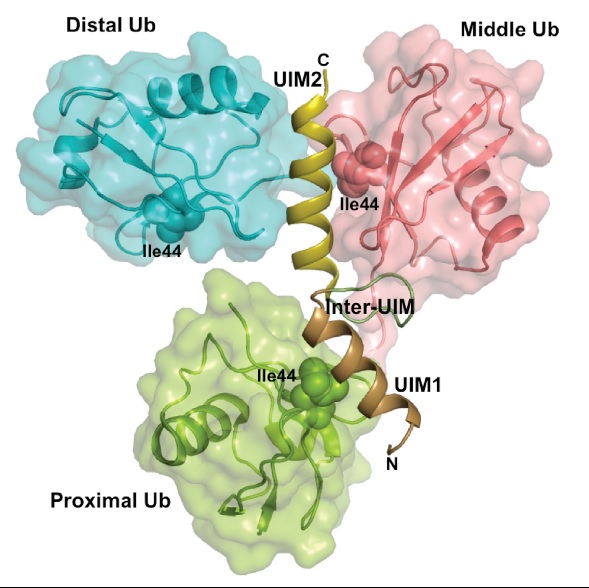
| Рис. 6 [2] Селективное связывание AIRTEL с lys48-связанным триубиквитин цепочками |
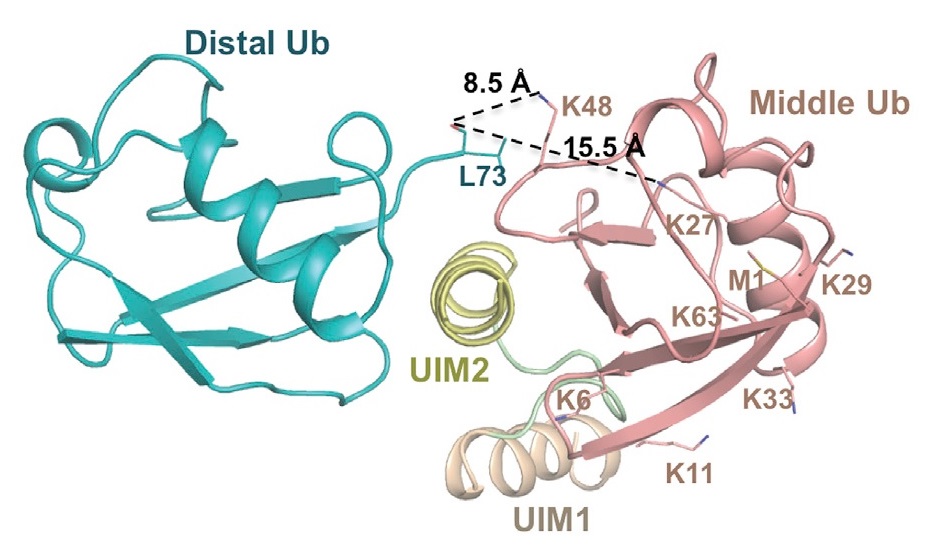
Ориентация убиквитинов позволяет lys48 образовывать связь. Lys48 - ближайший остаток от срединного убиквитина к карбонильной группе leu73. Второй ближайший лизин - lys27. (Рис. 7)
|
| Рис. 7 [2] Место связывания убиквитина |
Лизин часто может являться важным элементом для взаимодействия белковой части фермента с кофактором.
Например, кубический кор пируватдегидрогеназного комплекса (PDH) у грамотрицательной бактерии
Escherichia coli входит 24 копии Е2. К Е2 присоединяется простетическая группа липоат,
которая связывается амидной связью к ε-аминогруппе остатка лизина, входящего в
состав Е2. Е2 состоит из трёх функционально различных доменов: аминотерминального
липоильного домена, содержащего остаток лизина, связывающийся с липоатом; центрального
Е1- и Е3-связывающего домена; внутреннего корового ацилтрансферазного домена, содержащего
активные центры ацилтрансферазы. У дрожжей в PDH имеется единственный липоильный домен,
у млекопитающих — два, а у E. coli — три. Домены Е2 разделаются линкерными последовательностями
аминокислот, состоящими из 20—30 аминокислотных остатков, причём в них остатки аланина и
пролина перемежаются с заряженными аминокислотыми остатками. Такие линкеры обычно принимают
протяжённую форму, тем самым отделяя друг от друга три домена.
С активным центром Е1 связывается ТРР, а с активным центром Е3 — FAD.
У человека фермент Е1 представляет собой тетрамер, состоящий из 4 субъединиц: двух
Е1 и двух Е1. Также в состав комплекса PDH входят два регуляторных белка
— протеинкиназа и фосфопротеинфосфатаза. Такая основная структура из
Е1-Е2-Е3 оставалась консервативной в ходе эволюции.
Комплексы такого устройства принимают участие и в других реакциях, например, окислении
α-кетоглутарата в ходе цикла Кребса и окислении α-кетокислот, образующихся при
катаболической утилизации разветвлённых аминокислот: валина, изолейцина, лейцина.
У изученных видов Е3 PDH идентичен Е3 двух вышеупомянутых комплексов.
Примечательное сходство структур белков, кофакторов и механизмов реакций, осуществляемых
этими комплексами, свидетельствует об общности их происхождения. При прикреплении липоата к
лизину Е2 образуется длинная, гибкая «рука», которая может перемещаться с активного
центра Е1 в активные центры Е2 и Е3, т.е. на расстояния
предположительно 5 нм и более.
Также лизин может присутствовать в самом активном центре, осуществляя катализ.
Так например, многие альдолазы содржат в активном центре боковые группы лизина.
Аминогруппы этих боковых цепей образуют шиффовы основания с кетонными субстратами.
Рассмотри фруктозо-бифосфат альдолазу (FBP-альдолаза). Этот фермент катализирует обратимое превращение
глицеральдегидфосфата и диоксиацетонфосфата в FBP. FBP-альдолаза ускоряет как прямую,
так и обратную реакцию. Поэтому она необходима и для гликолиза, и для глюконеогенеза.
Несмотря на отсутствие FBP-альдолазы, данная реакция у архей все-таки происходит.
Правда, идет она обычно только в одну сторону — от трёхуглеродных молекул к FBP (что характерно
для глюконеогенеза). Биохимики из Фрайбургского университета (Германия) решили выяснить, что же
катализирует эту реакцию у термофильных архей, если у них нет FBP-альдолазы.
Опыты проводились с археями Ignicoccus hospitalis, Metallosphaera sedula и
Thermoproteus neutrophilus, которые живут при температуре 65–85°C.
Впрочем, до сих пор было не совсем ясно, каким образом вообще осуществляется глюконеогенез у
архей, потому что в их геномах отсутствует ген FBP-альдолазы.
Результат оказался неожиданным. Выяснилось, что функцию FBP-альдолазы у этих архей
выполняет другой фермент, который до сих пор был известен как «архейная FBP-фосфатаза
типа IV». FBP-фосфатазы есть у большинства живых существ. Они катализируют следующий шаг
глюконеогенеза — превращение FBP в фруктозо-6-фосфат (реакция 3 на рисунке). В свете новых
данных архейный фермент пришлось переименовать в «FBP-альдолазу/фосфатазу». Интересно, что ранее
этот фермент довольно тщательно изучался, была расшифрована даже его трехмерная кристаллическая
структура. При этом одна из двух его функций до сих пор ускользала от внимания исследователей.
Основу каталитического центра составляют очень консервативные аминокислоты: lys133, lys232 и tyr348.
(Рис. 8)
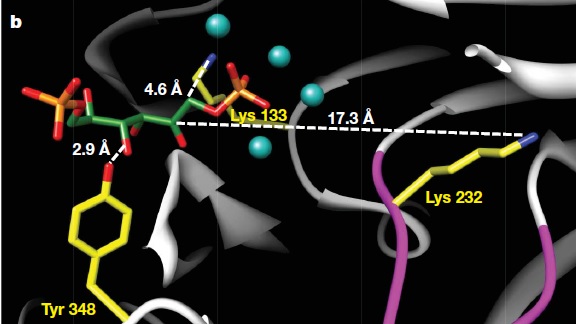
|
| Рис. 8 [2] Каталитический центр FBP-альдолаз/фосфатаз. |
Модификации 1. Метилирование ε-амино группы с образованием метил-, диметил и триметиллизина. Процесс является важным эпигенетическим механизмом, регулирующим связывание гистонов и ДНК в нкулеосомах, таким образом контролируя экспрессию генов. Другие белки тоже метилируются, например кальмодуллин. Метилирование увеличивает эффективный радиус положительного заряда, ослабляя электростатику. Кроме того, процесс влияет на гидрофобные взаимодействия. 2. Ацетилирование с образованием ацетиллизина. Процесс переноса ацетильных групп с ацетил-КоА на остатки лизина катализируется гистонацетилтрансферазами. В отличие от метиллизина, не заряжен. Так же встречается в гистонах (но не только в них) для регуляции экспрессии генов. 3. Присоединение регуляторных белков – убиквитинирование (регуляция распада, локализации белка, а так же белок-белковых взаимодействий) и сумолоилирование (регуляция широкого спектра клеточных процессов, включая экспрессию генов, клеточный цикл, локализацию белков и состояние хроматина) 4. В опсинах наподобие родопсина и зрительных опсинов, ретиналь (пигмент, обеспечивающий светочувствительную реакцию) образует с лизином основание Шиффа. Ряд модификаций происходит при синтезе коллагена: 5. Гидроксилирование 6. О-гликозилирование гидроксиллизина является меткой для секреции белка клеткой 7. Аллизин – производное лизина, получающееся под действием лизилоксидазы на лизин во внеклеточном матриксе при синтезе эластина и коллагена. Необходим для образования межмолекулярных связей.
.- Источники:
- [1] Wikipedia
- [2] Selective Binding of AIRAPL Tandem UIMs to Lys48- Linked Tri-Ubiquitin Chains, Simin Rahighi, Ilana Braunstein, Nicola Ternette and etc.
- [3] Fructose 1,6-bisphosphate aldolase/phosphatase may be an ancestral gluconeogenic enzyme, Rafael F. Say & Georg Fuchs
- [4] "Биохимия" Медлер
- [5] "Основы биохимии" А. Ленинджер
- [6] Protein Data Bank