| ○ Таблица №1 ○ Характеристика аминокислоты | |
| Общее | |
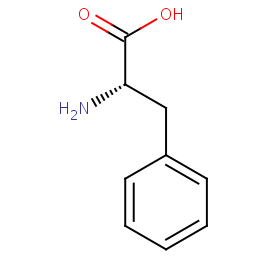
| Тривиальное название | Фениаланин (Phenylalanine) |
| Трехбуквенное обозначение | Фен, Phe |
| Однобуквенное обозначение | F |
| Название по IUPAC | 2-амино-3-фенилпропановая кислота (2-Amino-3-phenylpropanoic acid) |
| Брутто-формула | C9H11NO2 |
| Физические свойства | |
| Молярная масса (г/моль) | 165,18914 C 65,44 %, H 6,71 %, N 8,48 %, O 19,37 % |
| Т.плав | 283°C |
| pKa | 1,83 (карбоксильная группа) 9,13 (амино группа) |
| Изоэлектрическая точка | 5,48 |
| Классификация | |
| PubChem | 6140 - L-phenylalanine 994 - DL-phenylalanine |
| Некоторые биохимические особенности | |
| Кодоны | UUC, UUU |
| Синтез у человека | Незаменимая аминокислота |
| Встречаемость у позвоночных | 4,0% |
|
| Рис. 1 [6] PHE |
Апплет 1
Названия атомов
Апплет 2
Заряженные формы
История
Первый раз описали фенилаланин в 1879 году, когда Шульце и Барбьери выделили соединение с
эмпирической формулой C9H11NO2, в химическом составе саженцев растение люпин желтый
(Lupinus Lutenus). В 1882 году Эрленмейер и Липп впервые синтезировали фенилаланин из
фенилацетальдегида, цианистого водорода и аммиака. Генетический кодон фенилаланина был
впервые обнаружен Дж. Генрихом Маттеи и Маршаллом У. Ниренбергом в 1961 году. Ученые
продемонстрировали, что при использовании м-РНК для вставки нескольких повторений урацила в
геном кишечной бактерии Е.coli, можно вызывать производство бактериями полипептида, состоящего
исключительно из повторяющихся аминокислот фенилаланина [1].
Синтез
У человека и других животных фенилаланин является незаменимой аминокислотой.
Однако прокариоты (бактерии, археи) и некоторые эукариоты (грибы, растения,
некоторые протисты и т.д.) умеют синтезировать эту ароматическую аминокислоту. Все из-за
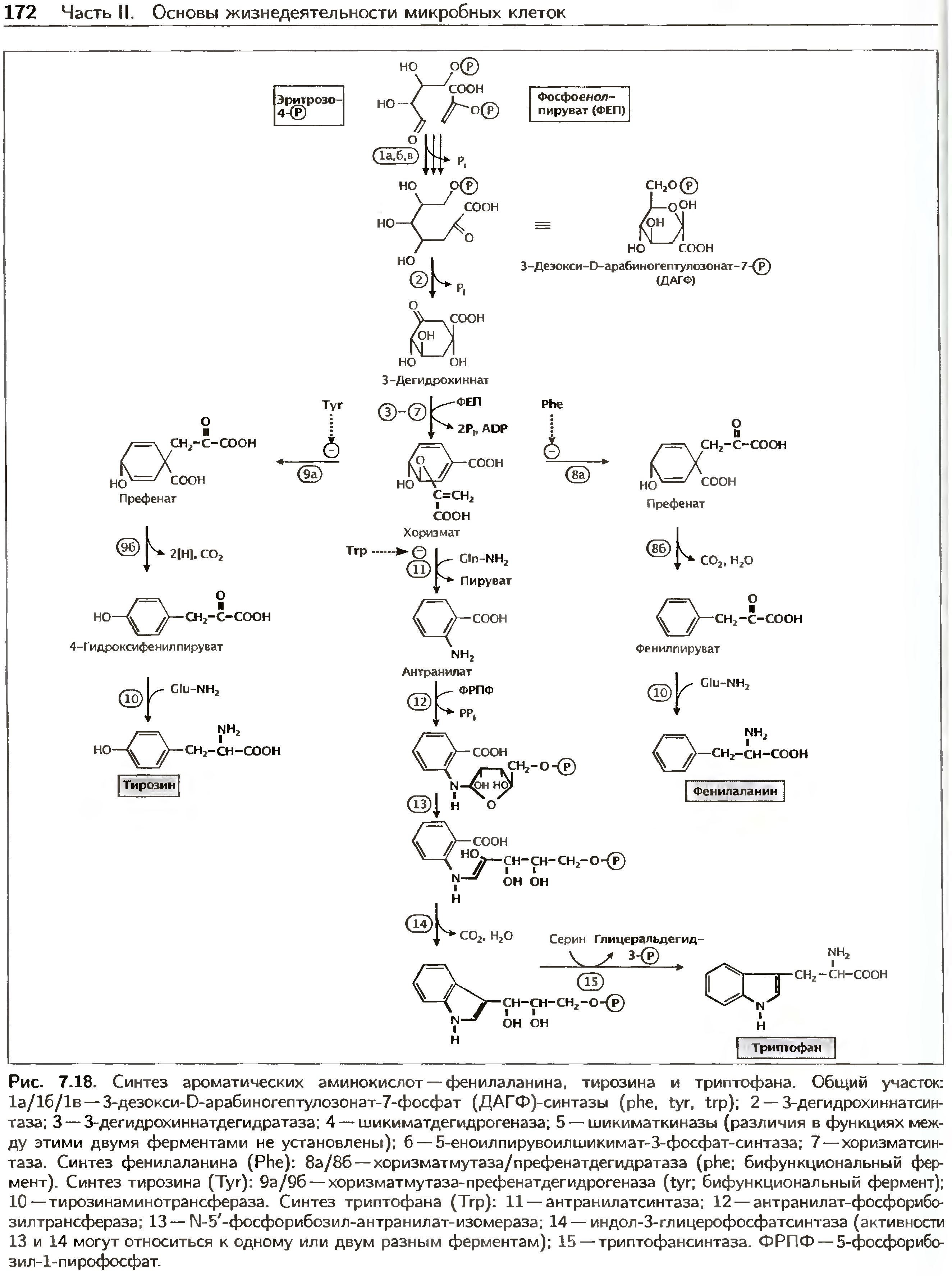
главного этапа синтеза ароматических аминокислот - шикиматного пути, которого у животных нет.
Ароматическое кольцо в составе трех ароматических аминокислот (фениаланин, тирозин, триптофан)
образуеся из эритрозо-4-фосфата и фосфоенолпирувата; С3-боковая цепь поисходит
из фосфоенопирувата. в биосинтезе ароматических аминокислот есть общий участок (шикиматный путь),
который начинается конденсацией двух вышесказанных предшественников с образованием C7-соединения
- 3-дезокси-D-арабиногептулозонат-7-фосфата (ДАГФ); реакцию кондексации катализируют три изофермента
(ДАГФ-синтазы)
Далее происходят циклизация С7-соединения (ДАГФ) с образованием 3-дигидрохинната и
превращения последнего через шикиматную кислоту в хоризмат. После этого этапа пути синтеза
трех ароматических аминокислот расходятся.
мутазная рекция (т.е. внутримолекулярный перенос группы) приводит к образованию из хоризмата префената,
предшественника фенилаланина и тирозина.
промежуточные соединения, образующиеся при синтезе ароматических аминокислот, были индентифицированы
с использованием ауксотрофных мутантов. Единственным веществом из 55 исследованных ароматических
и гидроароматических соединений, способным удовлетворять потребность некоторых ауксотрофных штаммов
E.coli в тирозине, фениаланине и триптофане, оказалась шикимовая кислота.
Как активность, так и синтез каждой из трех ДАГФ-синтаз ингибируется одной
из ароматических аминокислот.
|
| Рис. 2 [2] Синтез PHE |
Катаболизм
|
| Рис. 3 Катаболизм PHE |
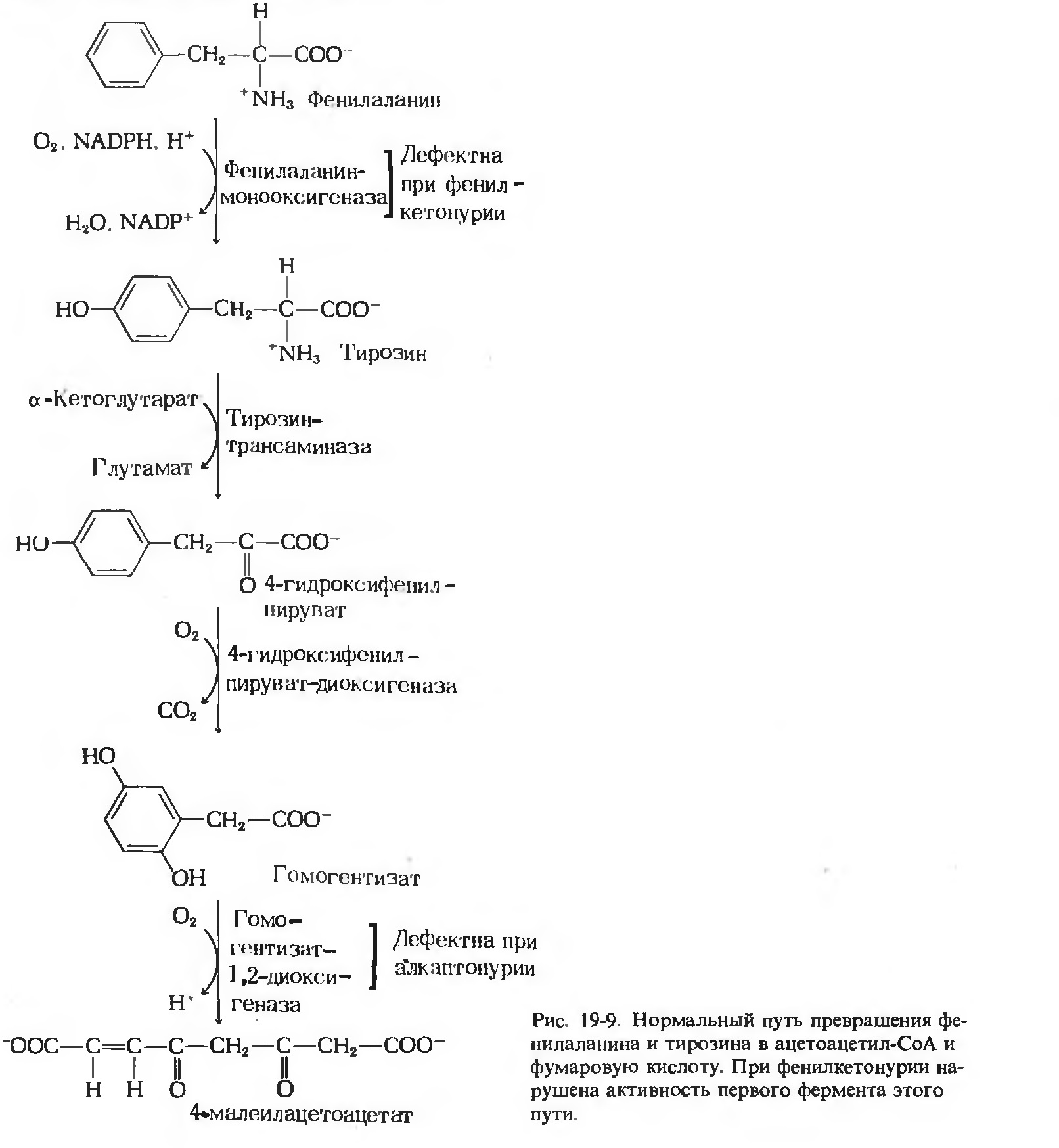
Фрагменты углеродного скелета фениаланина прекращаются в ацетоаце-CoA, из которого затем образуется
ацетил-CoA. Фениаланин распадается на 2 фрагменты; оба они могут вступать в цикл лимонной кислоты,
хотя и на разных уровнях. Четыре из девяти углеродных атомов фениаланина и тирозина дают
свободный ацетоацетат, который затем превращается в ацетил-CoA. Второй четырехуглеродный фрагмент
превращаетсяв фумарат - промежуточный продукт цикла Кребса. Таким образом, 8 из 9 атомов углерода поступают
в цикл лимонной кислоты, девятый отщепляется в виду CO2 [4].
Биологическая роль
Как отдельная аминокислота
Фенилаланин играет огромную роль не только как протеиногенная аминокислота, но
и как предшественник большого числа важных биологически активных веществ.
Из фениналанина синтезируется еще одна протеиногенная аминокислота тирозин. Тирозин (L)
может преобразовываться в L-ДОФА, который может перейти в дофамин, норадреналин и адреналин,
последние три известны как катехоламины. Также из тирозина синтезируется тироксин, гормон
щитовидной железы, и меланины, пигменты.

|
|
Рис. 4 Биосинтез PHE AAAH - биоптерин зависимая гидроксилаза ароматических аминокислот, AADC - дегидроксилаза ароматических L-аминокислот, PMMNT - фенилэтаноламин N-метилтрансфераза, DBH - дофамин бета-гидроксилаза, COMT - катехол-О-метилтрансфераза |
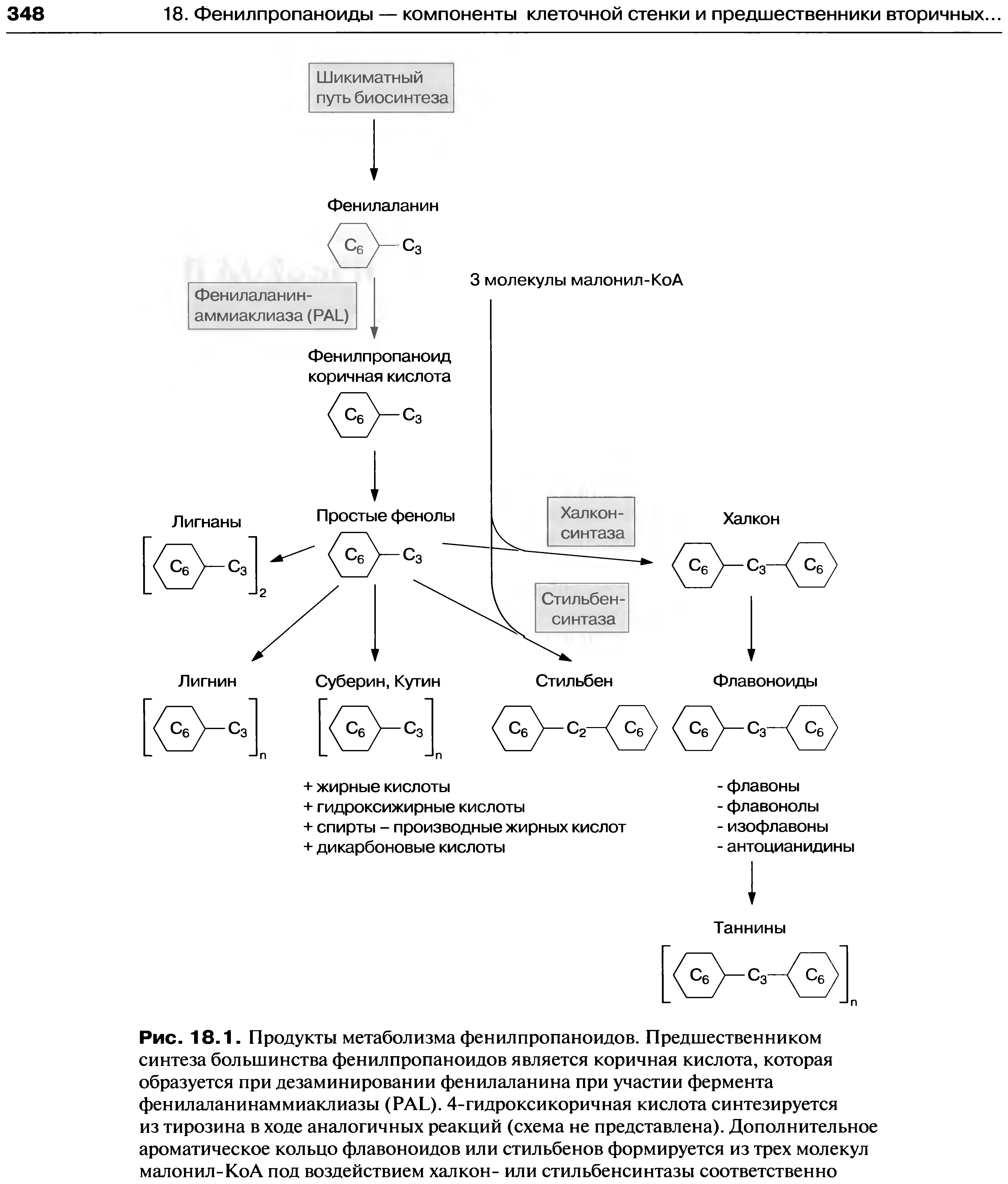
Кроме того фениаланин является основным предшественником синтеза фенольных соединений у растений. Кроме простых фенолов в эту группу входят флавоноиды, стильбены, таннины, лигнаны, лигнин и т.д.. Спектр действия растительных фенолов чрезвычайно разнообразен - фенольные производные могут защищать растительный организм от воздействия ультрафиолетового излучения, выполнять функции природных антибиотиков, пестицидов, сигнальных молекул при симбиотических взаимодействиях, аттрактантовдля привлчения насекомых-опылителей. Кроме того, фенолы укрепляют и изолируют клеточную стенку, уменьшая её газо- и водопроницаемость и увеличивая механическую прочность. Образующиеся в результате синтеза соединения C6-C3-ряда (ароматическое кольцо + боковая цепочка из 3-х дополнительных атомов углерода) носят название фенипропаноидов.
|
| Рис. 5 Продукты метаболизма фенилпропаноидов |
Исходная стадия биосинтеза фенилпропаноидов - дезаминирование фениаланина при участии фермента фениаланинаммиаклиазы (PAL). Отщепление NH2-группы и формирвоание двойной C-C связи приводит к образованию транс-коричной кислоты и выделению NH3, который, возможнов дальнейшем связывается в ходе реакции ассимиляции аммония, катализируемой глутаматсинтетазой. Действие PAL ингибируется образующейся транс-коричной кислотой. Инфицирование растительного организма индуцирует активацию PAL, что приводит к быстрому синтезу фитоалексинов фенольной природы. В настоящее время это наиболее интенсивно изучаемый фермент вторичного метаблизма растений [3].
Дофамин - нейромедиатор, а также гормон, вырабатываемый мозговым веществом надпочечников и некоторыми другими тканями. Дофамин является одним из химических факторов внутреннего подкрепления (ФВП) и служит важной частью «системы вознаграждения» мозга, поскольку вызывает чувство удовольствия (или удовлетворения), чем влияет на процессы мотивации и обучения. Дофамин играет немаловажную роль в обеспечении когнитивной деятельности. Активация дофаминергической передачи необходима при процессах переключения внимания человека с одного этапа когнитивной деятельности на другой. Таким образом, недостаточность дофаминергической передачи приводит к повышенной инертности больного, которая клинически проявляется замедленностью когнитивных процессов (брадифрения) и персеверациями. Данные нарушения являются наиболее типичнымикогнитивным симптомами болезней с дофаминергической недостаточностью — например, болезни Паркинсона. Норадреналин - гормон мозгового вещества надпочечников и нейромедиатор. Считается одним из важнейших «медиаторов бодрствования». Норадренергические проекции участвуют в восходящей ретикулярной активирующей системе. Действие норадреналина связано с преимущественным влиянием на альфа-адренорецепторы. Норадреналин отличается от адреналина гораздо более сильным сосудосуживающим и прессорным действием, значительно меньшим стимулирующим влиянием на сокращения сердца, слабым действием на гладкую мускулатуру бронхов и кишечника, слабым влиянием на обмен веществ (отсутствием выраженного гипергликемического, липолитического и общего катаболического эффекта). Норадреналин в меньшей степени повышает потребность миокарда и других тканей в кислороде, чем адреналин. Норадреналин принимает участие в регуляции артериального давления и периферического сосудистого сопротивления. Например, при переходе из лежачего положения в стоячее или сидячее уровеньнорадреналина в плазме крови в норме уже через минуту возрастает в несколько раз. Норадреналин принимает участие в реализации реакций типа «бей или беги», но в меньшей степени, чем адреналин. Уровень норадреналина в крови повышается при стрессовых состояниях, шоке, травмах, кровопотерях, ожогах, при тревоге, страхе, нервном напряжении. Адреналин - основной гормон мозгового вещества надпочечников, а также нейромедиатор. Адреналин вырабатывается нейроэндокринными клетками мозгового вещества надпочечников и участвует в реализации состояния, при котором организм мобилизируется для устранения угрозы. Его секреция резко повышается при стрессовых состояниях, пограничных ситуациях, ощущении опасности, при тревоге, страхе, при травмах, ожогах и шоковых состояниях. Он вызывает сужение сосудов органов брюшной полости, кожи и слизистых оболочек; в меньшей степени сужает сосуды скелетной мускулатуры, но расширяет сосуды головного мозга. Артериальное давление под действием адреналина повышается. Тироксин - основная форма тиреоидных гормонов щитовидной железы. Является прогормоном к трийодтиронину, более активной форме, конвертирующейся в переферических тканях селен-зависимой монодейодиназой из тироксина, формы, преобладающей в крови. Тироксин влияет на все ткани организма, для него нет специфичных клеток-мишеней. Этот гормон способен проникать через мембрану и соединяться с рецепторами в каждой клетке организма. Основной функцией тироксина является активация процессов метаболизма, которая осуществляется через стимуляцию синтеза РНК и соответствующих белков. Тироксин влияет на обмен веществ, повышает температуру тела, контролирует рост и развитие организма, увеличивает синтез белков и чувствительность к катехоламинам, увеличивает частоту сердечных сокращений, утолщает внутреннюю слизистую оболочку матки у женщин. Усиливает окислительные процессы в клетках всего организма, в частности и клетках мозга. Тироксин важен для надлежащего развития и дифференцировки всех клеток человеческого тела, также может стимулировать метаболизм витаминов. Меланины - природные тёмные пигменты, содержащиеся в коже, волосах, радужной оболочке глаза, тканях, шерсти и т.д..Они определяют цвет этих структур. В головном мозге меланин есть в медулле, голубом пятне, черной субстанции и др., также меланины есть в сетчатой зоне надпочечников. Меланины поглощают ультрафиолетовые лучи, и тем самым защищают ткани глубоких слоёв кожи от лучевого повреждения, уменьшая вероятность рака Другой недавно обнаруженной функцией является усвоение некоторыми грибами ультрафиолетового и гамма-излучения для обеспечения жизнедеятельности. Такая особенность обнаружена у микроскопических Cladosporium sphaerospermum, Cryptococcus neoformans и Wangiella dermatitidis, растущих на руинах реактора Чернобыльской АЭС [1].
Апплет 3
Взаимодействия
В составе белков
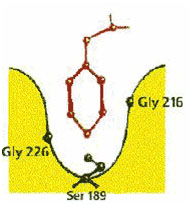
Участвуя в гидрофобных и стэкинг-взаимодействиях, фенилаланин играет значительную роль в фолдинге
и стабилизации белковых структур, является составной частью функциональных центров.
Например, благодаря гидрофобным взаимодействиям происходит реакция
расщепления пептида химотрипсином по ароматическим аминокислотам. По данным рентгено-структурного
анализа альфа-химотрипсин
имеет довольно вместительный "гидрофобный карман",
где связывается ароматическая боковая группа гидролизуемого пептида.
|
| Рис. 6 Продукты метаболизма фенилпропаноидов |
Фениналанин очень распространен в мембранных белках: каналы и т.д., на поверхности,
обращенной к гидрофобному бислою (см. апплет 3).
Также фенилаланин может входить в состав активного центра.
Например, лакказа из Trametes versicolor. Кроме гистидина, аланина и т.д. в активном центре содержится фенилаланин, который осуществляет
пи-стекинг, расположен он с боковой части активного центра (см. апплет 3). Он может обеспечивать
гибкость в связывании и вместить как фенольные, так и не фенольные фрагменты лигнина [5].
Заболевания
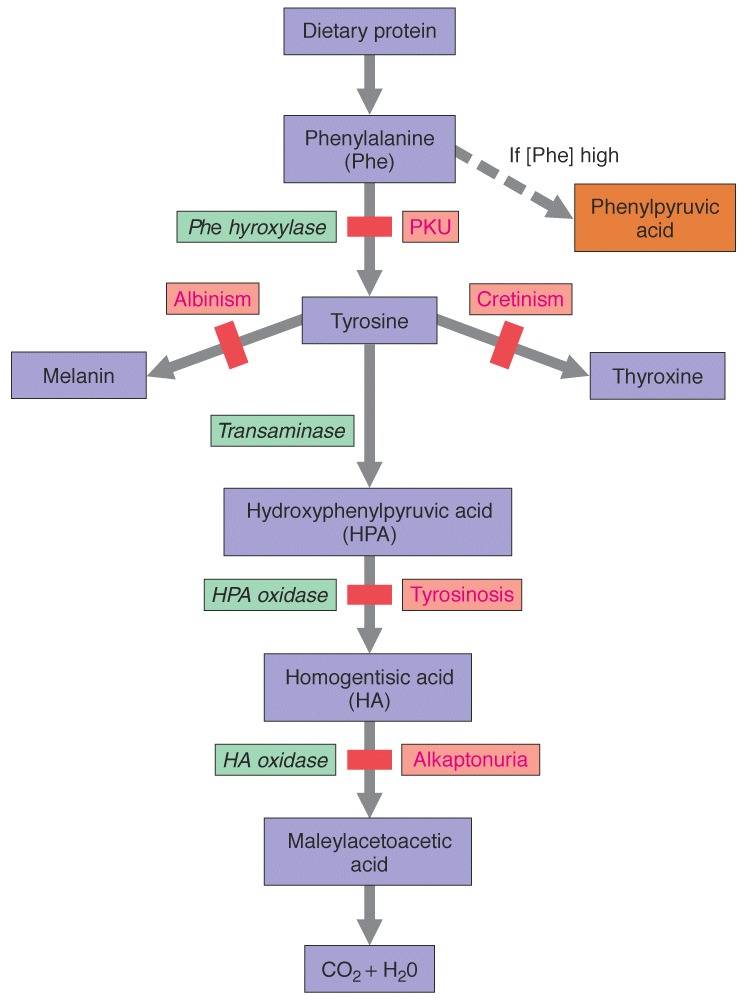
|
| Рис. 7 Заболевания |
Заболевание, вызванное дисфункией фермента фениаланин гидроксилазы на самом раннем этапе превращения фениаланина - фенилкетонурия (PKU) Сопровождается накоплением фенилаланина и его токсических продуктов: фенилпировиноградной и фениломолочной кислот. Кроме того, образуются также почти полностью отсутствующие в норме фенилэтиламин и ортофенилацетат, избыток которых вызывает нарушение метаболизма липидов в головном мозге. Предположительно, это и ведёт к прогрессирующему снижению интеллекта у таких больных вплоть до идиотии. Альбизим - Заболевание обусловлено полным или частичным дефектом синтеза фермента тирозиназы (частота 1:20000), необходимой для синтеза диоксифенилаланина в пигментных клетках. При полном отсутствии фермента – тотальная депигментация кожи, волос, глаз, причем окраска одинакова для всех расовых групп и не меняется с возрастом [4]. Алкаптонурия - генетическая аутосомно-рецессивная энзимопатия. В основе заболевания лежит снижение активности печеночного фермента гомогентизат-оксидазы, в результате в организме накапливается гомогентизиновая кислота. Одновременно гомогентизиновая кислота ингибирует лизилгидроксилазу, препятствуя синтезу коллагена, что делает хрупкими хрящевые образования. К пожилому возрасту наступает дегенеративный артроз позвоночника и крупных суставов. Тирозинемия - результат недостаточности гидроксифенилпируват-гидроксилазы. Чаще наблюдается у недоношенных детей. Наблюдается сниженная активность и летаргия. Аномалия считается безвредной. Дефицит аскорбиновой кислоты усиливает клиническую картину [1].