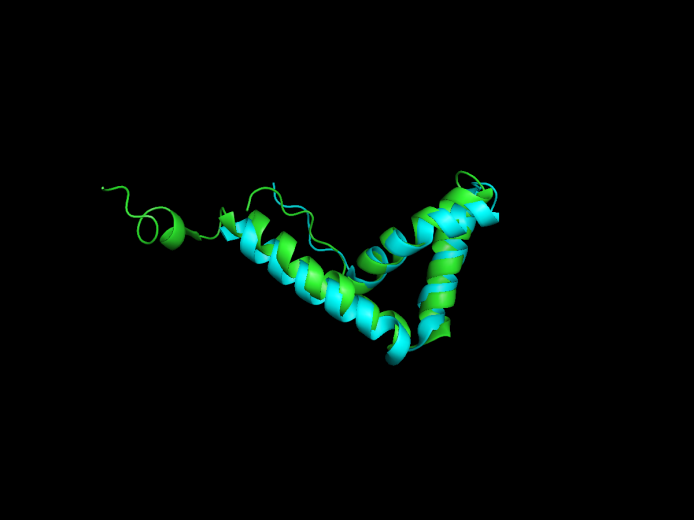
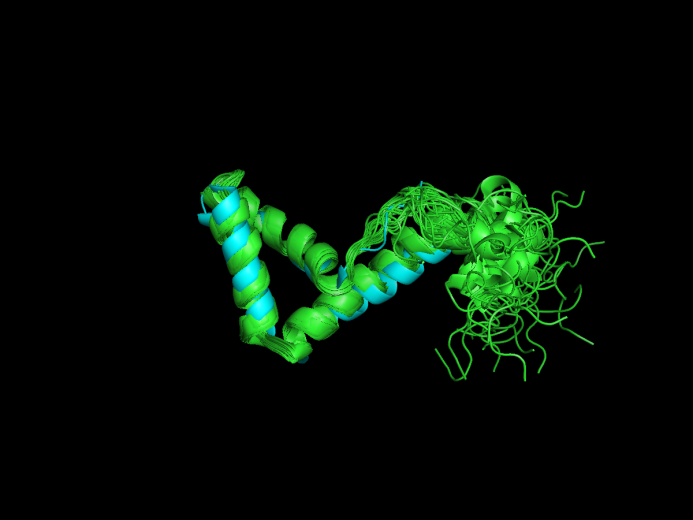
Сравнение ЯМР- и РСА-структур одного белка
|
|
|
Рис. 1. Наложение структур, полученных методами РСА (показано голубым) и ЯМР (показано зеленым)
Будем считать, что между донором и акцептором протона есть водородная связь, если расстояние между ними не превышает 3,5 Å.
Для анализа были выбраны 3 водородные связи: остовная в альфа-спирали (рис. 2), водородная связь между остатками боковых цепей, не выходящая на поверхность (рис. 3) и водородную связь остатков в петлях, выходящую на поверхность глобулы (рис. 4):
1) GLU`59(N)—3.0 Å—(O)LYS`55
2) THR`41(О)—3.3 Å—(О)TYR`23
3) LYS`9(N)—3.3 Å—(O)GLN`17, соответсвенно.
|
|
|
Рис. 2. Водородная связь между GLU`59(N) и (O)LYS`55; слева – общий вид структуры, справа - крупное изображение а.о., образующих связь; длина связи указана в Å
|
|
|
Рис. 3. Водородная связь между THR`41(О) и (О)TYR`23; слева – общий вид структуры, справа - крупное изображение а.о., образующих связь; длина связи указана в Å
|
|
|
Рис. 4. Водородная связь между LYS`9(N) и (O)GLN`17; слева – общий вид структуры, справа - крупное изображение а.о., образующих связь; длина связи указана в Å
|
Таблица №1. Сравнение водородных связей в РСА- и ЯМР-структурах |
|||||||
|
№ |
Остатки |
Описание |
Длина
связи, Å |
Число
моделей со связью |
Min
длина связи, Å |
Max
длина связи, Å |
Median
длина связи, Å |
|
1 |
GLU`59(N)—(O)LYS`55 |
Остов альфа-спирали |
3.0 |
1 (3%) |
3.5 |
3.5 |
3.5 |
|
2 |
THR`41(О)—(О)TYR`23 |
Боковые цепи в ядре белка |
3.3 |
0 (0%) |
- |
- |
- |
|
3 |
LYS`9(N)—(O)GLN`17 |
Боковые цепи петли на поверхности белка |
3.3 |
0 (0%) |
- |
- |
- |
Видно, что в ЯМР-структуре из рассмотренных водородных связей присутствует только связь между атомами в области с консервативной, жесткой структурой - альфа-спирали, однако всего в одной из 30 моделей. Связи между а.о. в подвижных участках белка не совпадают в РСА- и ЯМР-структурах.