Гидрофобные
кластеры
Гидрофобные
кластеры в структуре белка
Для
поиска гидрофобных кластеров в структуре
альдегид-деформилирующей оксигеназы
(PDB ID 4quw) использовался CluD.
Белок
представляет собой мономер и образован
8ю альфа-спиралями (рис. 1). 6ти консервативных
аминокислот из 4х альфа-спиралей образуют
пучок, в котором расположен центр
связывания ионов Fe2+.
Важной частью является гидрофобный
канал, в котором субстрат удерживается
и через который проходит к активному
центру, образованный почти всеми
альфа-спиралями. При связывании субстрата
происходит закрывание входа в канал.
Наша изучаемая структура как раз
соответствует конформацией белка с
закрытым гидрофобным каналом!
Мне
кажется, что стоит логично выделять 3
крупных кластера, первый образует
активный центр и часть гидрофобного
канала (со стороны оранжевой, красной
и фиолетовой спиралей), второй – формирует
часть канала с другой стороны (со стороны
синей спирали, и располагается в
пространстве между желтой, зеленой и
бирюзовой спиралями) и третий, образованный
замкнувшимися остатками на входе в
канал при связывании субстрата (с
противоположной от смотрящего стороны).
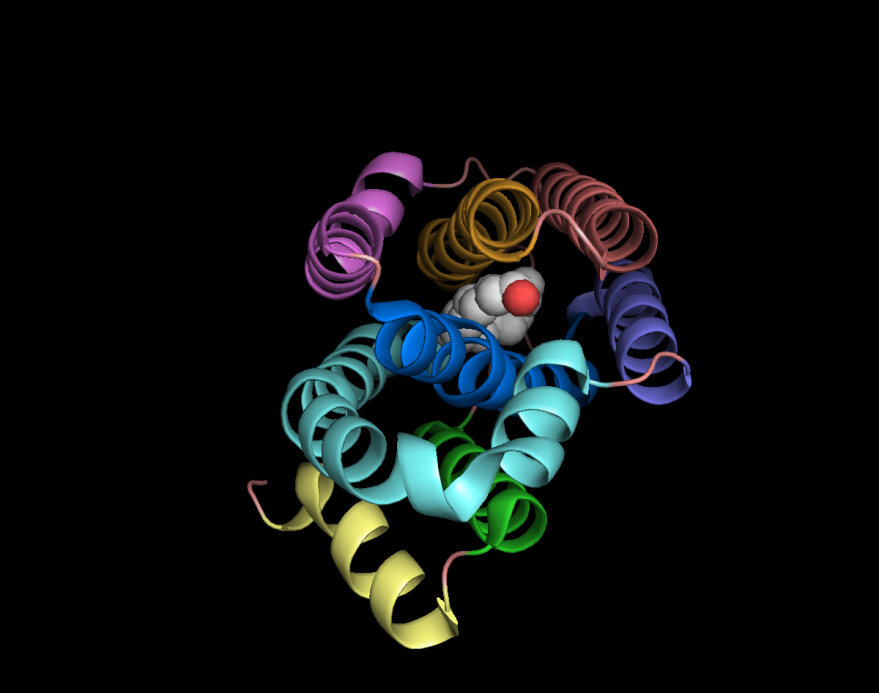
Рис. 1.
Структура альдегид декарбонилазы;
альфа-спирали выделены разными цветами;
субстрат (показан шариками) связан в
гидрофобном канале белка
В
результате работы программы с параметрами:
минимальный
размер кластера = 50 атомов и distance threshold
= 4.5 Å, был получен набор гидрофобных
кластеров (рис. 2), соответствующих
ожидаемым.
Рис.
2.
Найденные
гидрофобные кластеры в молекуле альдегид
декарбонилазы.
Сверху слева показаны все 3 крупных
кластера; сверху справа убран кластер,
образованный замкнувшимися остатками
на входе в канал, и видны ворота в активный
центр фермента; снизу показан кластер,
формирующий активный центр. Субстрат
показан шариками
Получилось,
что бежевый кластер состоит из 193 атомов,
розовый - из 70, фиолетовый – из 64. Если
же изменить минимальный
размер кластера с 50 на 5 атомов, то
алгоритм находит три вышеописанных
кластера без изменений, но кроме того,
6 маленьких кластеров на поверхности
белка (ссылка).
Можно предположить, что такие гидрофобные
области играют роль в узнавании
субстратов, аллостерических регуляторов
и молекул, принимающих участие в реакции.
Гидрофобные
кластеры на интерфейсе двух цепочек
Затем
был осуществлен поиск гидрофобных
кластеров в структуре лактат дегидрогеназы
(PDB
ID
3WWY).
Поскольку этот белок представляет собой
гомодимер, то было логично ожидать
симметричное расположение гидрофобных
кластеров. Однако, гидрофобный кластер,
располагающийся в области взаимодействия
двух молекул белка, так или иначе эту
симметрию нарушает.
Для
начала рассмотрим гидрофобные кластеры
в одной молекуле (цепь А), принимая
минимальный размер кластера = 50 атомов
и distance threshold = 4.5 Å. На рисунке 3 (сверху)
представлена структура мономера белка,
синим выделены бета-листы. Молекула (на
глаз) состоит из 2х аналогичных блоков:
разделенных на 2 части бета-листами
карманов, образованных альфа-спиралями.
Таким образом, мне кажется логичным,
что отдельные гидрофобные кластеры
расположены в таких областях между
спиралями и листом (рис. 3, посередине).
На
рисунке 3 снизу представлена структура
одной цепи дегидрогеназы с обозначенными
гидрофобными кластерами.
Рис.
3.
Гидрофобные кластеры в одной молекуле
(цепь А) при distance threshold = 4.5 Å
Таким
образом, от димера я ожидала похожего
расположения кластеров (кроме участка
взаимодействия цепей).
При
использовании настроек по умолчанию
программа выдавала один огромный кластер
на весь белок и множество совсем
маленьких, что никак не соответствует
доменной структуре.
Для
димера я подобрала 2 набора параметров:
минимальный
размер = 50 атомов, distance threshold = 4.5 Å (рис.
4);
минимальный
размер = 50 атомов, distance threshold = 4.4 Å (рис.
5).
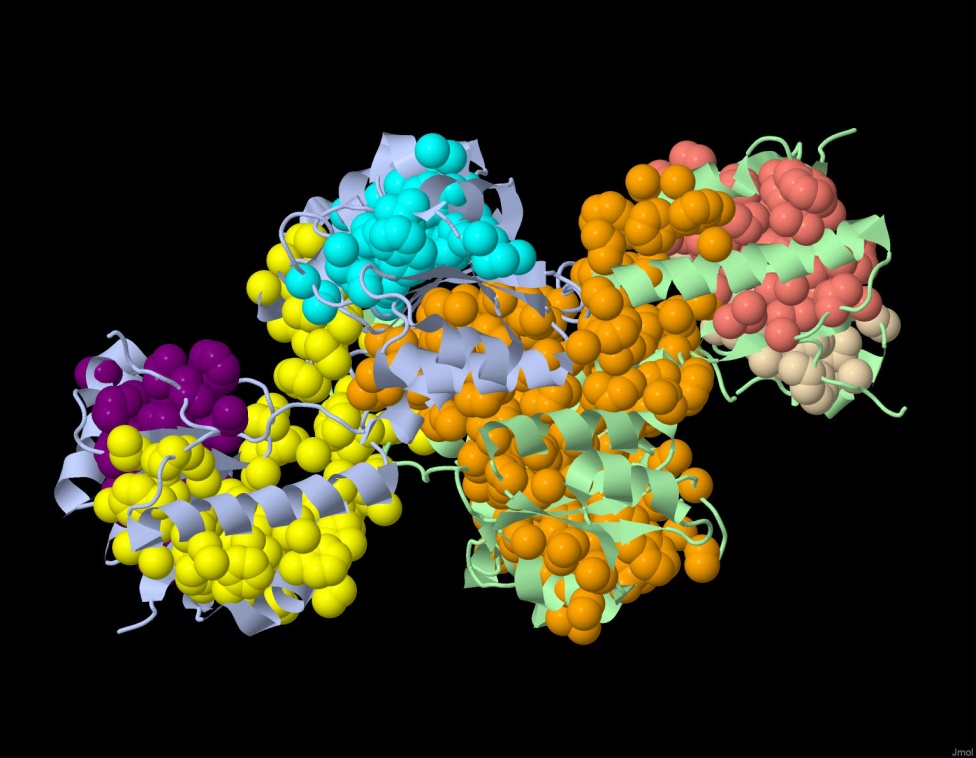
Рис.
4.
Найденные гидрофобные кластеры при
distance threshold = 4.5 Å
В
первом случае получилось 6 кластеров,
во втором – 8. Самый крупный гидрофобный
кластер при distance threshold = 4.5 Å (показан
оранжевым) располагается примерно в
центре димера и «связывает» 2 молекулы.
Расположение более мелких кластеров
не симметрично и не соответствует
логике, описанной выше. Плюс такого
набора гидрофобных кластеров заключается
в том, что крупные кластеры охватывают
всю молекулу белка.
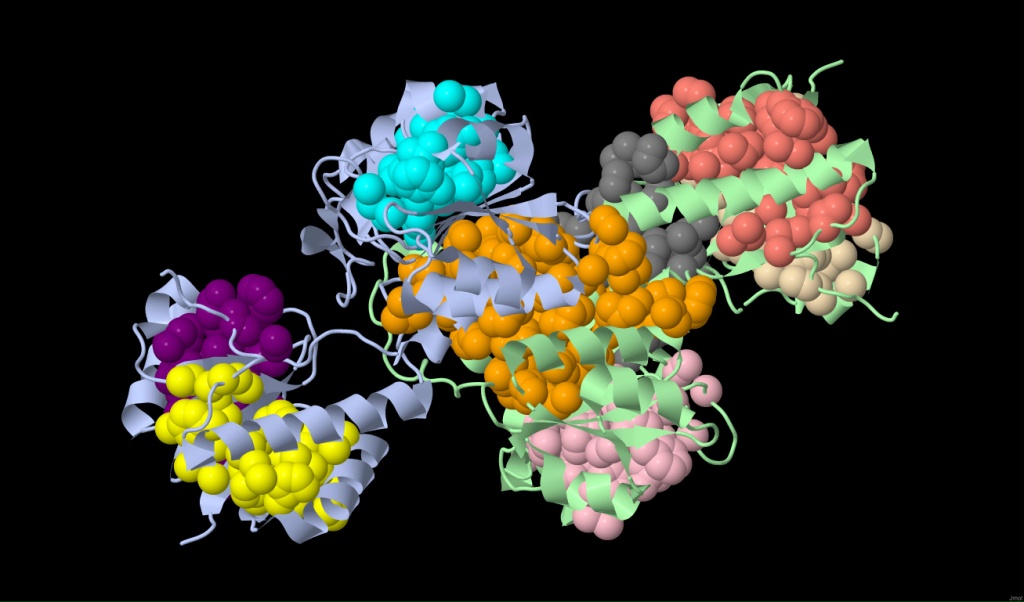
Рис.
5.
Найденные гидрофобные кластеры при
distance threshold = 4.4 Å
Во
втором случае получилось больше мелких
кластеров. Видно, что оранжевый кластер
из рис. 4 «распался» на меньший по размеру
оранжевый (176 атомов), серый и розовый.
В данной структуре сильнее заметна
симметрия: фиолетовый-пшеничный,
малиновый-желтый, голубой-розовый; также
оранжевый гидрофобный кластер
располагается более-менее в центре
между двумя цепями (рис. 5; 82 атома
принадлежат цепи А, 94 – цепи В). Тем не
менее целый участок цепи А (показан
голубым) остается «голым», что, как мне
кажется, не соответствует действительности.
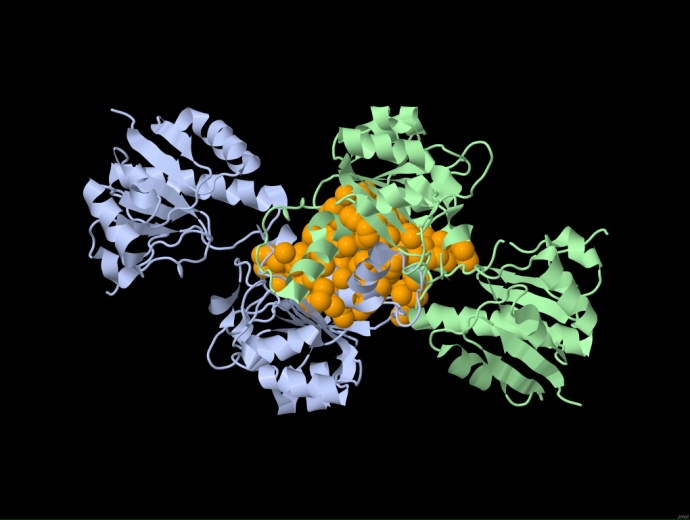
Рис.
6.
Гидрофобный кластер, расположенный
между цепями белка, найденный при
distance threshold = 4.4 Å
Судя
по всему, в формировании димера лактат
дегидрогеназы гидрофобные взаимодействия
играют большую роль, поскольку при
различных вариациях параметров программа
находила большой кластер между цепями
белка (рис. 6).




