Cytochrome C (isolated from Rhodothermus marinus)
Введение
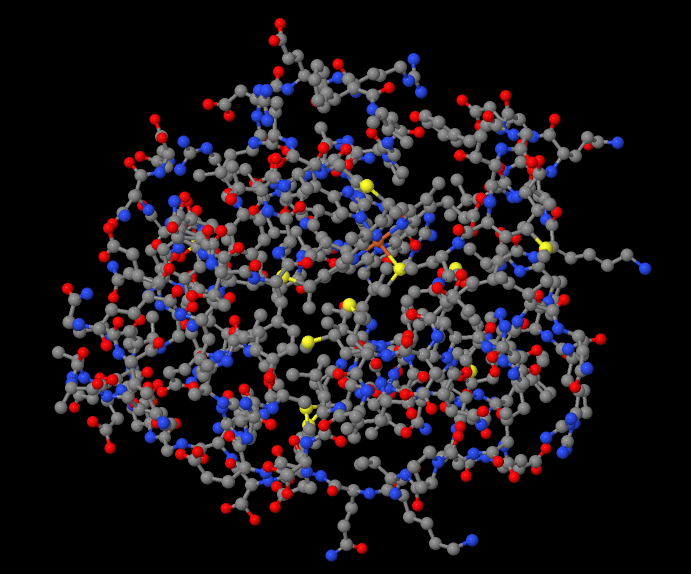
В данной работе исследуется гем-содержащий белок цитохром С из бактерии Rhodothermus marinus. Проводится анализ различных взаимодействий аминокислотных остатков между собой, с лигандом, а также с молекулами окружения: установление природы взаимодействия, его роли, а также определение его геометрических характеристик.
Общая информация о белке
PDB ID:3CP5
UNIPROT ID: B3FQS5
Расположение в клетке: белок располагается на внутренней мембране бактерии, гомологичный белок эукариот располагается на внутренней мембране митохондрий.
Функциональная роль: является переносчиком электрона в электрон-транспортной цепи между III (убихинол-цитохром c оксидоредуктаза) и IV (цитохром c оксидаза) белковыми комплексами. Также белки из семейства цитохромов непосредственно вовлечены в механизм апоптоза у эукариот. Митохондриальный сигнальный путь апоптоза запускается, при повышении проницаемости мембраны митохондрий. При этом цитохром C выходит в цитоплазму клетки, где связывается с 7 субъединицами белка APAF-1 и прокаспазами 9. Формируется апоптосома, которая активирует каспазу 9 и таким образом запускает каспазный каскад.
Структура: белок состоит из одной цепи. В структуре белка присутствуют 7 альфа-спиралей, бета-листов нет. Сам белок является водорастворимым, что позволяет ему находиться в межмембранном пространстве.
(Дальнейшая информация относится к человеческому цитохрому C)
При участии в окислительно-восстановительных процессах, цитохром C претерпевает ряд конформационных изменений, которые определяют его взаимодействия с комплексами дыхательной цепи и зависят от того, находится белок в окисленном или восстановленном состоянии. Изменения структуры носят, в основном, локальный характер и относятся к отдельным регионам, при этом структура в общем меняется слабо. Наибольшее количество изменений происходит в 3 петле. Изменения, происходящие в 3 петле, а также остатках 12-16, 79-82 определяют взаимодействия с цитохром C-оксидазой[4]
Описание лигандов
Гем C - простетическая группа белка, имеет в составе атом железа, принимающий и отдающий электрон в ходе окислительно-восстановительных процессов, в которых он участвует. Название по IUPAC: {3,3'-[3,7,12,17-тетраметил-8,13-бис(1-сульфанилитил)порфирин-2,18-диил-каппа(4)N(21),N(22),N(23),N(24)]дипропаноат(2-)}железо.
Идентификатор PubChem: 51351657
Молярная масса: 684.7 г/моль
Брутто-формула: C34H36FeN4O4S2-2
Изображение белка:
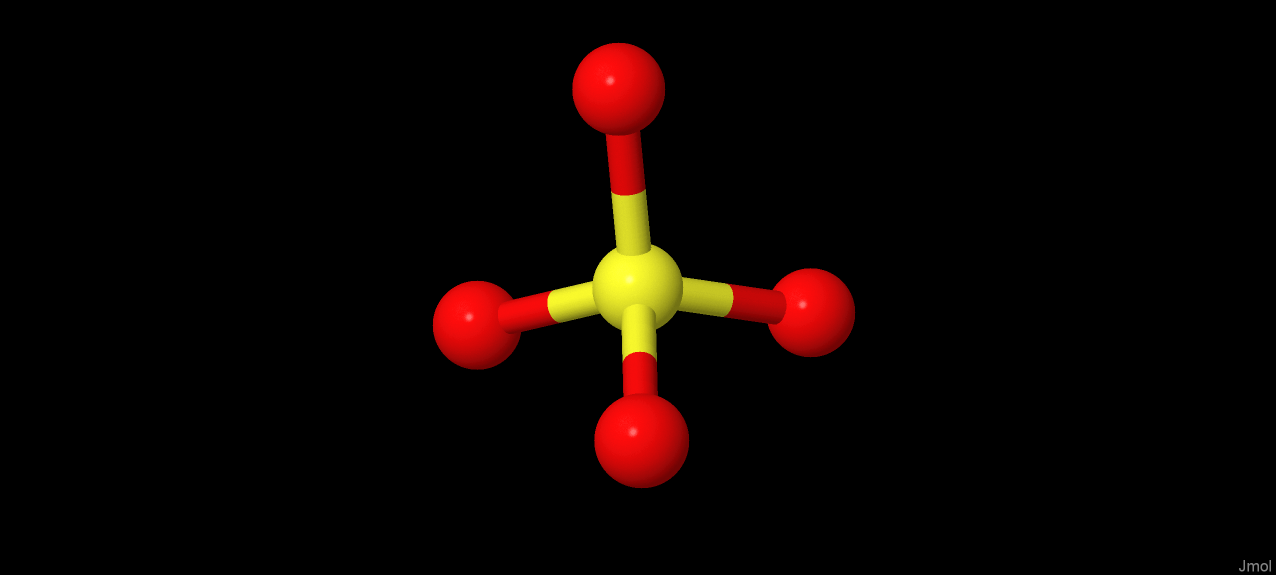
Также в структуре присутствует сульфат-ион, образующий водородную связь с Glu122, при этом он не участвует в выполнении функций белка, а является артефактом кристаллографии. Его функция - агрегация молекул в кристалле.
Идентификатор PubChem: 1117
Молярная масса: 96.07 г/моль
Брутто-формула: O4S2-
Химическая формула:
Контакты
Основные
Водородные связи
В белке присутствует 12 водородных связей между парами боковых цепей, 5 из которых установлены между N-концевой A’ и соседними C и D альфа-спиралями. На апплете показаны сами спирали A', C и D. Их местоположение и взаимная ориентация были восстановлены по рис. 4(А) из [1]. Водородные связи между альфа-спиралями не выявляются с помощью команды "calculate hbonds", так что была совершена попытка найти их, измеряя расстояния между атомами, способными образовывать водородную связь. Результаты измерений соответствуют нормальной длине водородной связи (от 2.7 до 3.3 ангстрем)[2].
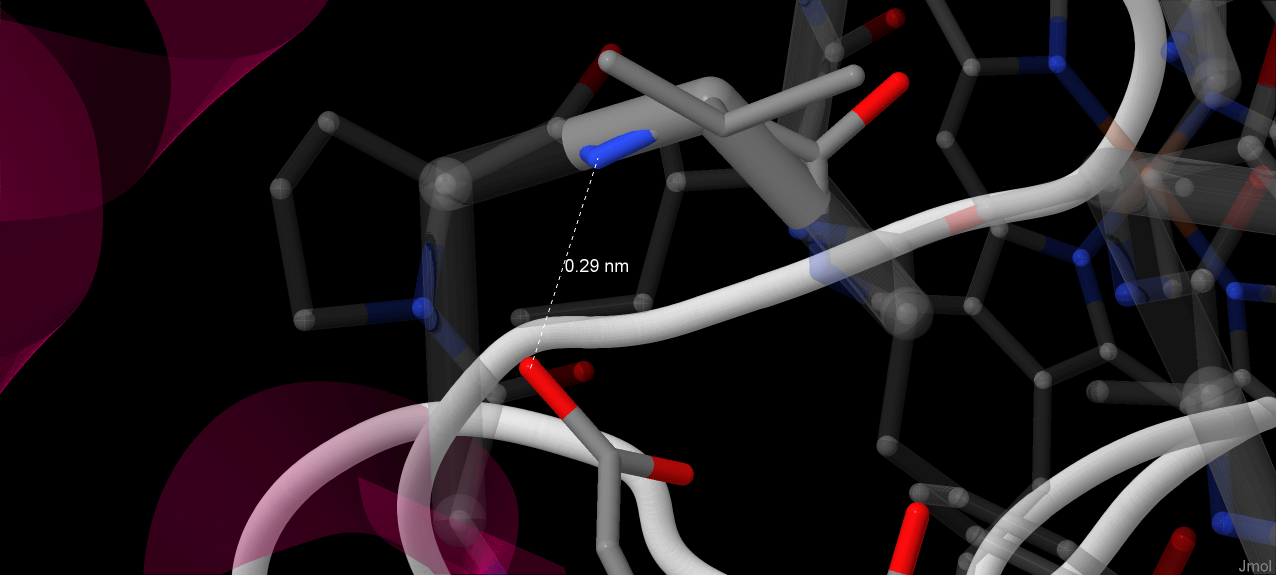
Солевые мостики
Данные получены путем поиска заряженных аминокислот, измерения расстояния между их атомами и были подтверждены с помощью этого сервиса. Все измеренные значения лежат в пределах 4А, что соответствует нормальной длине солевого мостика [3]. На апплете также показана совокупность заряженных аминокислот: Arg, Lys, Asp, Glu, His.
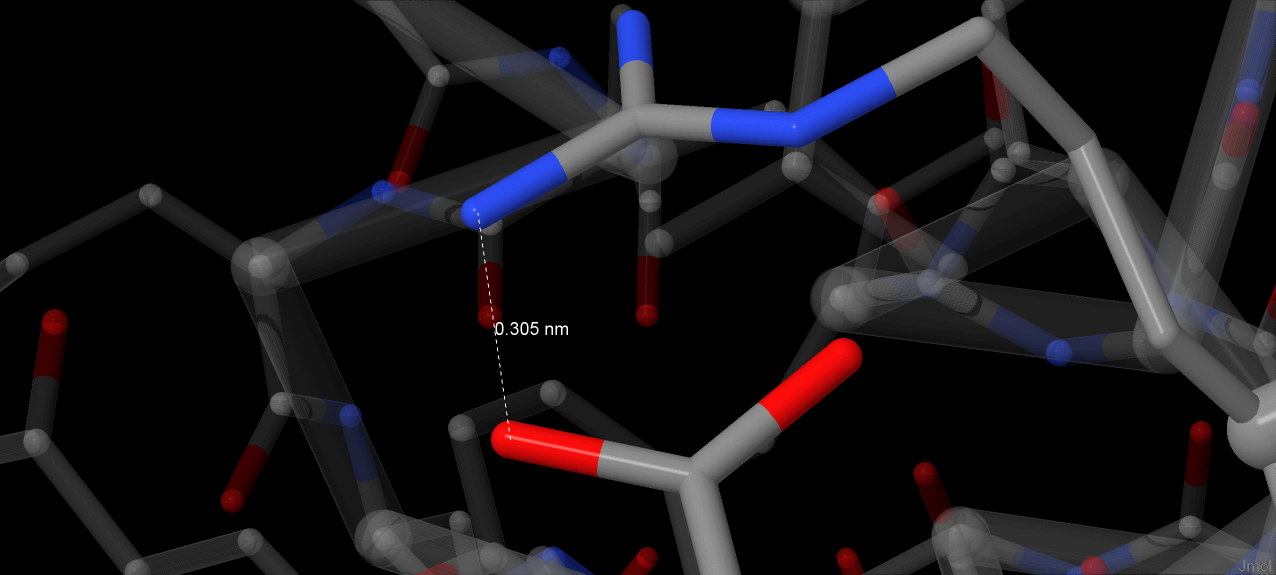
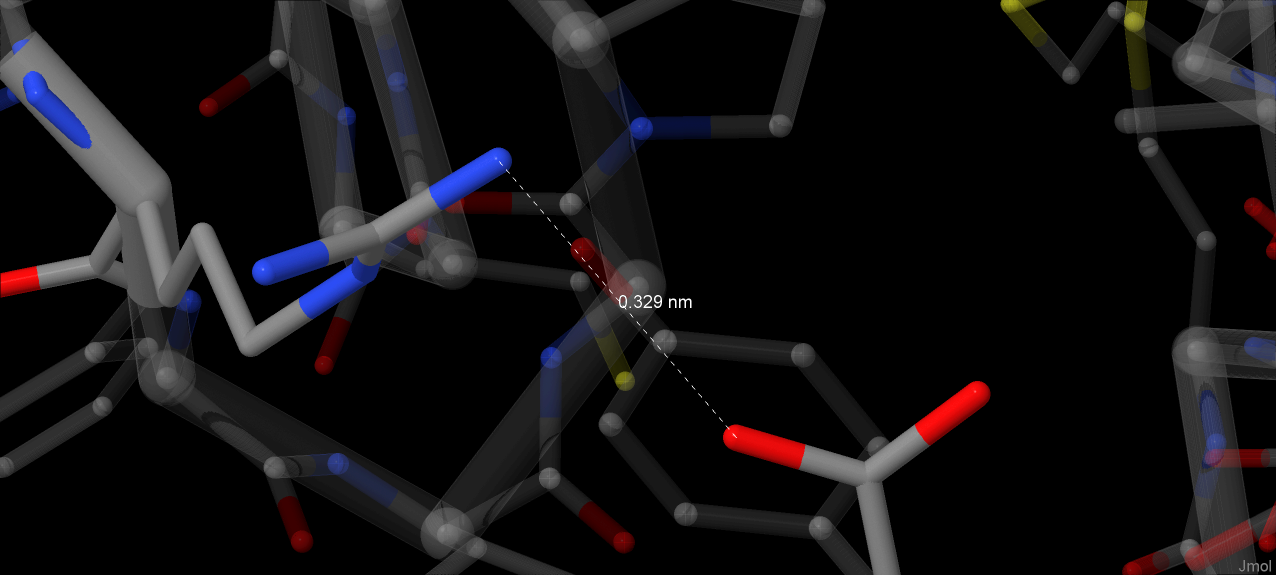
Плотность упаковки в гидрофобном ядре
Начиная с радиуса в 6Å, плотность упаковки увеличивается, однако даже в радиусе 7Å находится недостаточно атомов, чтобы окружить остаток полностью.
Характерное расстояние между двумя атомами в белке, не связанными ковалентно, - это сумма ван-дер-ваальсовых радиусов.
Ниже в таблице представлены расстояния в Å между атомами в белке. Для рассчета были использованы следующие значения ван-дер-ваальсовых радиусов: углерод - 1.85Å, азот - 1.54Å, кислород - 1.4Å, сера - 1.85Å [5].
Теоретически, между двумя атомами мог бы поместиться еще один, чей диаметр меньше расстояния между ними, но в реальности это невозможно из-за взаимного отталкивания электронных оболочек.
| Расстояния между двумя атомами в белке | ||||
| C | N | O | S | |
| C | 3.7 | |||
| N | 3.39 | 3.08 | ||
| O | 3.25 | 2.94 | 2.8 | |
| S | 3.7 | 3.39 | 3.25 | 3.7 |
Лиганд-биомолекулярные контакты
Ковалентные связи
Cys45, Cys48 - обеспечивают связь с гемом путем образования тиоэфирных связей с второй и четвертой боковыми винильными цепями[1] Ковалентная связь показана на апплете.
Координация
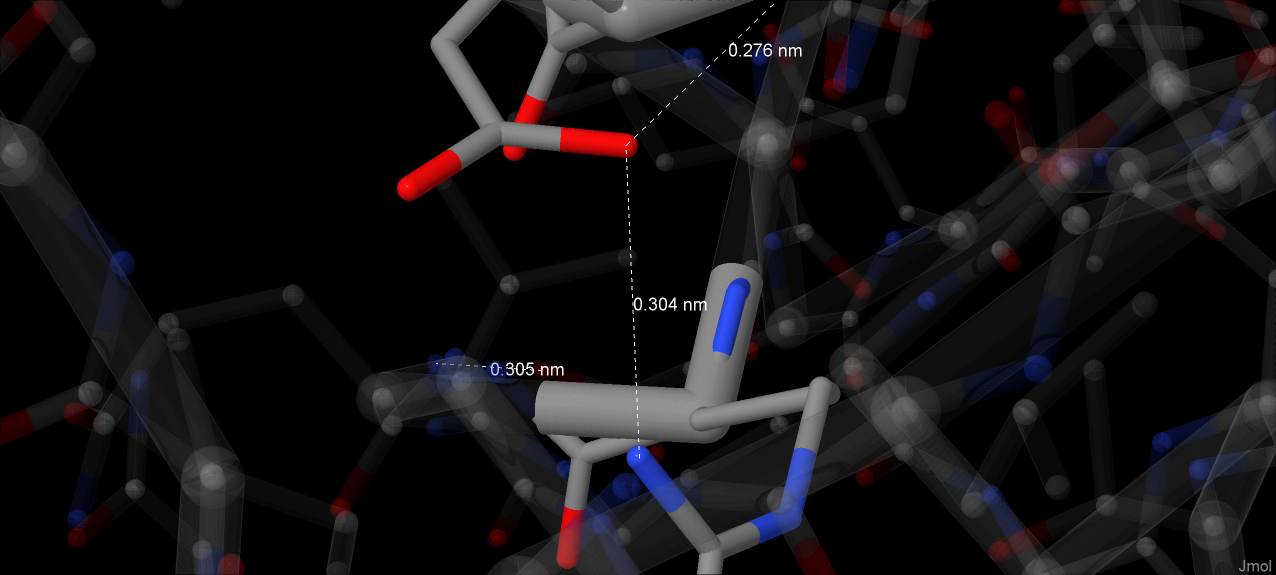
His49, Met100 координируют ион Fe(III) - координационные связи обеспечиваются атомом NE2 и атомом серы SD соответственно[1]. Длины координационных связей равны 0.202 нм (2.02А) и 0.234 нм (2.34А) соответственно.
Другое
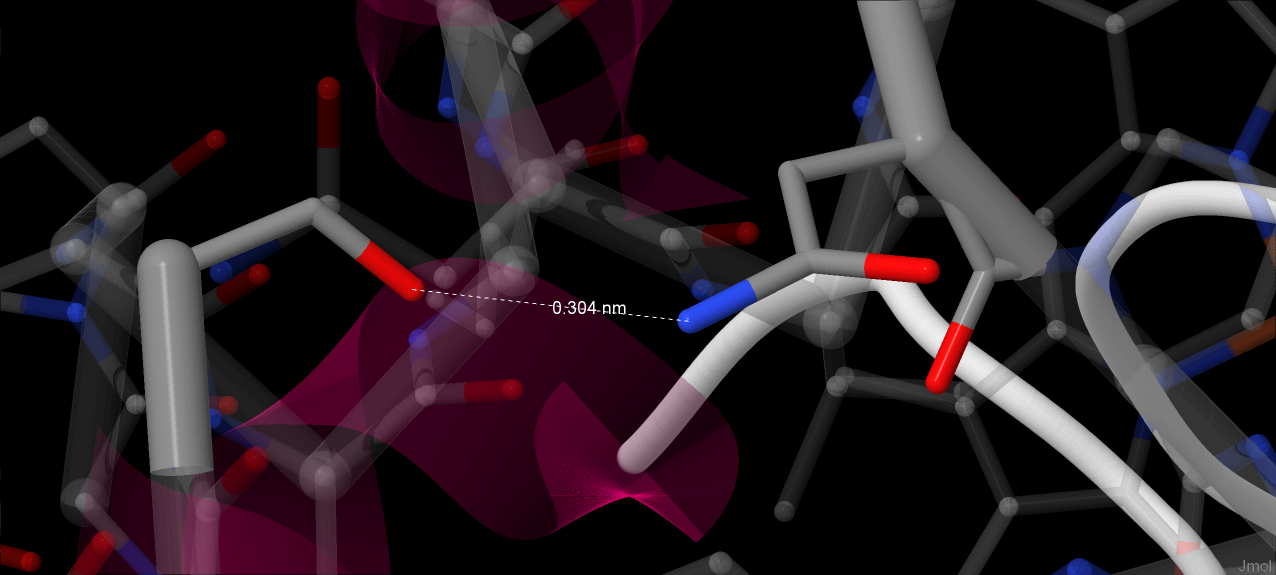
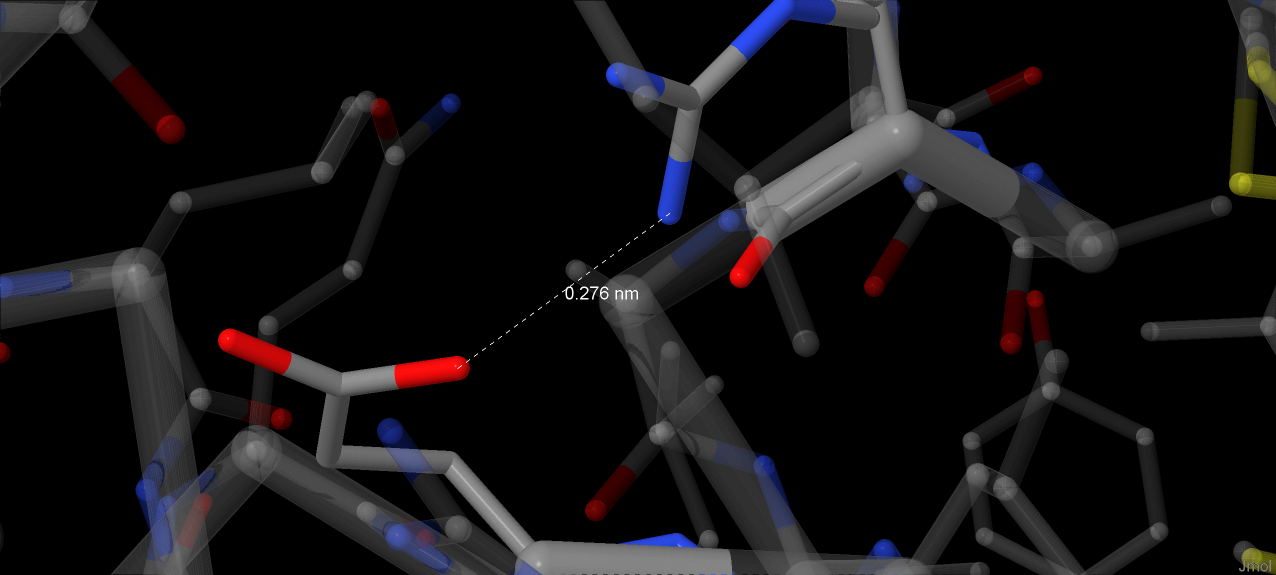
N-delta1 атом His49 связан водородной связью с карбонильным атомом кислорода Pro58, что играет роль в поддержании гистидина положения, в котором он координирует атома железа[1]. Jmol не распознает эту водородную связь (вероятно, при установленном в программе значении pH радикал гистидина депротонирован), однако расстояние между N и O в 2.76 Å совпадает со значением в источнике[1]
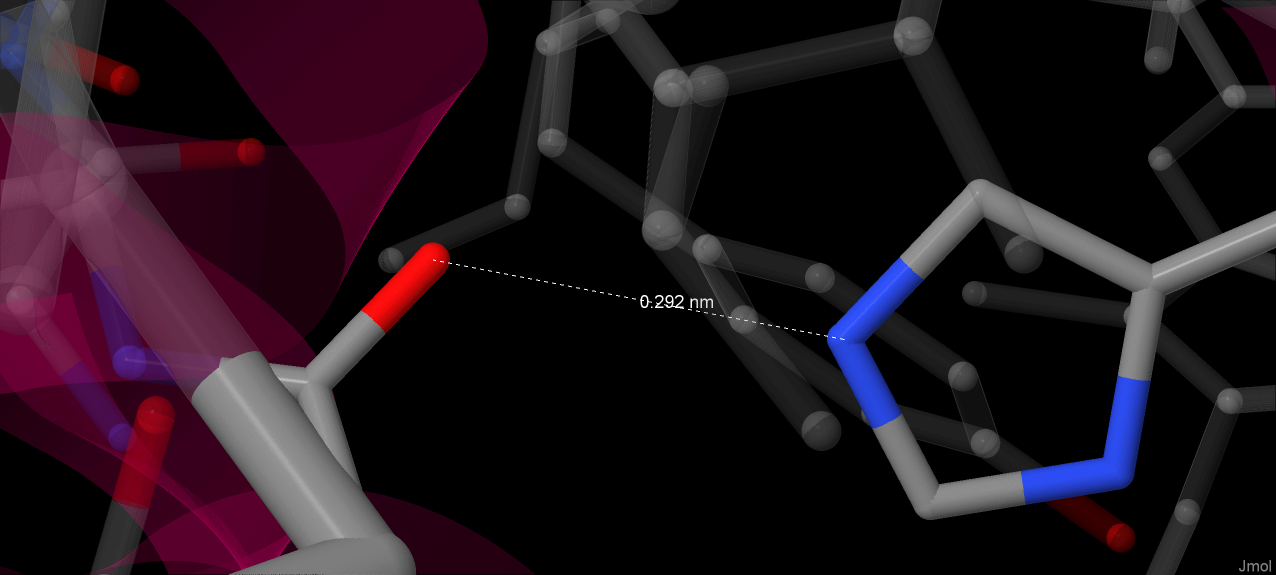
Цепь, содержащая Arg66, принимает две конформации: в одной образуются водородные связи между атомом азота гуанидиновой группы с пропинильной цепью гема (длина связи - 2.46 Å), в другой аминокислотный остаток обращён в растворитель[1]. Кроме того, расстояние между аминогруппой гуанидиновой группы радикала Arg67 и вторым кислородом карбоксильной группы пропинильной цепи составляет 2.88 Å. Авторы предполагают, что на этом месте образуется водородная связь.
Вклад участников
Звездин Дмитрий и Винников Ренат занимались анализом литературы - находили данные о структуре цитохрома c и пытались подтвердить гипотезы, выдвинутые в ходе работы, а также занимались написанием текста обзора.
Хасанова Ума работала со структурой данного белка в JMol и написала скрипт, демонстрирующий функционально важные структуры в молекуле белка.
Ссылки на источники
- [1]Stelter M, Melo AM, Pereira MM, Gomes CM, Hreggvidsson GO, Hjorleifsdottir S, Saraiva LM, Teixeira M, Archer M. A novel type of monoheme cytochrome c: biochemical and structural characterization at 1.23 A resolution of rhodothermus marinus cytochrome c. Biochemistry. 2008 Nov 18;47(46):11953-63. doi: 10.1021/bi800999g. Epub 2008 Oct 15. PMID: 18855424.
- [2]DUNCAN E. McREE, 3 - COMPUTATIONAL TECHNIQUES, Editor(s): DUNCAN E. McREE, Practical Protein Crystallography (Second Edition), Academic Press, 1999, Pages 91-cp1, ISBN 9780124860520, DOI:https://doi.org/10.1016/B978-012486052-0/50005-1.
- [3]Kumar S, Nussinov R (July 2002). "Close-range electrostatic interactions in proteins". ChemBioChem. 3 (7): 604–17.
- [4]Imai, M., Saio, T., Kumeta, H., Uchida, T., Inagaki, F., & Ishimori, K. (2016). Investigation of the redox-dependent modulation of structure and dynamics in human cytochrome c. Biochemical and Biophysical Research Communications, 469(4), 978–984.
- [5]Дж. Эмсли. Элементы. 1993г.