Практикум 9
Было выполнено выравнивание белков кишечной(Escherichia coli) и сенной(Bacillus subtilis) палочки. Были выбраны три пары белков с одинаковыми мнемониками функций в идентификаторах: FUR, LUXS и ARAB. То есть белок, регулирующий усвоение железа, S-рибозилгомоцистеиновая лиаза и рибулокиназа соответственно. Число инделов в каждом выравнивании было посчитано с помощью Python скрипта. Полученные результаты приведены в таблицах ниже.
Глобальное парное выравнивание гомологичных белков
| Protein Name | ID 1 | ID 2 | Score | % Identity | % Similarity | Gaps | Indels |
| Ferric uptake regulation protein | FUR_ECOLI | FUR_BACSU | 208.5 | 31.6% | 50.3% | 13 | 3 |
| S-ribosylhomocysteine lyase | LUXS_ECOLI | LUXS_BACSU | 273.0 | 35.1% | 52.9% | 20 | 5 |
| Ribulokinase | ARAB_ECOLI | ARAB_BACSU | 769.0 | 30.6% | 48.7% | 56 | 14 |
Локальное парное выравнивание гомологичных белков
| Protein Name | ID 1 | ID 2 | Score | % Identity | % Similarity | Gaps | Indels | Coverage 1 | Coverage 2 |
| Ferric uptake regulation protein | FUR_ECOLI | FUR_BACSU | 211.0 | 34.1% | 53.6% | 3 | 1 | 91.2% | 92.6% |
| S-ribosyl- homocysteine lyase | LUXS_ECOLI | LUXS_BACSU | 280.0 | 37.5% | 55.6% | 9 | 3 | 92.4% | 96.2% |
| Ribulokinase | ARAB_ECOLI | ARAB_BACSU | 776.0 | 31.9% | 50.2% | 44 | 12 | 97.2% | 95.4% |
Комментарии к выравниваниям
По числам в колонке Identity и Coverage можно сделать вывод, что белки всех трех пар гомологичны по всей последовательности, так как процент идентичности в каждой из пар выше 25% как в глобальном, так и в локальном выравниваниях.
У белка, регулирующего усвоение железа, процент идентичности в глобальном выравнивании составил 31.6%, в локальном - 34.1%, при этом значения перекрывания для первой и второй цепи составили 91.2% и 92.6%. Выравнивания строятся по всей последовательности, а потому результат локального так мало отличается от глобального. Также можно сказать, что данные белки эволюционно не так уж и близки, так как проценты идентичности и схожести сравнительно малы. Вероятно, это связано с тем, что процесс усвоения железа в разных условиях обитания(сенная палочка живет в воздушной пыли и почве, а кишечная палочка в нижних отделах кишечника теплокровных организмов) значительно отличается.
S-рибозилгомоцистеиновая лиаза имеет схожие результаты с парой, рассмотренной выше. Между глобальным и локальным выравниваниями в идентичности и схожести разница составляет 2.4% и 2.7% соответсвенно. S-рибозилгомоцистеиновая лиаза играет ключевую роль в метаболизме бактерий. Она участвует в синтезе сигнальной молекулы Al-2, используемой в межклеточной коммуникации бактерий и координации поведения популяции. Поэтому неудивительно, что у сенной и кишечной палочки рассматриваемый белок сильно отличается.
Рибулокиназа значительно длиннее двух других белков, поэтому в глобальном выравнивании проценты схожести и идентичности у нее чуть поскромнее, а именно 30.6% и 48.7%. В локальном выравнии значения прмерно на 2 с копейками процента больше, как и у других белков. Рибулокиназа участвует в углеводном обмене, обеспечивая синтез пентофосфатов, а также играет не последнюю роль в альтернативных путях метаболизма.
Про все три пары белков можно сказать, что локальное выравнивание по сравнению с глобальным не так уж и информативно так как белки гомологичны по всей последовательности.
Результат применения программ выравнивания к неродственным белкам.
| Тип выравнивания | Score | % Identity | % Similarity | Gaps | Indels | Coverage 1 | Coverage 2 |
| глобальное | 41.0 | 6.3% | 9.8% | 374 | 8 | - | - |
| локальное | 42.5 | 19.7% | 35.7% | 80 | 13 | 74,5% | 69,0% |
При построении парного выравнивания негомологичных последовательностей металлопротеазы LOIP_ECOLI(Metalloprotease LoiP) и белка SSUA_BACSU, связывающего алифатические сульфонаты(Putative aliphatic sulfonates-binding protein), процент идентичности меньше 25%(что соответствует случайному значению). Также в выравиваниях очень много гэпов и инделов. Процент перекрывания тоже маленький что в первой, что во второй последовательности. Металлопротеаза играет важную роль в разрушении тканей хозяина бактерии и межклеточной коммуникации. Второй взятый для выравнивания белок участвует в метаболизме серы и адаптации к стрессу.
Множественные выравнивания белков
В расширенном поиске в UniProt по мнемонике LUXS, соответствующей S-рибозилгомоцистеиновой лиазе, было получено 7954 результатов. Дополнительно к LUXS_BACSU и LUXS_ECOLI я выбрала следующие аннотированные белки(с меткой reviewed): LUXS_DEIRA, LUXS_SERMA, LUXS_NEIMB, LUXS_CLOPE и LUXS_SALTY.
Выравнивание было построено в UniProt и загружено файлом в Jalview, где было раскрашено по проценту идентичности.
Ссылка на выравнивание: Проект Jalview
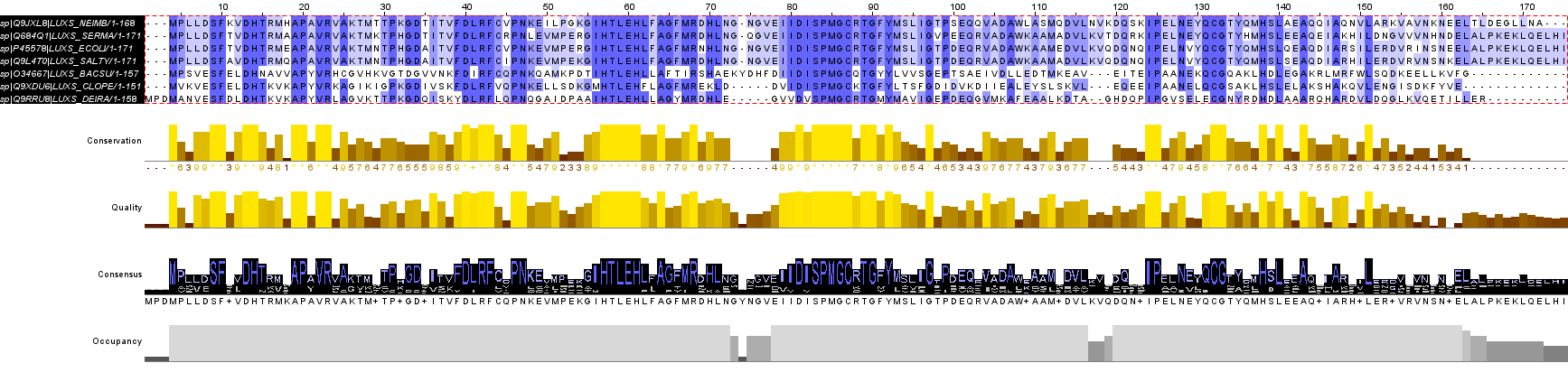
В выравнивании все белки хорошо выравнялись, так как они все гомологичны, по моему мнению. Это видно еще и по наличию достаточного количества продолжительных консервативных участков. Однако можно заметить, что внутри четверки LUXS_NEIMB, LUXS_SERMA, LUXS_ECOLI и LUXS_SALTY прослеживается значительно большее сходство, нежели между вместе взятыми 6-ю последовательностями.
Наиболее консервативными участками оказались сайты связывания катиона железа - позиции 54, 58 и 126 для всех белков из лучшей четверки. Также консерваативными оказались участки 13-15, 39-43, 79-90, 128-133. Скорее всего они либо являются активными центрами, либо важны в поддержании конформации белка. Малоконсервативными оказались позиции 110-123, а также 155-176. На счет хвоста могу предположить, что его неконсервативность связана с тем, что определение концевых участков последовательности белков всегда наименее точное, а потому хвосты обычно плохо выравниваются.