Внутримолекулярные взаимодействия в структуре 2I5B
Общая характеристика структуры 2I5B
| Идентификатор PDB | 2I5B |
| Название белка | Пиридоксин-киназа (pyridoxal kinase) |
| Количество разных цепей в PDB-файле | 5 |
| Молекулы, отличные от собственно белка | 5 молекул ADP (аденозиндифосфат) |
С помощью программы Jmol построено изображение вторичной структуры белка (рис.1).
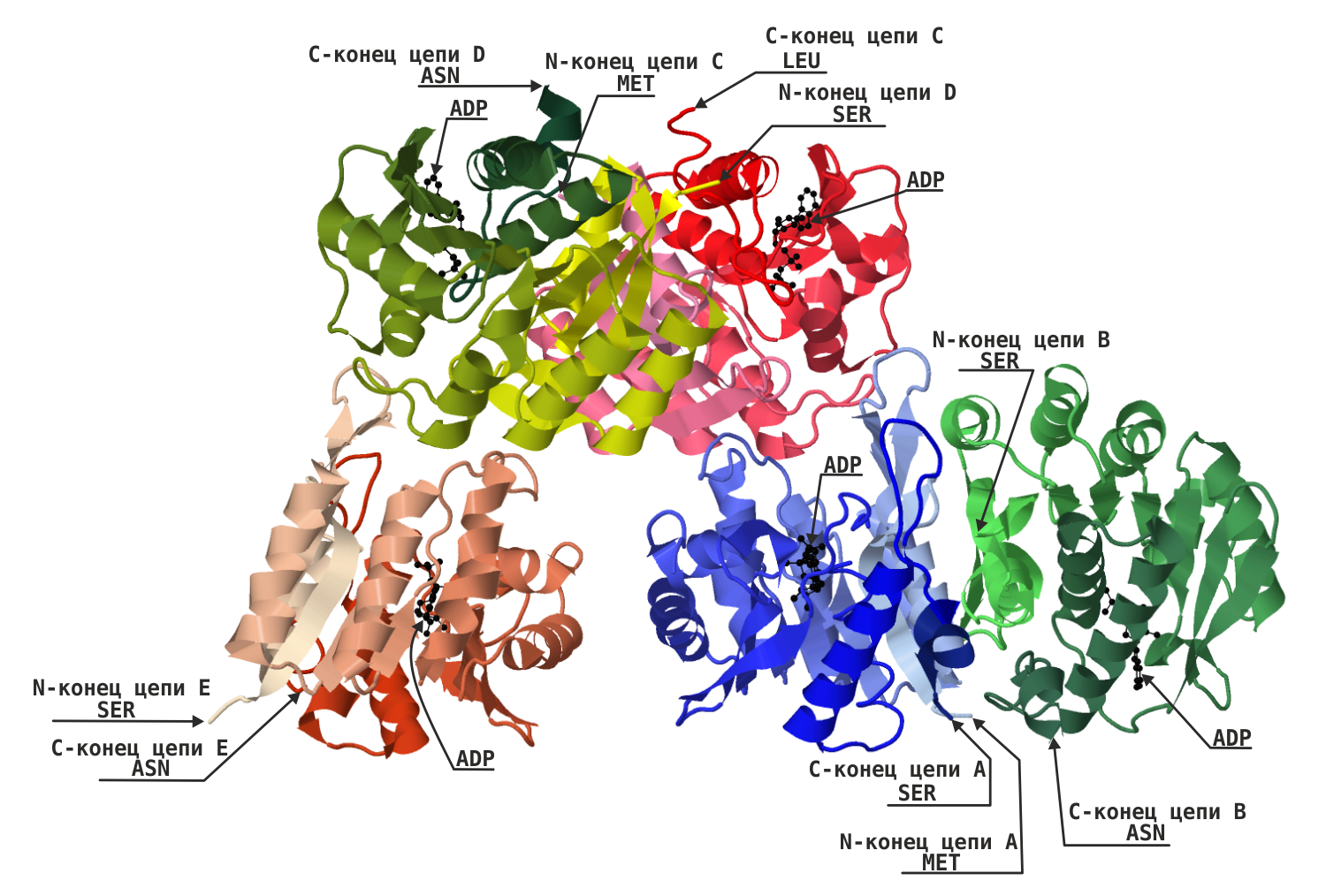
Цветом выделены все 5 цепей. Насыщенность цвета увеличивается от начала цепи (N-конца) к концу (C-концу). Стрелками указаны начало и конец каждой цепи. Цепь А выделена оттенками синего цвета, цепь В - оттенками зеленого цвета, С - оттенками красного цвета, Е – оттенками коричневого цвета, D - от желтого к зелёному, молекула ADP – черным цветом. Для получения кодов цветов переходящих тонов использовалась равномерная сетка по каждому из цветов (r,g,b).
Анализ структуры α-спиралей и β-листов в цепи А белка с кодом PDB 2I5B
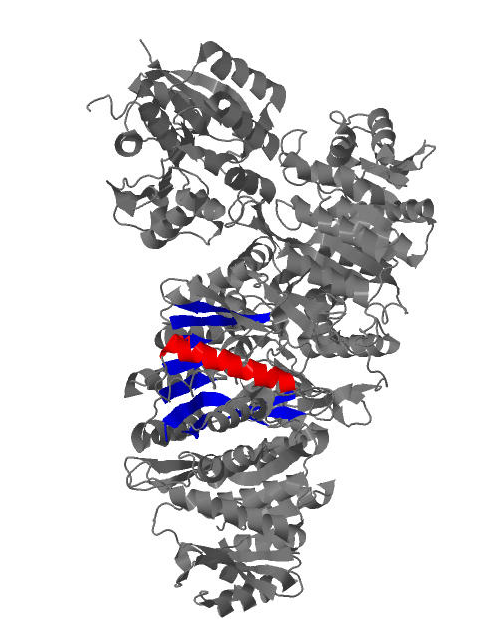
Цепь А белка pyridoxal kinase содержит 11 α-спиралей и β-лист с 9 тяжами. Для анализа структуры α-спиралей рассмотрим α-спираль, в которую входят остатки 231-249. На рис.2 показана позиция α-спирали и β-листа на цельной структуре белка. Спираль показана красным цветом, лист синим.
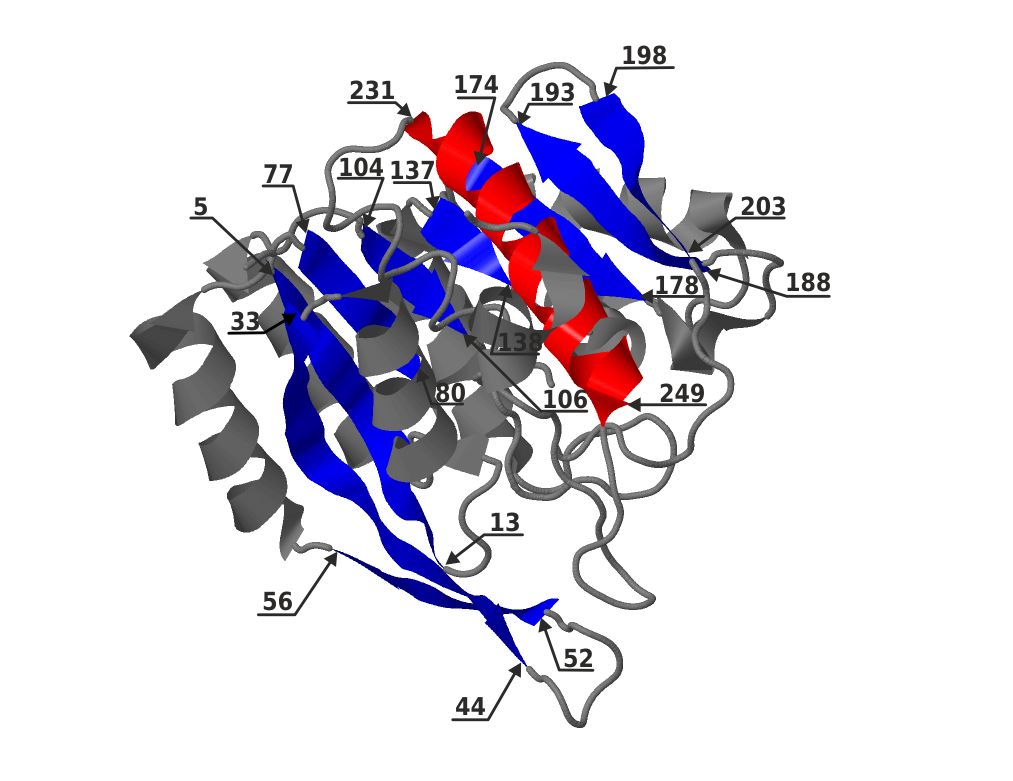
На рис.3 показано более детальное изображение – отдельно на цепи А показано положение α-спирали и β-листа, указаны номера остатков начала и конца спирали и каждого из тяжей листа.
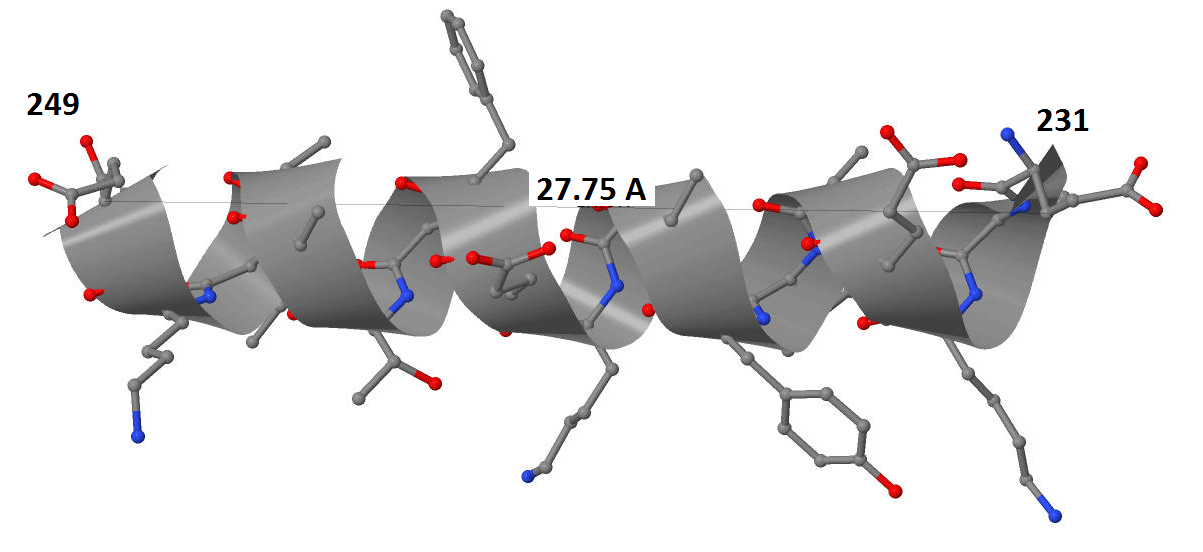
Характеристики α–спиралей в настоящее время получены методами рентгеноструктурного анализа. В таблице приведены значения, полученные непосредственными замерами средствами Jmol (рис.4) и рентгеноструктурного анализа.
Таблица| Способ измерения | Шаг спирали, А | Число остатков спирали на виток |
| Рентгеноструктурный | 5,4 | 3,5 |
| Средствами Jmol | 5,76 | 3,6 |
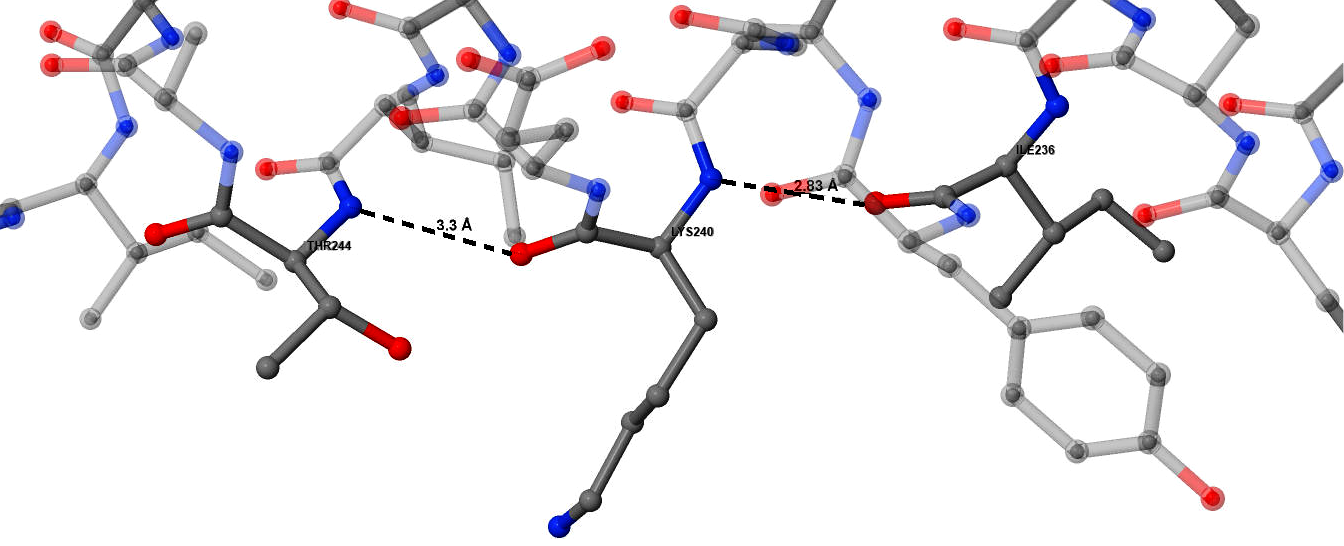
Образование водородных связей показано на примере аминокислотного остатка 240 (рис.5). Образуются две водородные связи: аминогруппа Thr244 и карбонильная группа Lys240, аминогруппа Lys240 и карбонильная группа Ile244.
Цепь А включает β-лист, состоящий из 9-ти тяжей (рис.2). В него входят остатки 5-13, 33-44, 52-56, 77-80, 104-106, 137-138, 174-178, 188-193, 198-203. Расположение соседних тяжей может быть параллельным или антипараллельным, в зависимости от направления пептидных цепей. В выбранном листе есть как параллельные, так и антипараллельные тяжи. Для этого выделим на изображении белка только бета-лист (рис.6), развернув его так, чтобы было видно направление тяжей. Стрелка соответствует направлению пептидной цепи от начала тяжа к концу. Соноправленные стрелки на тяжах – в параллельных бета-тяжах, противоположно направленные - в антипараллельных. Параллельные тяжи, состоящие из остатков 52-56 и 187-193 антипараллельны каждому тяжу из другой группы параллельных тяжей, состоящий из остатков 33-44, 5-13, 77-80, 104-106, 137-138, 174-178, 198-203. Поверхность, образованная данными тяжами, не является плоской.

Внутримолекулярные взаимодействия боковых групп белка в цепи A структуры 2I5B
1. В белке Pyridoxal kinase содержится 9 цистеиновых остатков, причем два остатка (112 остаток цепи А и 112 остаток цепи С) образуют дисульфидный мостик. На рис.7 изображена вторичная структура белка, где красным цветом выделены остатки цистеина, не образующие дисульфидные мостики, а синим - образующие.
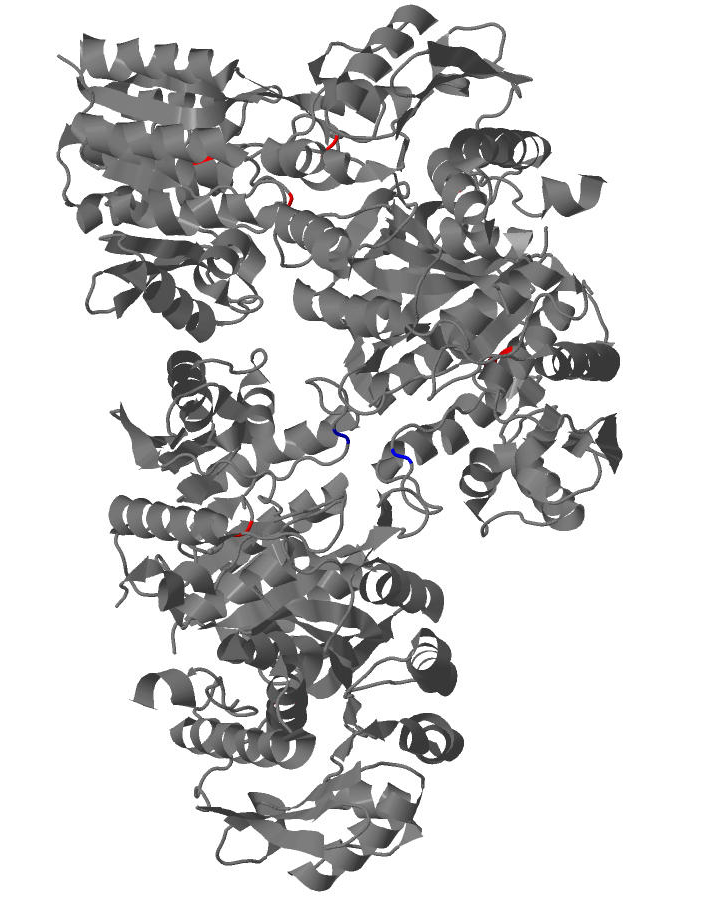
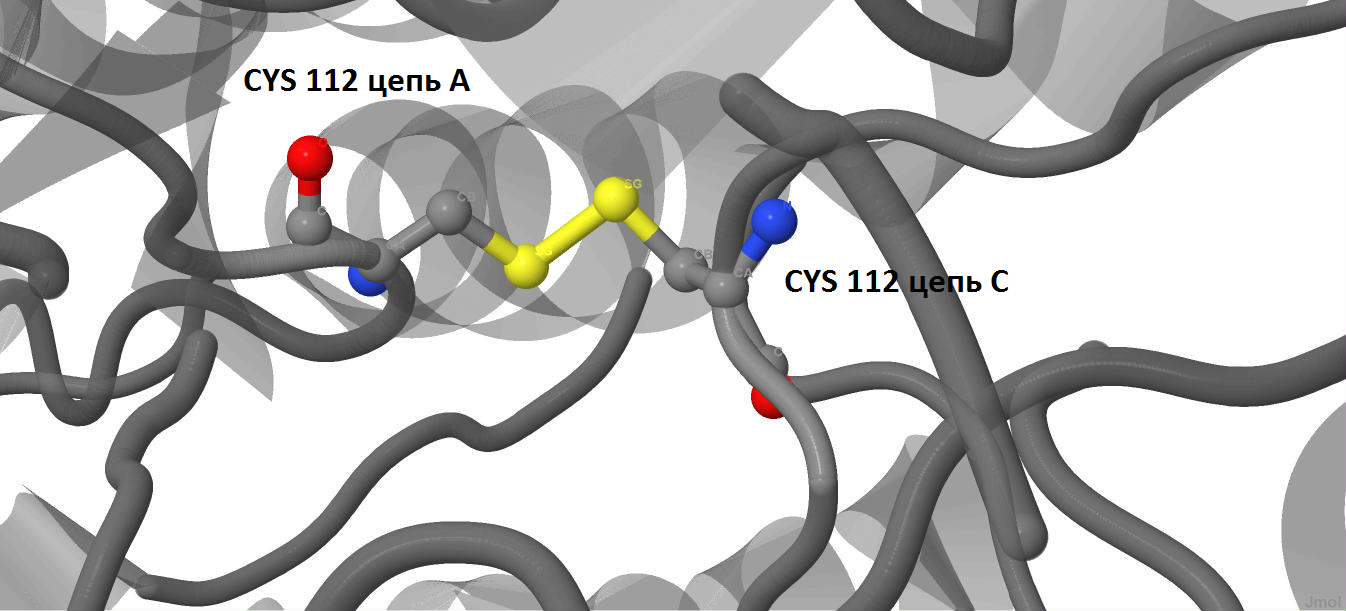
Детальное изображение дисульфидного мостика приведено на рис.8.
2. В белке Pyridoxal kinase содержится 25 солевых мостиков (по 5 мостиков в каждой цепи), образованных положительно заряженными аминокислотам (Arg, Lys) и отрицательно заряженными аминокислотами (Glu, Asp). На рис.9 показано положение всех солевых мостиков во вторичной структуре белка.

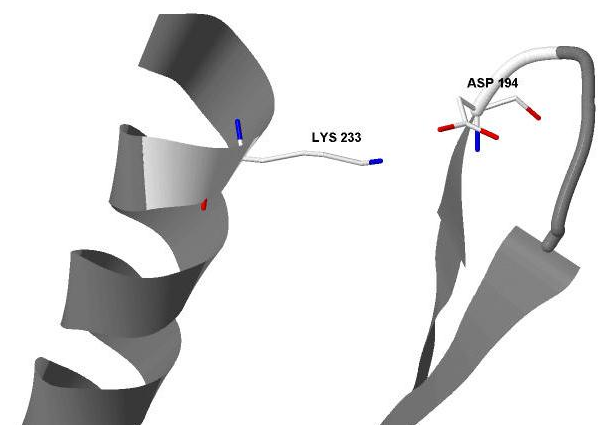
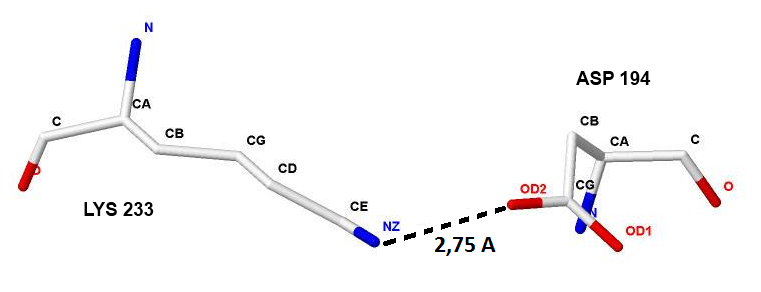
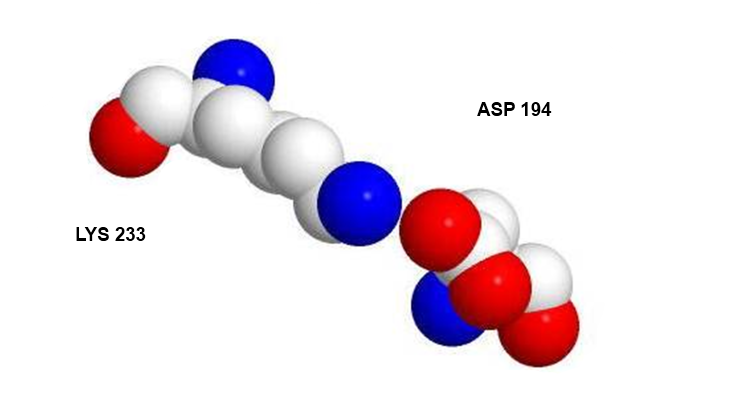
На рисунках 10, 11, 12 детально изображен солевой мостик, образованный аминокислотными остатками Asp194 и Lys233 цепи А.