Описание области контакта белка и лиганда ADP в структуре 2I5B
Лиганды в структуре 2I5B
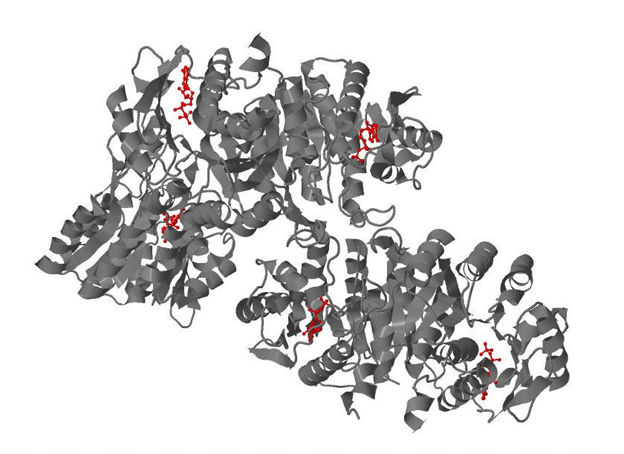
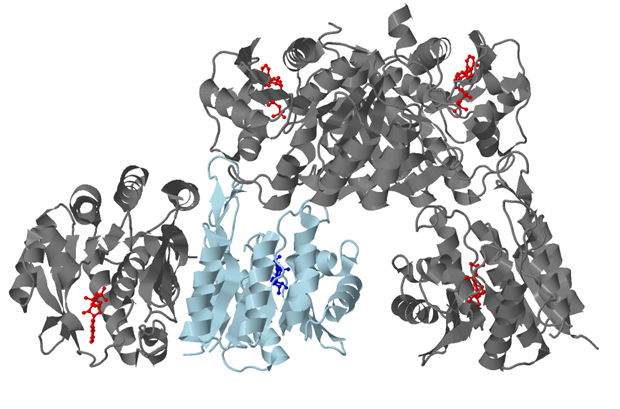
В структуре 2I5B содержится 5 лигандов - молекул ADP (аденозиндифосфата). Каждая из 5 цепей содержит 1 лиганд. На рис.1 показано положение всех лигандов в белке.
Вычисление размеров белка проводилось как средствами Jmol (рис.2, 3), так и непосредственным вычислением расстояний на основе информации о координатах атомов PDB-файла в MATLAB.
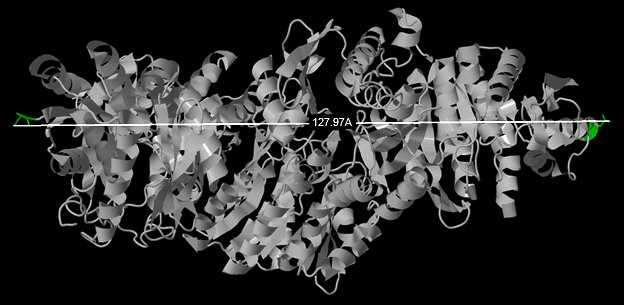
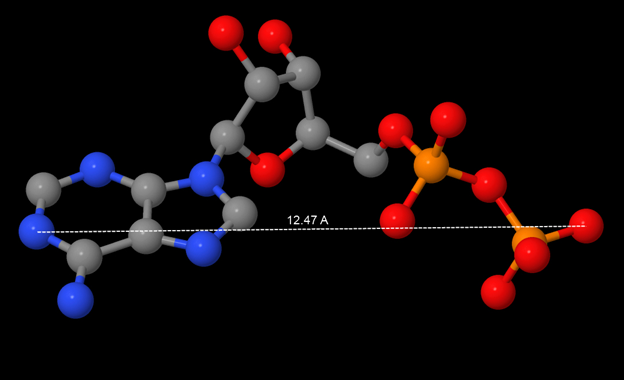
Максимальное расстояние между атомами белка достигается между атомами 7114 (ASP159 цепь А) и 7942 (158SER E) и составляет 127.97 Å. Белок имеет интересную геометрическую форму. Некоторые его проекции аппроксимируются кругом, каждая из цепей – шаром. Размеры белка и лиганда приведены в табл.1. Размеры лиганда также определены двумя способами.
Таблица 1 – Размеры белка и лиганда
| D | по OX | по OY | по OZ | |
| 127.97 Å | 68.119 Å | 81.221 Å | 123.33 Å | |
| Белок | 12.797 нм | 6.8119 нм | 8.1221 нм | 12.333 нм |
| 0.12697·10-7м | 0.68119·10-7м | 0.81221·10-7м | 1.2333·10-7м | |
| Лиганд цепи | 12.467 Å | 11.774 Å | 7.982 Å | 4.260 Å |
В современных исследованиях считается, что удается определить координаты атомов в белке с точностью до сотых долей ангстрема [1]. Максимальные линейные размеры ADP, рассчитанные программно по координатам атомов из PDB-файла, входящих в разные цепи различаются на 1% (табл.2). Такое значительное отличие в результатах вероятно можно объяснить различием влияния соседних атомов в разных цепях.
Таблица 2 – Максимальный линейный размер лиганда различных цепей
| Лиганд | ADP цепи A | ADP цепи B | ADP цепи C | ADP цепи D | ADP цепи E |
| D, Å | 12.467 | 12.322 | 12.245 | 12.255 | 12.318 |
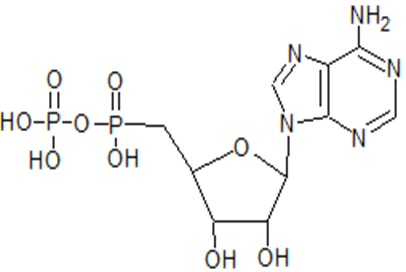
ADP (АДФ, аденозиндифосфат) – это нуклеотид, который состоит состоит из аденина, рибозы и двух остатков фосфорной кислоты. Структурная формула АДФ приведена на рис.4.
Белок pyridoxine kinase, является катализатором реакции фосфорилирования провитамина B6:
ATP + pyridoxal = ADP + pyridoxal 5'-phosphate.
ADP образуется в результате переноса концевой фосфатной группы АТФ. ADP – лиганд, найденный в структуре 2I5B, является продуктом этой реакции. Наличие в белке ADP должно обуславливать его химическую активность, т.к. фосфорные связи являются энергоемкими.
Анализ области контакта белка из структуры PDB 2I5B и лиганда ADP
Для анализа контактов лиганда ADP с белком была выбрана цепь А и молекула ADP, связанная с ней (номер молекулы в PDB-файле – 301). На рис.5 показано положение, выбранной цепи и лиганда во вторичной структуре белка.
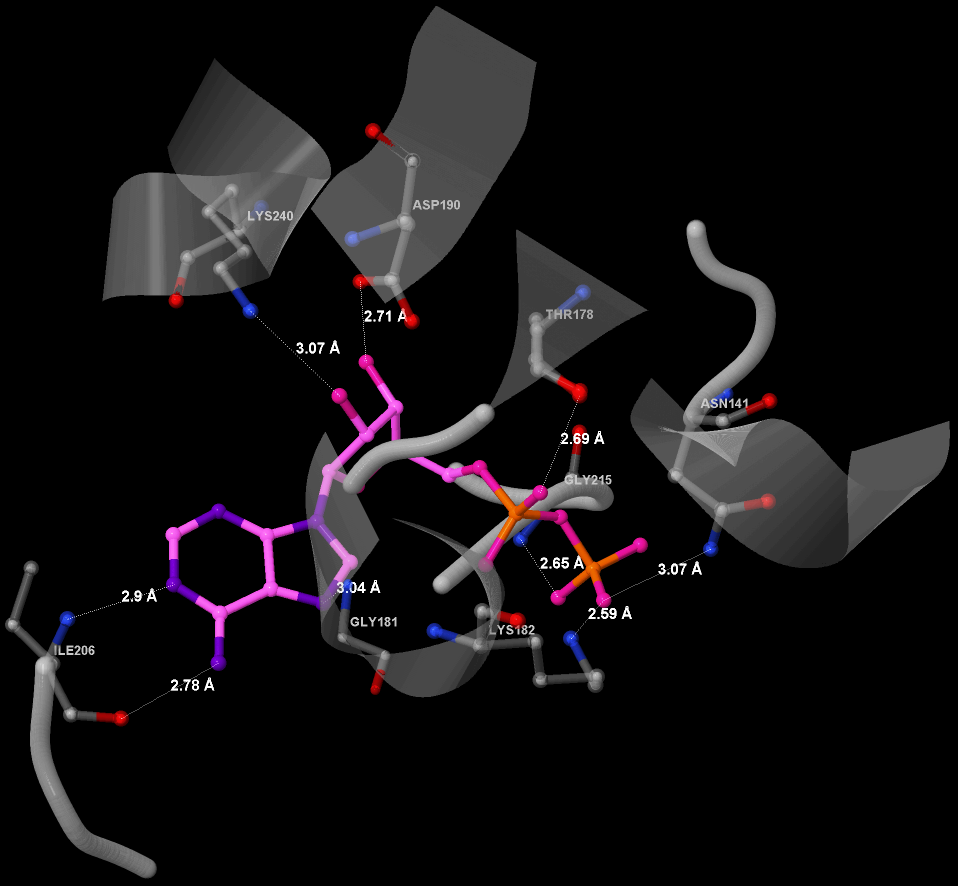
ADP образует водородные связи с восемью аминокислотами: Asn141, Thr178, Gly181, Lys182, Asp190, Ile206, 215Gly, 240Lys. На рисунке 5 показаны элементы вторичной структуры, которые включают контактирующие с ADP аминокислоты.
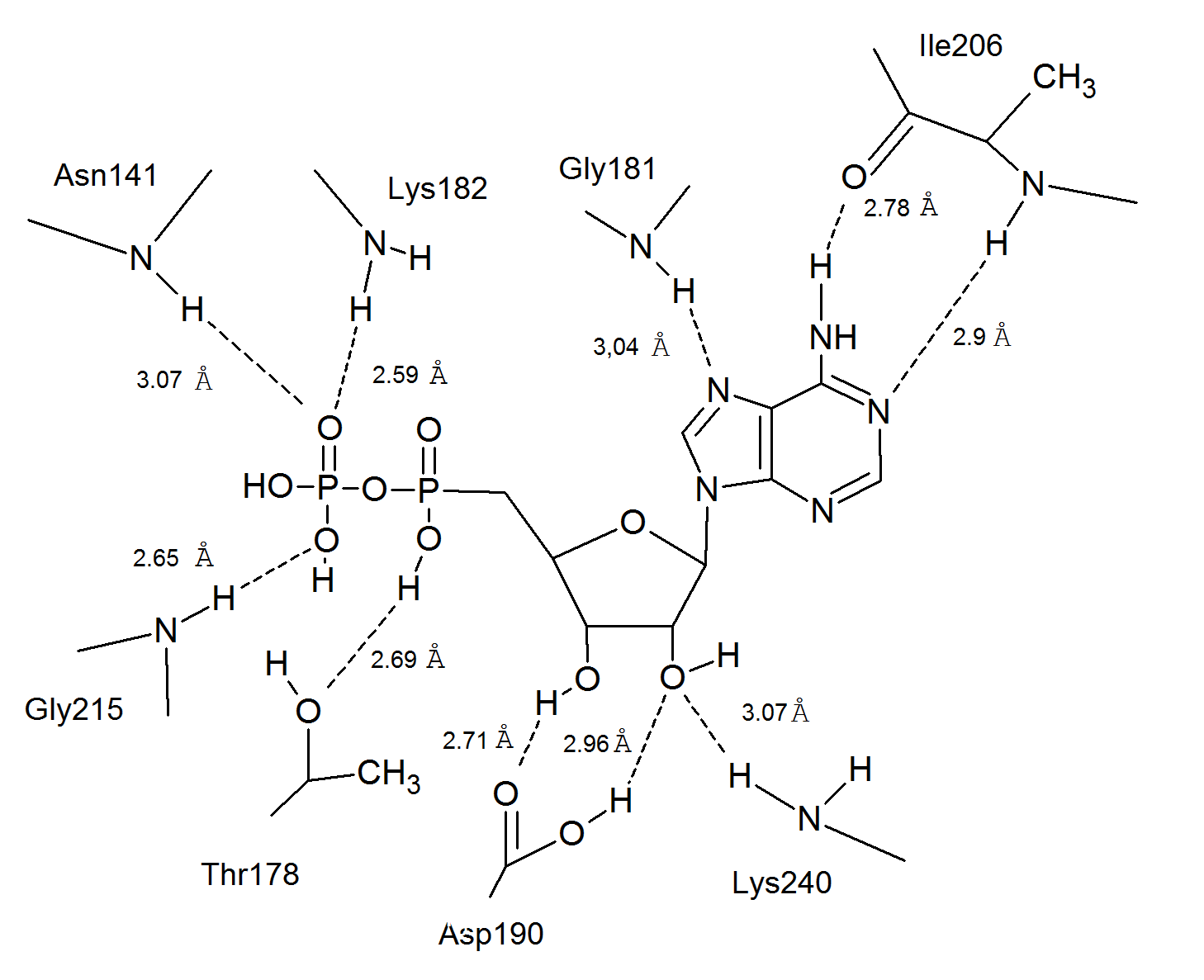
На рис.7 изображена схема, на которой приведена химическая формула ADP и пунктиром показаны водородные связи. Так же на схеме указаны длины водородных связей, образуемых лигандом и аминокислотами.
Приведенные рисунки получены с помощью следующего скрипта: script.txt.
Проект генно-инженерного эксперимента с белком из структуры 2I5B
В образовании водородных связей АДФ и аминокислот Asn141, Ile206, Gly215 участвуют атомы азота аминокислот, которые участвуют также в образовании пептидных связей. Поэтому очень трудно сказать, какую точечную мутацию надо применить, скорее всего в этом случае придется заменить несколько соседних аминокислот. У Lys182 и Lys240 участвуют аминогруппы аминокислот, причем обе аминокислоты входят в состав разных α-спиралей. Если заменить какую-либо из этих аминокислот на любую другую, кроме Arg, то белок потеряет способность связывать лиганд. Надо заметить, что длина водородной связи с Lys182 самая короткая (2.59 Å), что говорит о том, что Lys182 особенно важен в связывании лиганда.
Если заменить Lys182 или Lys240 на Arg, то, возможно, белок не потеряет способность связывать ADP.
Список литературы
1. Лунин В.Ю. Математический аппарат рентгеноструктурного анализа макромолекул