Множественное выравнивание
Создание репрезентативной выборки гомологов белка PDXK_BACSU
С помощью программы ВLAST была создана репрезентативная выборка гомологов PDXK_BACSU по различным таксонам прокариот. Bacillus Subtilis, которой принадлежит белок, относится к филуму Firmicutes, поэтому при создании запроса в поле “Organism” исключили филум Firmicutes и Eukaryota. Поиск гомологов осуществлялся по базе данных RefSeq.
Таблица 2
| Поиск | Алгоритм BLAST | Название базы данных | Ограничения по таксонам | Порог e-value | Максимальное количество хитов |
| По эукариотам | blastp (protein-protein BLAST) | RefSeq | Eukaryota | 1e-5 | 140 |
| По прокариотам | blastp (protein-protein BLAST) | RefSeq | Exclude (Eukaryota and Firmicutes) | 1e-5 | 3160 |
Для того, чтобы узнать, к каким группам относятся гомологи, в секции Descriptions окна выдачи BLAST выделили все последовательности и получили о них выдачу GenBank, в правом верхнем углу окна нажали “Tree”.
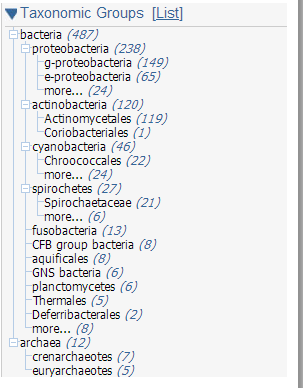
На рисунках 1 и 2 показан результат для прокариот эукариот. Так как не удалось загрузить все полученные результаты для прокариот, использовали максимальное количество хитов, равное 1000.
Информация о белках эукариот располагалась исключительно в ядре.

В таблице 2 приведены белки, которые были выбраны для множественного выравнивания.
Таблица 2
| Домен | Филум/Царство | Название организма | Количество белков (в конкретной выборке) |
| Archaea | Crenarchaeota; | Caldivirga maquilingensis IC-167 | 1 |
| Bacteria | Deferribacteres | Calditerrivibrio nitroreducens DSM 19672 Deferribacter desulfuricans SSM1 |
1 1 |
| Deinococcus-Thermus | Thermus oshimai JL-2 Thermus scotoductus SA-01 |
1 1 |
|
| Planctomycetes | Rhodopirellula europaea 6C | 1 | |
| Fusobacteria | Sebaldella termitidis ATCC 33386 Fusobacterium sp. D12 Leptotrichia buccalis C-1013-b |
1 1 1 |
|
| Aquificae | Sulfurihydrogenibium azorense Az-Fu1 Persephonella marina EX-H1 |
1 1 |
|
| Spirochaetes | Treponema denticola OTK Brachyspira hampsonii 30599 |
1 1 |
|
| Cyanobacteria | Synechocystis sp. PCC 7509 Nostoc sp. PCC 7524 |
1 1 |
|
| Actinobacteria | Arthrobacter crystallopoietes BAB-32 Streptomyces davawensis JCM 4913 Streptomyces davawensis JCM 4913 |
1 1 1 |
|
| Proteobacteria | Salmonella enterica subsp. enterica serovar Typhimurium str. LT2 | 1 | |
| candidate division NC10 | Candidatus Methylomirabilis oxyfera | 1 | |
| Eukaryota | Viridiplantae | Medicago truncatula Zea mays Selaginella moellendorffii Oryza sativa Japonica Group |
1 1 1 1 |
| Fungi | Schizosaccharomyces japonicus yFS275 Penicillium chrysogenum Wisconsin 54-1255 |
1 1 1 |
Из чернового списка гомологов была убрана Acanthamoeba_castellanii_str._Neff и Candida glabrata CBS 138, принадлежащая Eukaryota.
Множественное выравнивание гомологов белка PDXK_BACSU
Множественное выравнивание выбранных последовательностей было произведено с помощью программы MUSCLE. Результат выравнивания можно посмотреть в файле. На рисунке 3 приведена полная картина выравнивания. Выравнивание не исправлялось ( если не считать того, что удалили последовательности Acanthamoeba_castellanii_str._Neff и Candida glabrata CBS 138 , которые сильно выбивались), так как выбивающиеся остатки в блоках нельзя было убрать с помощью удачного сдвига последовательности.
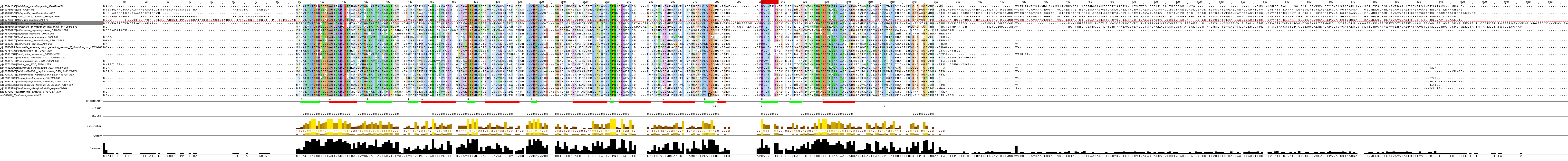
Результаты анализа множественного выравнивания гомологов белка PDXK_BACSU
В целом выравнивание можно назвать консервативным. Как правило, элементы вторичной структуры соответствуют участкам консервативности, но отнюдь не всегда. Первое связано с тем, что вторичная структура может обуславливать функции белка. По вторичной структуре можно частично предсказать функцию пептила. Самое плохое выравнивание на концах последовательностей. Это объясняется тем, что белок PDXK_BACSU (и его гомологи) представляет собой глобулу, причем концевые участки его последовательности выдаются наружу, т. е., скорее всего, не так сильно влияют на выполняемую им функцию. А в "ядре" глобул как раз и находятся консервативные участки. Таким образом, можно предположить, что изменение последовательности белка на концах в процессе эволюции не сильно сказывается на его функции. Начальные и конечные участки последовательностей у эукариот более длинные, чем у прокариот.
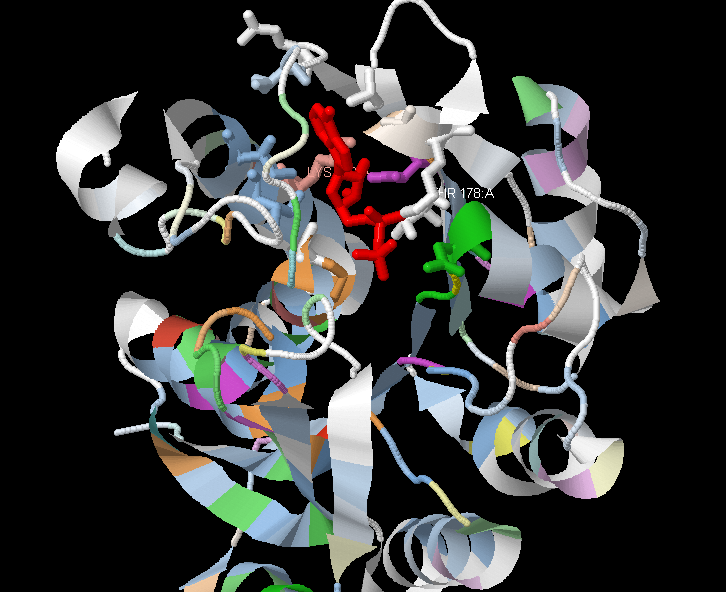
С помощью JalView связали трехмерную структуру PDXK_BACSU с его последовательностью в формате fasta. С лигандом связываются следующие аминокислотные остатки белка: Asn141, Thr178, Gly180, Gly181, Lys182, Ala188, Asp190, 204Glu, Ile206, 214Ala, 215Gly, 240Lys, 243Ile, 247Ile. Неконсервативными остатками являются 178, 182. Надо заметить, что только у других белков на в колонке, соответствующей Lys182 находятся гидрофобные неполярные аминокислоты. В колонке с Thr178 только PDXK_BACSU обладает этой аминокислотой, другие белки содержат Lys. В колонке со слабо консервативной Gly181 , как правило, встречается His, а в колонке с Asn141 - Asp, которая заряжена в отличие от Asn. Остальные - консервативны. В целом, большинство аминокислот, связывающих лиганд, консервативны, поэтому, я думаю, что способность связывать ADP могла и не измениться.
На рисунке 4 изображена пространственная структура белка PDXK_BACSU, полученная в JMol. Сам белок изображен с помощью команды cartoon, а аминокислоты, которые связываются с лигандом ADP (выделен красным цветом) изображены с помощью команды wireframe. Все аминокислоты имеют тот же цвет, что и в множественном выравнивании (рисунок 3).