Задание 2. Восстановление соседних ячеек 2I5B
Описание контактов внутри кристалла
Модель 2I5B описывает пространственную структуру белка пиридоксалькиназы Bacillus subtilis. Кристаллографические характеристики указаны в поле CRYST1 в файле PDB:
CRYST1 102.499 102.499 251.360 90.00 90.00 90.00 P 41 21 2 40
Первые три числа - это длины направляющих векторов, следующие три - углы между ними. В одной ячейке содержится 40 молекул.
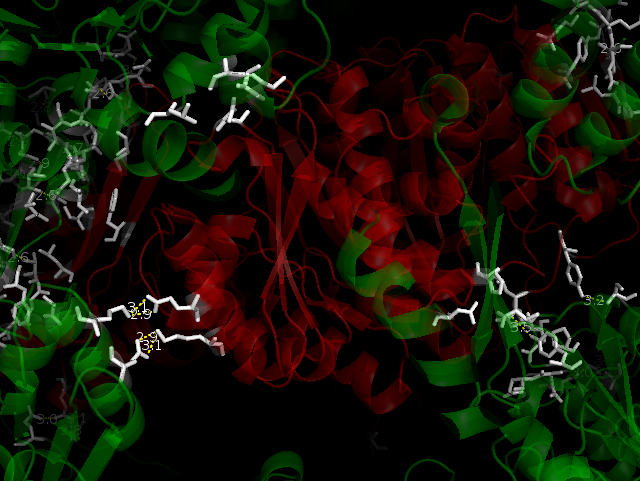
Пиридоксалькиназа является гомодимером, но ячейка кристалла содержит 5 одинаковых цепей - A, B, C, D, E. На рисунке ниже показано содержимое ячейки (зеленый цвет) и ряда соседних ячеек (красный цвет).
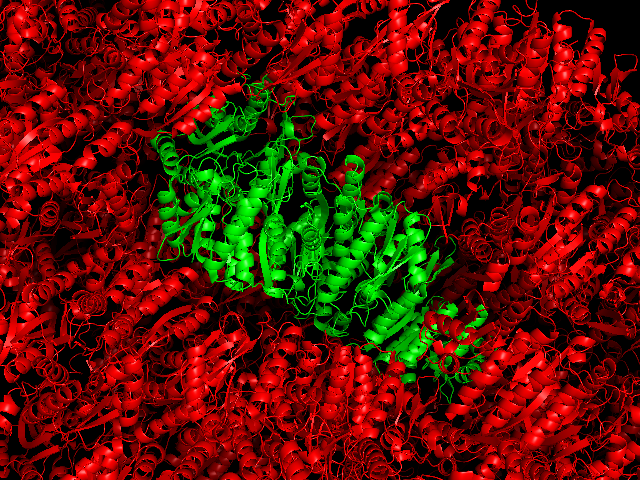
Анализ контактов между белками соседних ячеек
Для того, чтобы найти идентифицировать водородные связи между белками из соседних ячеек, использовались следующие команды:
symexp symp, 2i5b, 2i5b, 3, 1 select st1, byres (2i5b within 3.5 of symp*) select st2, byres (symp* within 3.5 of 2i5b) color white, byres (st2 and (st1 around 3.5)) color white, byres (st1 and (st2 around 3.5)) show sticks, byres (st1 and (st2 around 3.5)) show sticks, byres (st2 and (st1 around 3.5)) distance hbonds, st1, st2, 3.5, 2
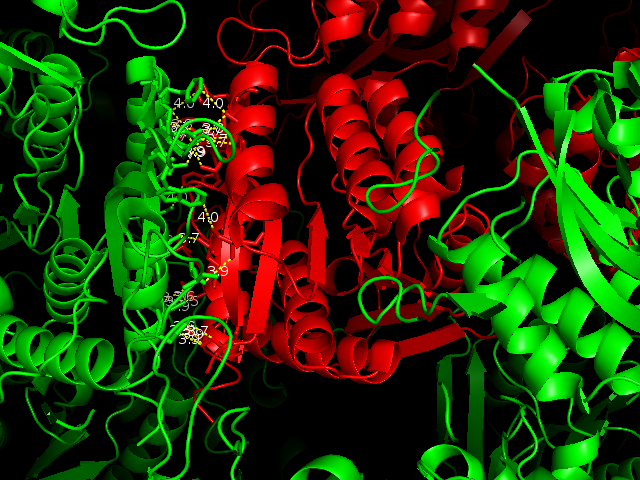
Ниже на рисунках показаны водородные связи между белком и его соседними ячейками. Зеленым покрашен белок одной ячейки, красным - цепи белков соседних ячеек. Белым покрашены аминокислоты, которые находятся на расстоянии меньшем или равным 3.5. Водородные связи показаны желтым пунктиром. Водородных связей более 20. Можно заметить, что есть симметричные водородные связи, например, Lys166***Glu162, Glu162***Lys166 во фрагменте 4.
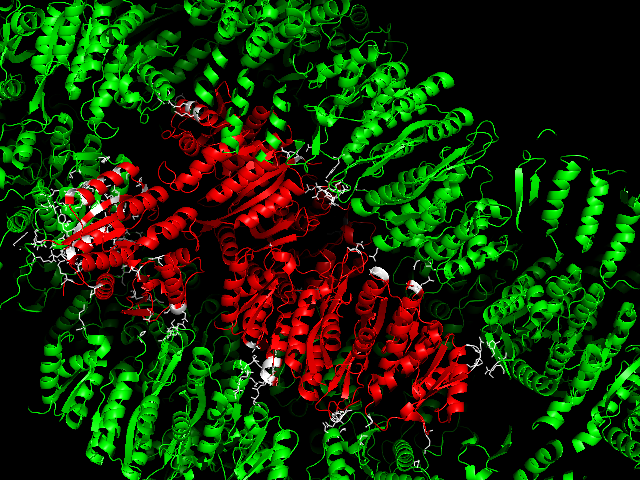
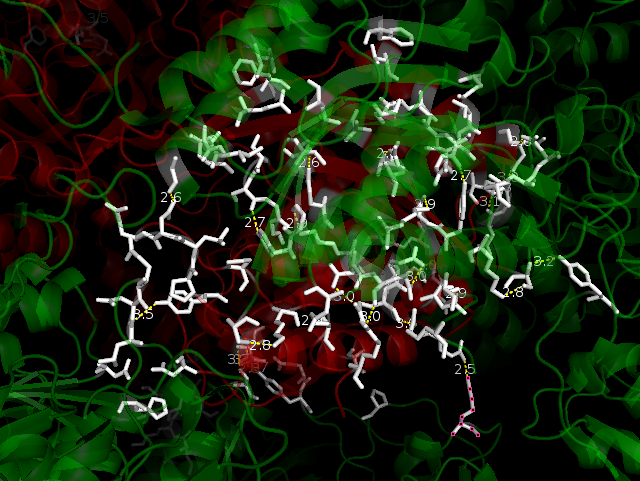
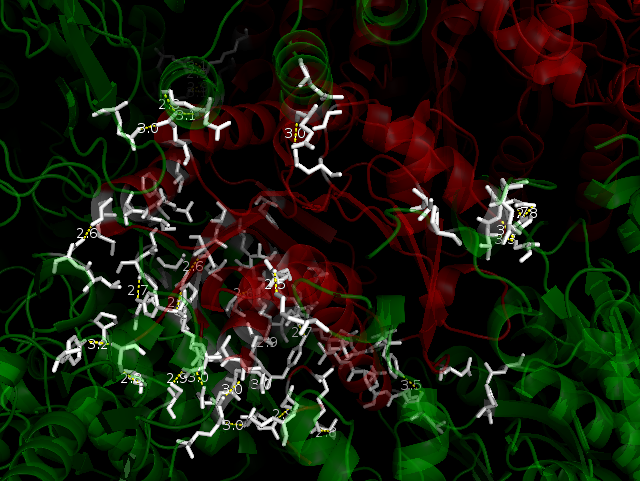
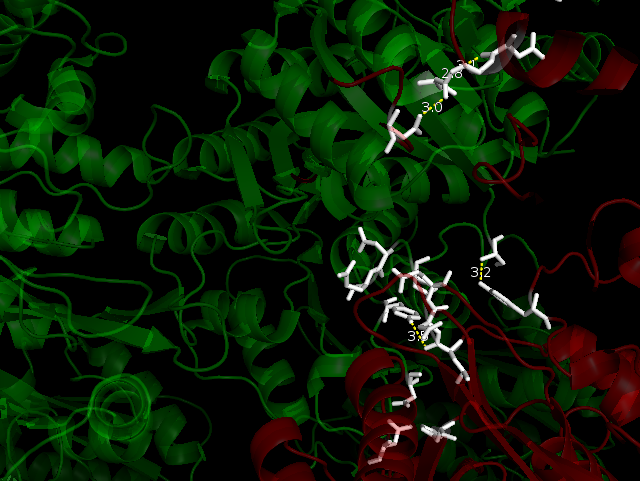
Была найдена одна область гидрофобных контактов. Для этого использовали команды:
select hyph, resn leu+ile+val+phe+trp+met+ala distance hyphint, byres(hyph and 2i5b), byres(hyph and symp*), 4 select hyph_res1, byres((hyph and 2i5b) within 4 of (hyph and symp*)) select hyph_res2, byres((hyph and symp*) within 4 of (hyph and 2i5b)) show sticks, hyph_res*
Таким образом, водородные связи играют большую роль в кристаллизации белка.
Структура 3HDD
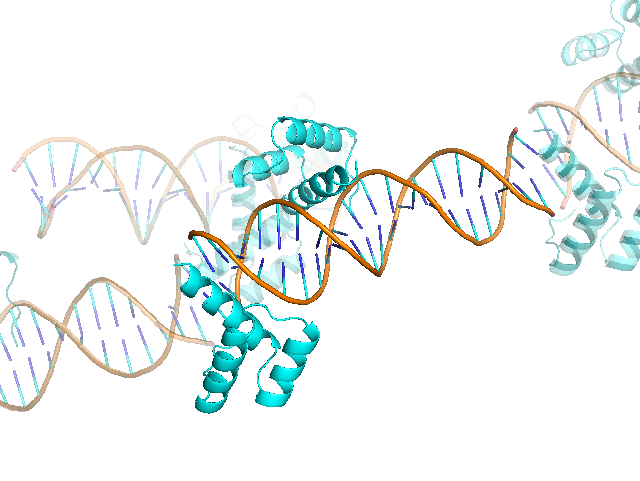
В данном задании было предложено проанализировать структуру 3HDD - комплекса гомеодоменового белка с ДНК Drosophila melanogaster. Она имеет разрешение 2.2 A. На рисунке ниже представлено изображение комлекса и соседних ячеек. Можно увидеть, что цепь белка B взаимодействует не только с ДНК в своей ячейке, но и с соседней.
Для отображения водородных связей использовались следующие команды:
symexp sym, 3hdd, chain B, 4, 1 select chA, byres (chain A within 3.5 of sym*) select DNA, byres (sym* within 3.5 of chain A) show sticks, chA show sticks, DNA distance hbonds, chA, DNA, 3.5, 2
Далее водородные связи показаны более детально:
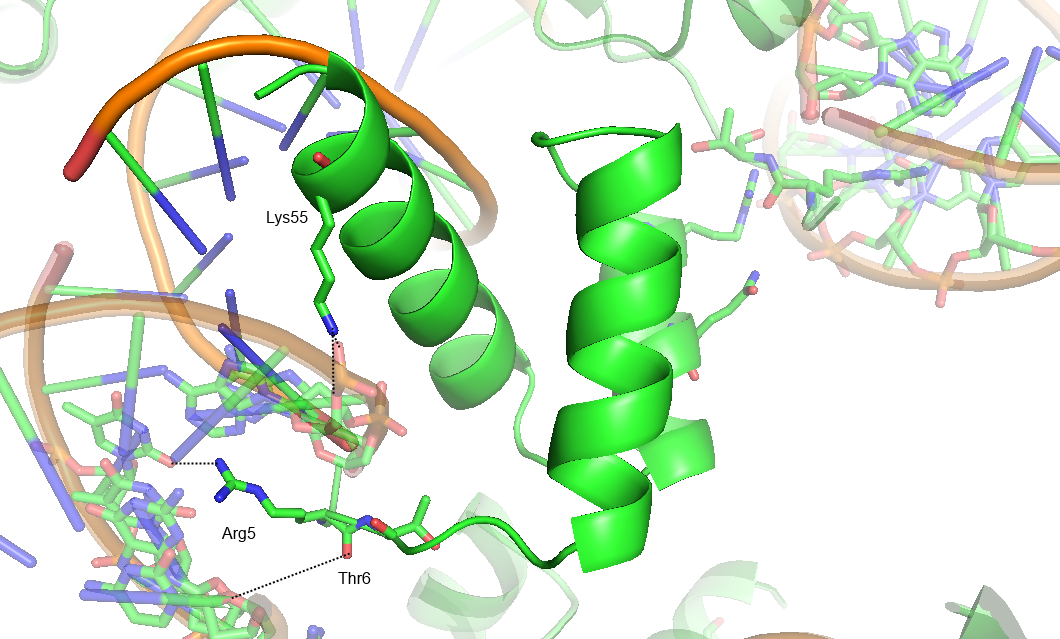
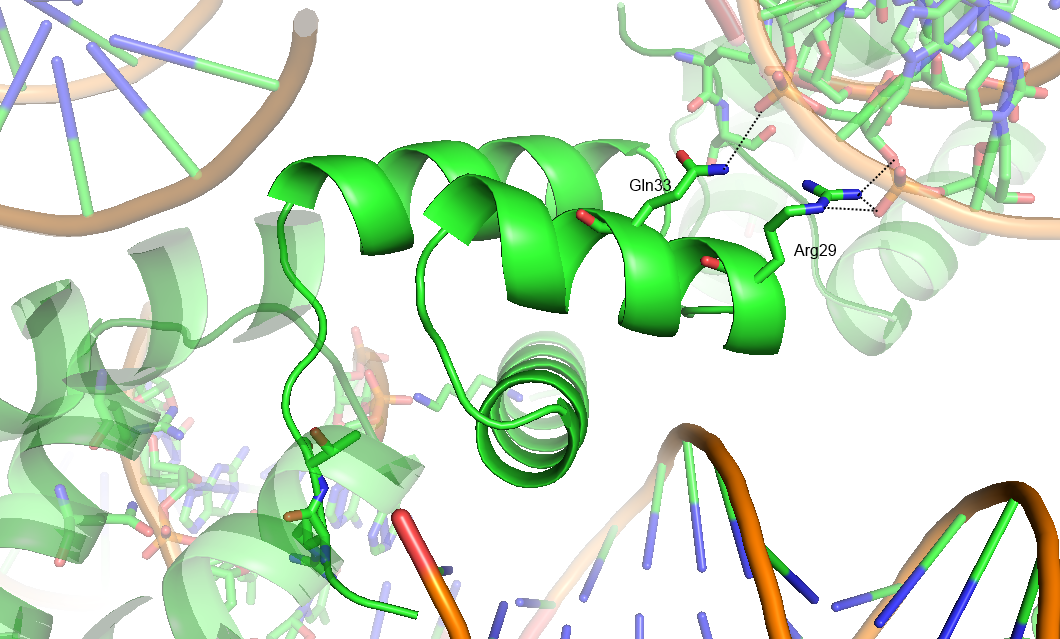
Таким образом, странное положение цепи B обусловлено тем, что она образует водородные связи с молекулами ДНК соседней ячейки.