Задание 6. Сравнение структур, полученных с помошью ЯМР и РСА
Для анализа были выбраны структуры белка ангиогенина коровы. Длина белка 125 аминокислотных остатков. Выбор был остановлен на этой структуре, потому что у неё очень хорошее разрешение - 1.5 ангстрема. Основная информация о моделях, полученных с помощью ЯМР и РСА представлена в таблице:
| РСА | ЯМР | ||||
| PDB entry | Цепь | Разрешение | PDB entry | Цепь | Число моделей |
| 1AGI | A | 1.5 σ | 1GIO | A | 10 |
На рисунке 1 показано изображение структуры, полученной с помощью ЯМР. Показаны все 10 моделей. Можно заметить, что элементы вторичной структуры накладываются очень хорошо, а петли и концы белка лежат немного по-разному.
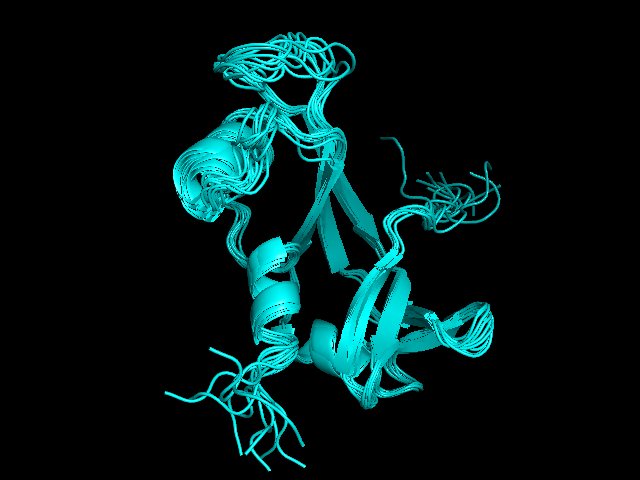
На рисунке 2 показано изображение структуры, полученной с помощью РСА.
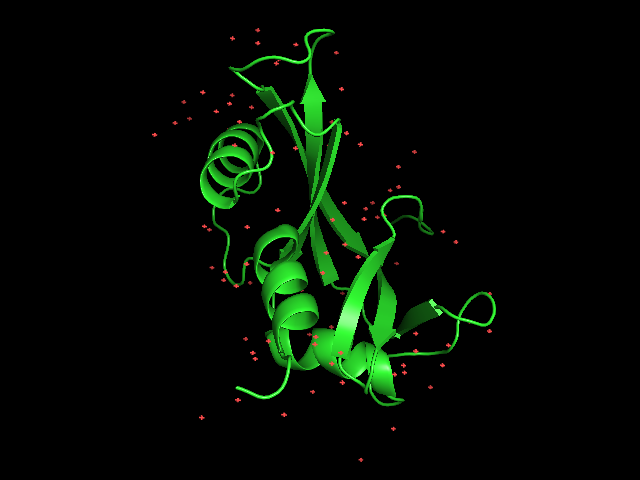
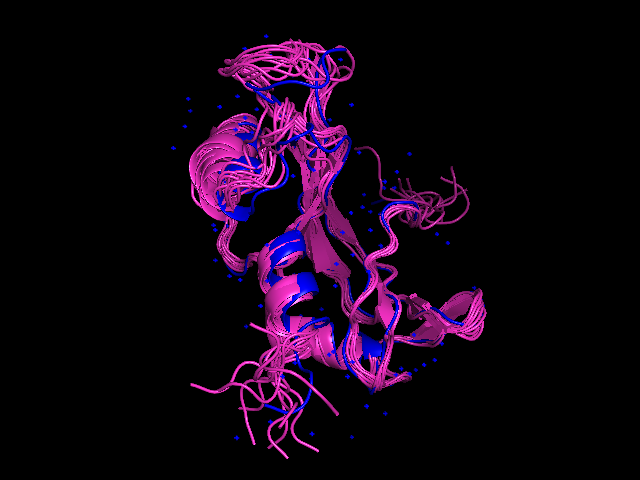
На рисунке 3 можно увидеть, как соотносятся структуры, полученные с помощью ЯМР со структурой, полученной рентгеноструктурным анализом. Совмещение построено с помощью программы LCore. =)
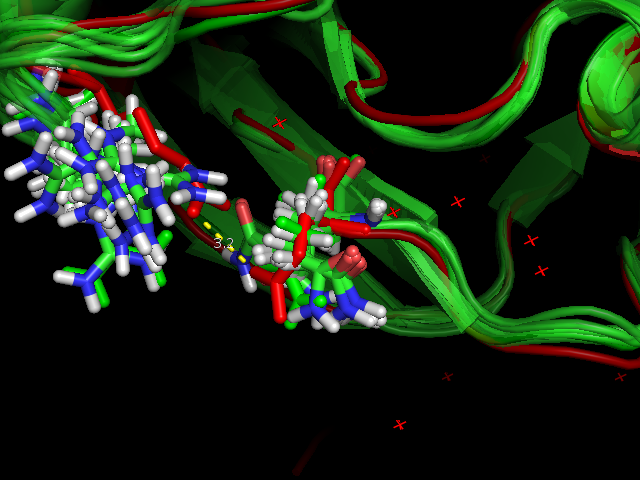
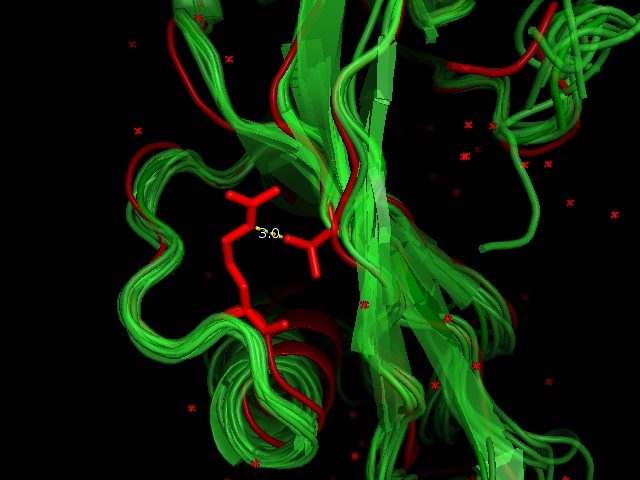
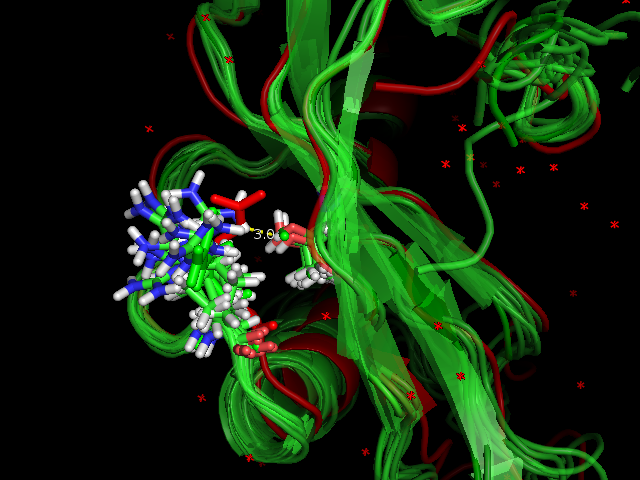
В качестве остовной водородной связи рассмотрели водородную связь между и Asp24 (O) и Phe28 (N). Длина связи в структуре 1AGI, полученной с помощью РСА, равна 3.0 σ. Эту водородную связь имеют все модели структуры 1GIO, длина её равно либо 3.0 σ, либо 3.1 σ, что соответствует нормальной длине остовной водородной связи. На рисунке 4 показана водородная связь для структуры, полученной методом РСА, и для первой модели 1GIO.

В качестве водородной связи боковых цепей в ядре белка рассмотрим связь между Trp80 (OG1) и Arg22 (NE). Для структуры 1AGI длина водородной связи равна 3.0σ. Однако этой связи нет ни в одной модели 1GIO! Это одна из десятка водородных связей между боковыми группами, которые есть в ядре белка, и в структурах ЯМР ни одной нет.=( Водородная связь для структуры РСА и остатки аминокислот, соответствующих структурам ЯМР, показаны на рисунке 5.
Водородная связь между Gln78 (OE1) и Arg22 (NH1) - водородная связь между петлей и частью бета-листа, выходящими на поверхность белка. Для неё повторяется та же история, что и для предыдущей водородной связи. =( Водородная связь для структуры РСА (рисунок 6) и остатки аминокислот, соответствующих структурам ЯМР, показаны на рисунке 7.
Итоговые результаты измерений приведены в таблице:
| Где расположена водородная связь | Донор и акцептор электронов | Расстояние в РСА | Число моделей ЯМР, в которых есть связь | Минимальное расстояние в ЯМР | Максимальное расстояние в ЯМР | Медианное расстояние в ЯМР |
| Остовная водородная связь в альфа-спирали | Phe28 (N) и Asp24 (O) | 3.0 σ | 10/10 | 3.0 | 3.1 | 3.1 |
| Между боковыми группами в ядре белка | Arg22 (NE) и Trp80 (OG1) | 3.0 σ | 0/10 | - | - | - |
| Между петлями на поверхности белка | Arg22 (NH1) и Gln78 (OE1) | 3.2 σ | 0/10 | - | - | - |
Подводя итоги, можно сказать, что элементы вторичной структуры действительно очень стабильны в растворе, однако петли в ядре белка, а так же выходящие на поверхность - нет.