Восстановление кристалла из PDB файла

|

|

|

|

|

|

|

|

|
Информация о элементарной кристаллографической ячейке находится в PDB-файле в строке с идентификатором CRYST1. В частности, в рассматриваемой структуре ABC-транспортерного периплазматического связывающего аминокислоты белка с идентификатором 2YJP поле CRYST1 выглядит как:
Первые три числа – значения длин направляющих векторов кристалла: |a|=58.710 Å, |b|=91.590 Å, |c|=158.300 Å следующие три – углы между направляющими векторами: α=90.00, β=90.00, γ=90.00. Далее идет обозначение группы семметрии по символике Германа-Могена: P 1 21 1. Последнее число означает, что число молекул в ячейке равно 12. Таким образом, ячейка имеет форму правильного параллелепипеда.
На рис.1 приведена ассиметрическая единица данного pdb-файла.

Рис.1. Ассиметрическая единица 2yjp. Включает в себя 3 биологические единицы АBC-транспортерного периплазматического связывающего аминокислоты белка.
На рис.2-4 показана элементарная ячейка с разных ракурсов в окружении других молекл, образующих кристалл. Для наглядности каждая повторяющаяся ассиметрическая единица покрашена по входящим в нее цепям. Границы элементарной ячейки выделены красным.



Рис.2. Структура кристалла, восстановленного из 2yjp. Исходная ассиметрическая единица покрашена радугой. Прочие ассиметрические единицы покрашены по цепям. Границы элементарной ячейки выделены красным. Для удобства осображения часть молекул, образующих кристалл и загораживающих элементарную ячейку, убраны.
В связи с большим размером элементарной ячейки и большим числом входящих в нее молекул, рассмотрим межмолекулярные контакты, в которых участвует только одна биологическая единица, обозначенная как цепь А. Для выявления полярных контактов использовались следующие команды Pymol:
select 2yjp_hyd, cha and resn Lys+Arg+His+Tyr+Asp+Glu+Ser+Thr+Cys+Asn+Gln
select other_hyd, not cha and resn Lys+Arg+His+Tyr+Asp+Glu+Ser+Thr+Cys+Asn+Gln
select wow, resn HOH and (2yjp_hyd around 3.5) and (other_hyd around 3.5)
show sticks, byres (2yjp_hyd and (other_hyd around 3.5))
show sticks, byres (other_hyd and (2yjp_hyd around 3.5))
distance hbonds_2, other_hyd, 2yjp_hyd , 3.5, 2
Как видно на рис.5, у белковой цепи А 5 соседей в кристалле, с каждым из которых имеется отдельная зона контакта. Также дополнительно был использован скрипт color_h.py для выявления гидрофобных взаимодействий цепи А. При детальном рассмотрении боковых радикалов, выступающих у цепи А наружу, становится ясно, что смотрящие наружу белка группы не являются гидрофобными. Таким образом, гидрофобные контакты с соседними по кристаллу молекулами невозможен.
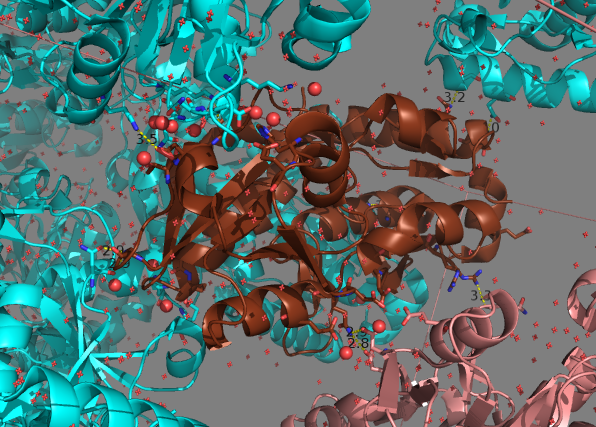
Рис.5. Зоны контактов белковой цепи А с соседними белковыми молекулами. Аминокислотные остатки, участвующие в контакте, показаны палочками. Молекулы воды, принимающие участие в контактах, выделены шариками. Цепь А покрашена в коричневый цвет, другие цепи той же ассиметрической единицы покрашены в розовый, прочие белковые молекулы показаны голубым. Границы элементарной ячейки выделены линиями.

Рис.6. Гидрофобные остатки белковой цепи А. Чем гидрофобнее остаток, тем он краснее. Гидрофобные остаки выделены толстыми палочками. Как видно из рисунка, на поверхность белка они не выступают.
Согласно записи в базе данных PDB, ABC-транспортерный периплазматический связывающий аминокислоты белок является мономерным. Кроме того, имеющиеся у одной биологической единицы контакты малочисленны и представлены в основном полярными контактами. Следовательно, в организме данные взаимодействия недостаточно сильны для формирования олигомеров.
3hdd
Рассмотрим структуру комплекса гомеодомена engrailed Drosophila melanogaster (ДНК-связывающий домен транскрипционных факторов) с ДНК, представленную в файле 3hdd.pdb. На рис.7 видно, что в структуре присутвтвует две белковые молекулы, причем одна из них (белковая цепь В) связывается на самом краю молекулы ДНК.
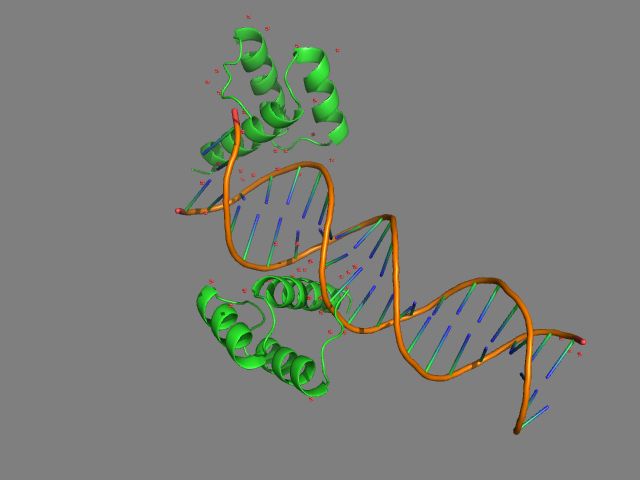
Рис.7. Структура 3hdd. Белковые цепи показаны зеленым, остов ДНК - оранжевым, направления расположения азотистых оснований - синим.
С помощью команды symexp были реконструированы молекулы соседних ячеек, находящиеся на расстоянии не более 3.5 Å от цепи B гомеодомена (рис.8). Как видно из рис.9, молекула ДНК исходной ассиметрической ячейки имеет липкий конец, способный спариваться с нуклеотидом другой цепочки ДНК из соседней ассиметрической единицы (А с Т). Кроме того, наблюдаются стэкинг-взаимодействия нуклеотидов двух соседних молекул ДНК.
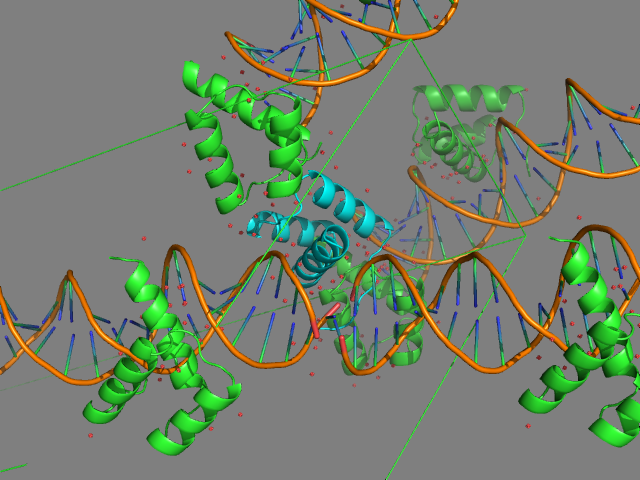
Рис.8. Восстановление соседних ассиметрических единиц кристалла. Белковая цепь В исходной ассиметрической единицы выделена голубым. Прочие белковые цепи показаны зеленым.

Рис.9. Взаимодействие двух молекул ДНК. Молекула исходной ассиметрической единицы показана фиолетовым цветом, молекула соседней ассиметрической единицы - зеленым. Цепь В исходной ассимерической единицы покрашена голубым.
Далее были найдены полярные контакты цепи В с соседними молекулами. Как видно из рис.10, цепь В имеет контакты не только с ДНК из своей ассиметрической единицы, так и с ДНК из соседней единицы.

Рис.10. Полярные контакты белковой цепи В сдругими молекулами. Цепь В показана голубым, молекулы воды - красными шариками, цепь ДНК исходной ассиметрической единицы - фиолетовая, цепь ДНК соседней единицы - зеленая. Полярные контакты в пределах 3.5 Å выделены желтыми пунктирами.
Кроме того, были найдены полярные контакты цепи В с другими цепями В, соседствующими с данной цепью в кристалле (рис.11).
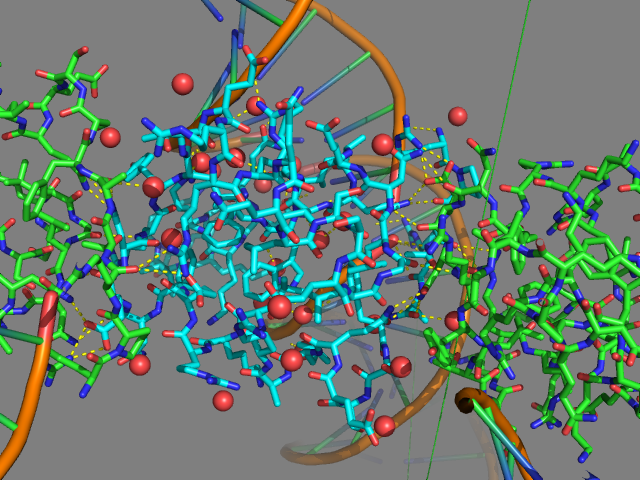
Рис.11. Полярные контакты белковой цепи В сдругими молекулами. Цепь В показана голубым, молекулы воды - красными шариками, цеппи В из соседних ассиметрических единиц показаны зеленым. Полярные контакты в пределах 3.5 Å выделены желтыми пунктирами.
Таким образом, получается, что в кристалле цепь В имеет сложные взаимодействия сразу с 2 молекулами ДНК и 2 молекулами белка. Странность в расположении на краю цепочки ДНК в единичной ассиметрической единице объясняется сложным устройством кристалла, а не взаимодействием гомеодомена с концом двуцепочечной ДНК.
Примеры PDB файлов, ассиметрические единицы которых не совпадают с биологической единицей
Зачастую белки в организме фукнционируют в виде олигомеров - комплексов из нескольких молекул белка. Поскольку мономеры в этих комплексах соединены достаточно прочно, связи между ними могут принимать участие в образовании кристаллов. Биологической единицей называется та структура, в виде которой белок выполняет свою функцию. Ассиметрической же единицей называется комплекс, образующийся в ячейке кристалла.
Рассматриваемая в начале практикума структура 2yjp соответсвует заданному критерию. Описанная в RCSB ассиметрическая единица имеет 3 молекулы белка. При этом, биологическая единица состоит из 1 молекулы (рис.12). Такое соотношение можно объяснить деформацией структур отдельных биологических едниц в процессе кристаллизации так, что воспроизвести кристалл можно только с помощью операций симметрии над 3 слипшимися вместе биологическими единицами.

Рис.12. А - ассиметрическая единица 2yjp. В - одна из биологических единиц (цепь А).
Далее для выполнения задания был проведен расширенный поиск в базе RCSB структур. Сначала были найдены стуктуры, ассиметрические единицы которых содержат 4 и больше молекулы белка, а биологические единицы - 1-2 молекулы. Одна из найденных структур - 5B1H, цистатоин-бета-синтаза из Lactobacillus plantarum. Биологическая единица представляет из себя гомодимер, а ассиметрическая единица включает в себя 4 белковые цепи.

Рис.13. А - ассиметрическая единица 5b1h. В - биологическая единица.
Наконец, были найдены структуры, ассиметрическая единица которых имеет 1-2 молекулы белка, а биологическая - 3 и более. Найденный пример - 5G4K, флороклюкон-редуктаза из Clostridium sp.. Биологическая единица - это гомотетрамер. Ассиметрическая единица включает в себя только половину биологической - 2 молекулы белка.
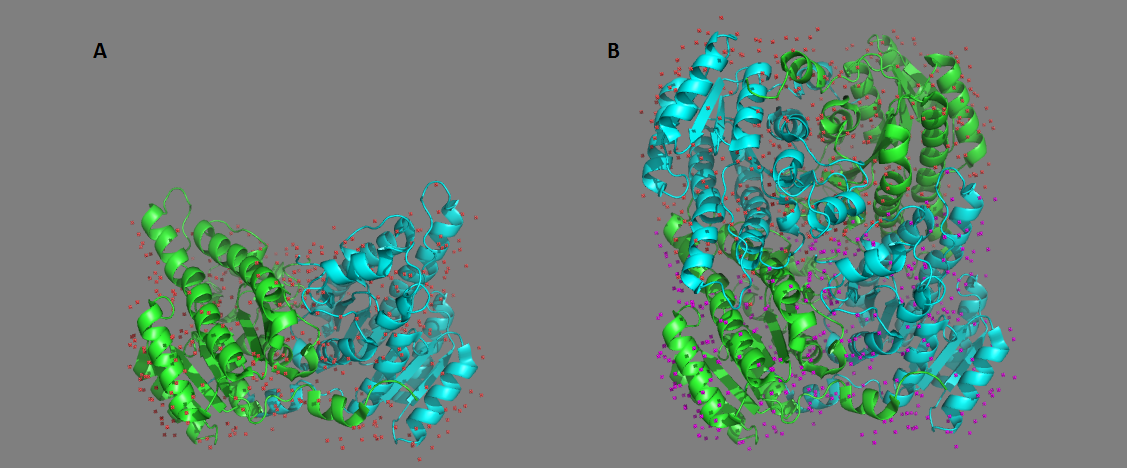
Рис.14. А - ассиметрическая единица 5g4k. В - биологическая единица, восстановленная из ассиметрической.
Последнее изменение: 24.09.2014