Сравнение водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА

|

|

|

|

|

|

|

|

|
Для выполнения данного практикума были взяты структруры пермеазы глюкозы из B.subtilis, полученные двумя способами: ЯМР (структура 1AX3, 16 состояний) и РСА ( структура 1GPR, разрешение 1.9 Å).
Для получения выравнивания структур использовалась команда pymol: align. На рис.1. приведено выравнивание полных структур. На рис.2-3 показано выравнивание отдельных элементов вторичной структуры.

Рис.1. Полное выравнивание структур 1AX3 и 1GPR. 1GPR показана голубым, отдельные модели 1AX3 показаны белым.

Рис.2. Выравнивание α-спиралей в структурах 1AX3 и 1GPR. 1GPR показана голубым, отдельные модели 1AX3 показаны белым.

Рис.3. Выравнивание β-листов в структурах 1AX3 и 1GPR. 1GPR показана голубым, отдельные модели 1AX3 показаны белым.
На рисунках видно, что положение α-спиралей и β-листов, в целом, совпадает, однако есть небольшие участки, где α-спираль определяется только в РСА структуре или только в ЯМР. Вероятно, это связано с тем, что в этих участках определяемые α-спирали очень короткие, имеют несколько съехавшую топологию и такое определение/не определение структуры является погрешностью алгоритмов pymol по обнаружению вторичных структур.
Также заметно, что есть часть белка, которая показывает высокую стабильность в ЯМР и хорошо совмещается с результатами РСА, но ближе к N- и C-концам, где нет α-спиралей и β-листов, наблюдается большая подвижность белковой цепи.
Для дальнейшей работы будем считать, что водородная связь существует, если между образующими ее атомамими расстояние меньше 3.5 Å. Для анализа были выбраны следующие связи:
- остовная водородная связь в β-листе в ядре белка: 43 (Phe), 131 (Ile)
- остовная водородная связь в α-спирали: 22 (Glu), 41 (Asp)
- водородная связь боковых радикалов аминоксилот в ядре белка: 66 (Thr), 68 (His)
- водородная связь боковых радикалов аминоксилот на поверхности белка: 73 (Gln), 79 (Glu)
На рис. 4-7 приведены изображения данных водородных связей в структурах 1AX3 и 1GPR
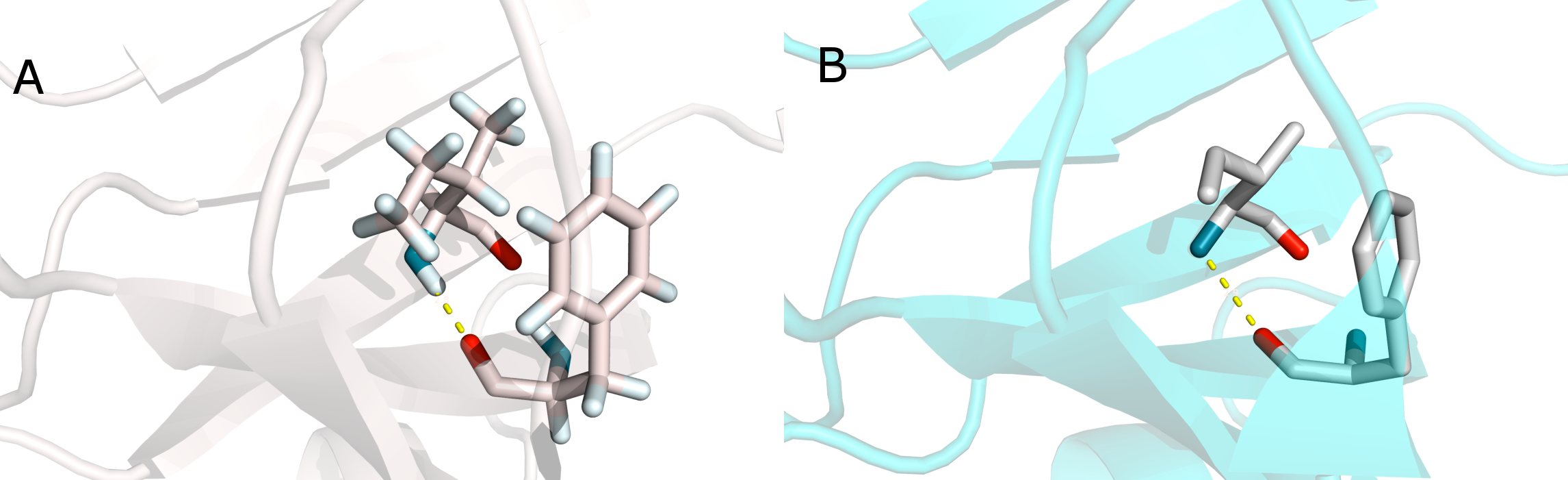
Рис.4. Остовная водородная связь в β-листе в ядре белка между 43 (Phe) и 131 (Ile). А - в стуктуре 1AX3. В - в структуре 1GPR. Водородная связь показана пунктиром.
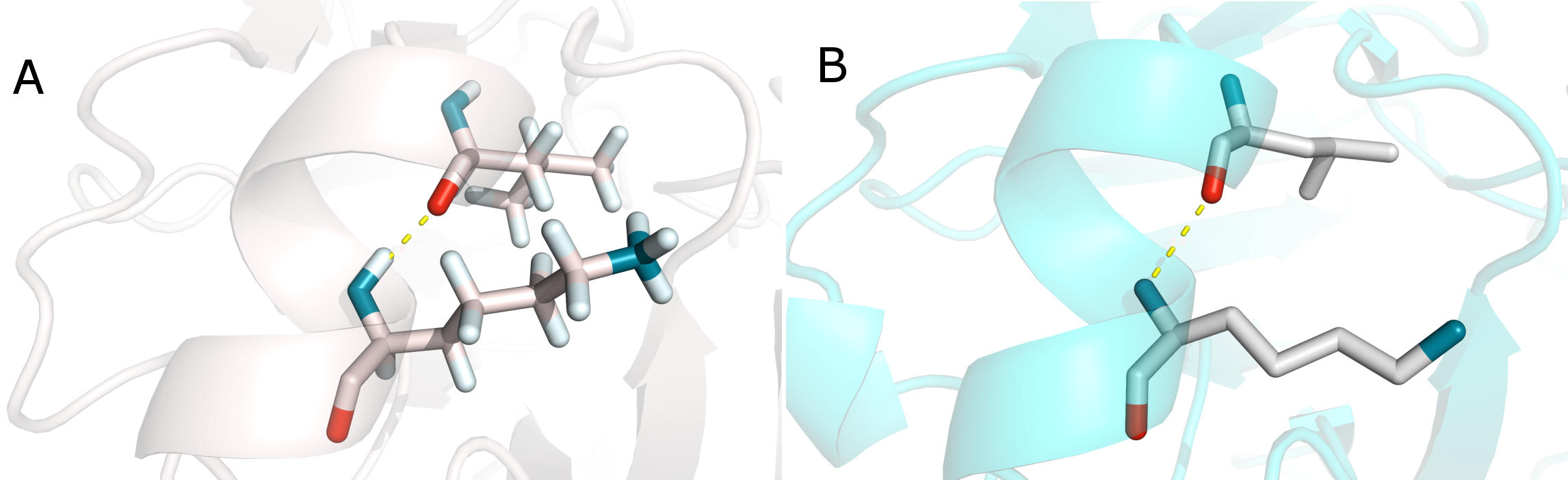
Рис.5. Остовная водородная связь в α-спирали между 22 (Glu) и 41 (Asp). А - в стуктуре 1AX3. В - в структуре 1GPR. Водородная связь показана пунктиром.

Рис.6. Водородная связь боковых радикалов аминоксилот в ядре белка между 66 (Thr) и 68 (His). А - в стуктуре 1AX3. В - в структуре 1GPR. Водородная связь показана пунктиром.

Рис.7. Водородная связь боковых радикалов аминоксилот на поверхности белка между 73 (Gln) и 79 (Glu). А - в стуктуре 1AX3. В - в структуре 1GPR. Водородная связь показана пунктиром.
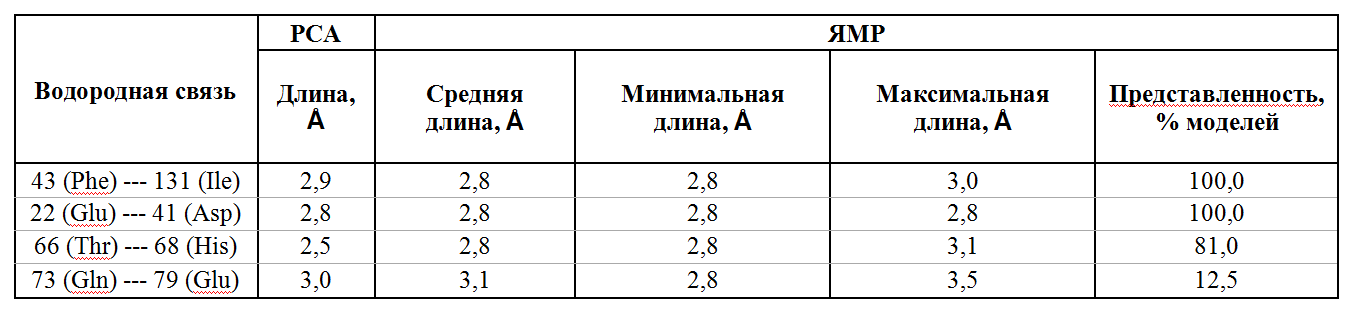
Как видно из рис.4-7 а также таблицы 1, остовные связи, формирующие элементы вторичной структуры, отличаются очень высокой стабильностью (представлены у всех рассмотренных структур). Водородные связи между боковыми радикалами остатков проявляют большую подвижность. Как видно из таблицы 1, связь между аминокислотными радикалами более стабильна, если находится не на поверхности белка, а внутри; видимо из-за более тесного и более гидрофобного окружения, формирование данной связи более вероятно, чем на поверхности белка, где остатки подвижнее всего и могут формировать водородные связи не тлолько друг с другом, но и с молекулами воды.
Таблица 1. Сравнение водородных связей.

Последнее изменение: 24.09.2014