Исследование белок-нуклеиновых контактов
Исследование контактов между молекулами белка и нуклеиновой кислоты
В заданном файле 1BG1.pdb была обнаружена лишь одна цепь ДНК, поэтому была скачана биологическая еденица с сайта Macromolecular Structure Database EBI , в которой, помимо второй цепи ДНК, оказалась вторая субъединица белка (впрочем идентичная первой). Однако было посчитано целесообразным рассматривать взаимодействия с ДНК только одной еденицы (идентификатор цепи - D), поэтому на всех изображениях, кроме первых двух, второй молекулы белка нет.Для начала, чтобы наиболее приближенно исследовать взаимодействие белка с ДНК, был написан скрипт, визуализирующий наиболее вероятные атомы, вовлеченные в связывание:
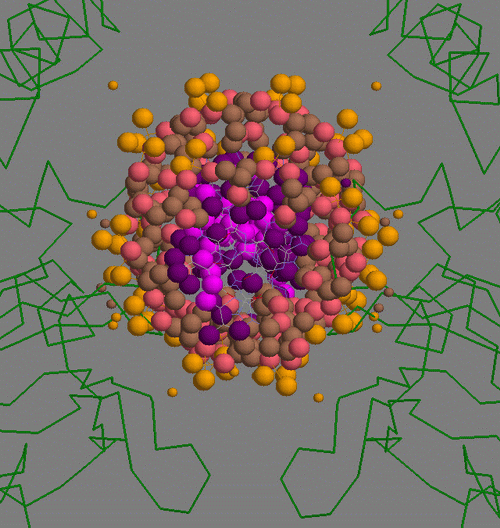
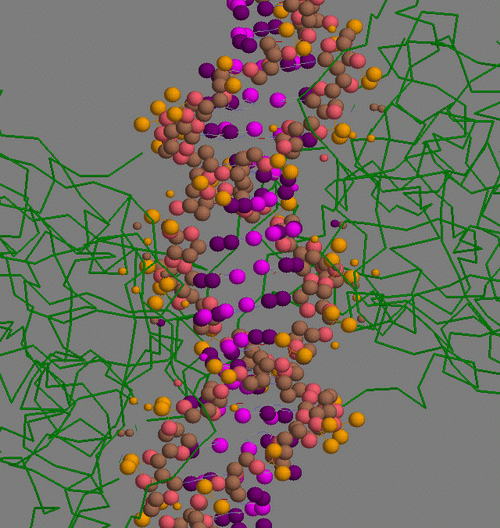
Малыми шариками показаны атомы белка, вступающие во взаимодействие, большими - атомы ДНК, за исключением атомов малой бороздки. Принцип раскраски ясен из таблицы:
| Контактирующие с белком участки ДНК | Полярные | Гидрофобные | Всего | |
|---|---|---|---|---|
| Остатки 2'-дезоксирибозы | 2 (розовый) | 14 (голубой) | 16 | |
| Остатки фосфорной кислоты | 26 (оранжевый) | 0 | 26 | |
| Остатки азотистых оснований со стороны большой бороздки | 2 (сиреневый) | 2 (фиолетовый) | 4 | |
В таблице не представлены данные для атомов из малой бороздки ДНК, поскольку скрипт не выявил взаимодействий для них.
Очевидно, что главную роль в связывании белка с ДНК играют гидрофобные взаимодействия с остатками дезоксирибизы и полярные взаимодействия с остатками фосфорной кислоты.
Поиск специфических контактов, обеспечивающих узнавание сайта в молекуле ДНК
Для отбора специфичных участков связывания, я основывался на том факте, что они обычно расположены обособлено и сгруппировано. Был проделан доскональный анализ данных скрипта. В результате этой работы были отобраны аминокислоты, принадлежащие к трем гипотетическим группам. Также был написан скрипт, визуализирующий данное представление и составлена таблица контактирующих атомов.
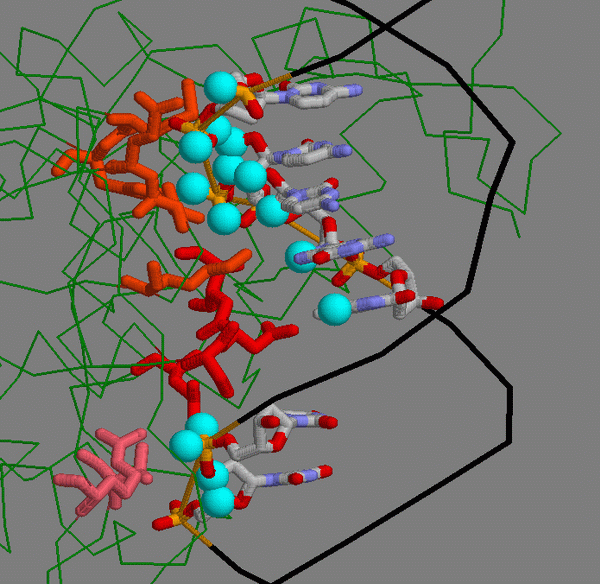 |
Атомы белка | Атомы ДНК |
|---|---|---|
| I группа | ||
| *382:d.nh1 | *1006:c.o1p | |
| *432:d.cb | *1005:c.c3* | |
| *432:d.cg2 | *1005:c.c4* | |
| II группа | ||
| *331:D.cg | *1009:b.c4* | |
| *332:D.ne2 | *1010:b.o1p | |
| *343:D.cg1 | *1009:b.c3* | |
| *343:D.cg2 | *1009:b.c2* | |
| *344:D.n | *1009:b.o2p | |
| *344:D.ne2 | *1008:b.o1p | |
| *340:D.nz | *1010:b.o2p | |
| III группа | ||
| *465:D.og | *1006:c.o2p | |
| *466:D.nd2 | *1012:b.o4 | |
| *467:D.cb | *1010:b.c2* | |
| *467:D.cg2 | *1011:b.c8 | |
| *469:D.ne2 | *1006:c.o2p | |
На рисунке тремя оттенками красного показаны три потенциальные группы связывания. Крупными шариками показаны отдельные атомы ДНК, вступающие в контакт. Можно заметить, что самая верхняя на рисунке
группа рыжего цвета (группа II в таблице) образует наиболее сильное связывание с ДНК, но группа красного цвета в центре (III) образует связи с обеими цепями ДНК, что делает это взаимодействие достаточно прочным.
Последняя группа (I) самая слабая по своему взаимодействию с ДНК, но, располагаясь скраю, придает комплексу ДНК-белок гибкость.
| Интересно то, что группы связывания никак не объединены вторичной структурой. Удалив ДНК из отображения и раскрасив белок по структуре, можно увидеть, что аминокислотные остатки, предсказанные как связывающиеся с ДНК, располагаются в совершенно разных структурных участках. Отдельные группы обведены. | 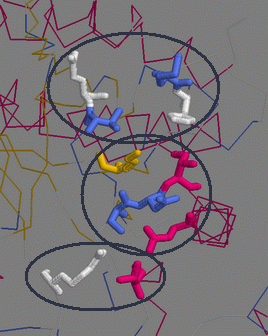 |
|
| Для отдельного рассмотрения был выбран 344-й глутамин. Он содержит два атома азота и может образовывать две полярные связи (см. таблицу). Здесь изображен его контакт с 1008-м цитозином. | 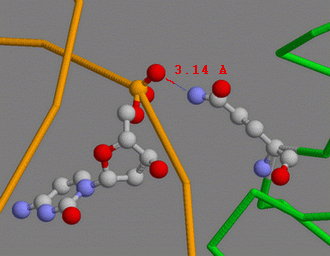 |
|
Описание функций исследованного белка
Белок STAT3 является передатчиком сигнала и активатором транскрипции 3 (Signal Transducers and Activators of Transcription). STAT-белки связывются с рецепторами на клеточной мембране, фосфорилируются киназами и димеризуются. Далее они перемещаются в ядро, где связываются с промоторами определенных генов. STAT3 существует в форме гомо- или гетеродимера (в паре с другим STAT-белком, например STAT1).ДНК-связывающий домен располагается в STAT3_MOUSE с 321 по 574 аминокислотный остаток. Он обладает иммуноглобулино-подобной формой, подобно белку-супрессору опухолей p53. По полной выборке было построено выравнивание. Проведя анализ, было установлено, что из 11, предсказанных нами аминоксилотных остатков, наиболее консервативными являются четыре: лизин 340, аргинин 382, валин 332 и глутамин 469. Интересно (и обидно), что самый большой из абсолютно консервативных участков располагается между 458-м и 464-м остатками, таким образом не вступая во взаимодействия, но непосредственно предшествуя группе связывающихся остатков (465-467). Также примечательно, что в каждой отмеченной нами группе есть хотя бы один высококонсервативный остаток, и абсолютно все остатки принадлежат ДНК-связывающму домену.
Построение схемы контактов белка с ДНК
При первой попытке запустить программу nucplot, она выдала ошибку. Выяснилось, что данная структура содержить слишком много аминокислотных остатков. Было решено создать PDB-файл только с одной цепочкой белка. Такой файл программа приняла и в результате выдала следующую схему:
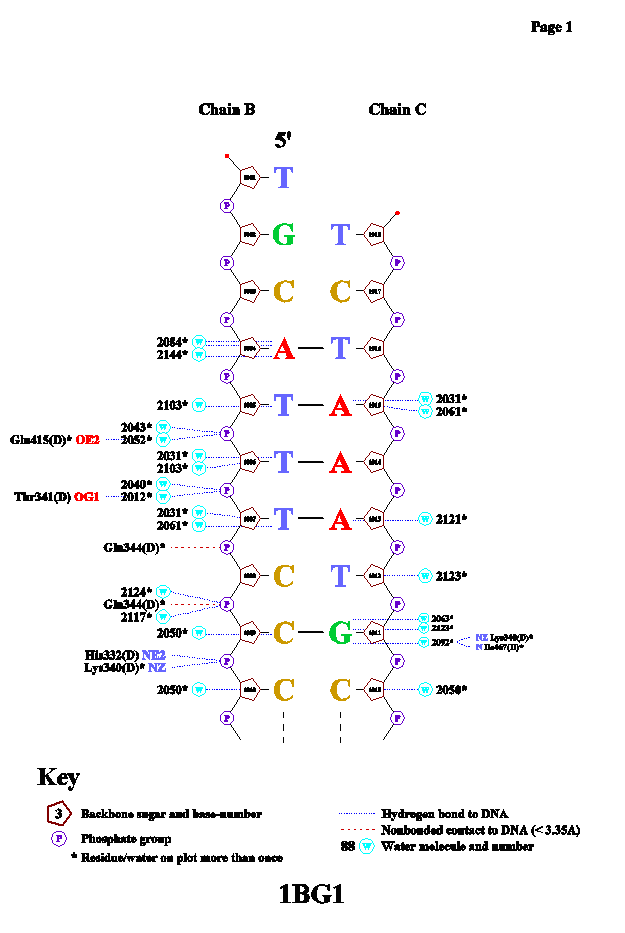 |
Я, по-правде говоря, был разочарован данной программой. Количество найденных взаимодействий смехотворно мало. Утешает лишь то, что все эти четыре контакта были предсказаны нами абсолютно точно. |
© Донченко Иван, 2007