Ралдугина Василиса Студентка Факультета биоинженерии и биоинформатики МГУ имени М.В. Ломоносова  |
Обо мне |
Ресеквенирование. Поиск полиморфизмов у человека
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| export PATH=${PATH}:/home/students/y06/anastaisha_w/hisat2-2.0.5 |
| Команда | Функция | Выдача |
| hisat2-build chr9_2.fasta chr9_2 | Индексирование референсной последовательности |
Индексированный файл chr9_2.fasta |
| hisat2 -x chr9_2 -U chr9_2_out.fastq --no-spliced-alignment --no-softclip >align1.sam | Выравнивание чтений после чистки с референсной последовательностью | Файл, который содержит выравнивание формата SAM align1.sam |
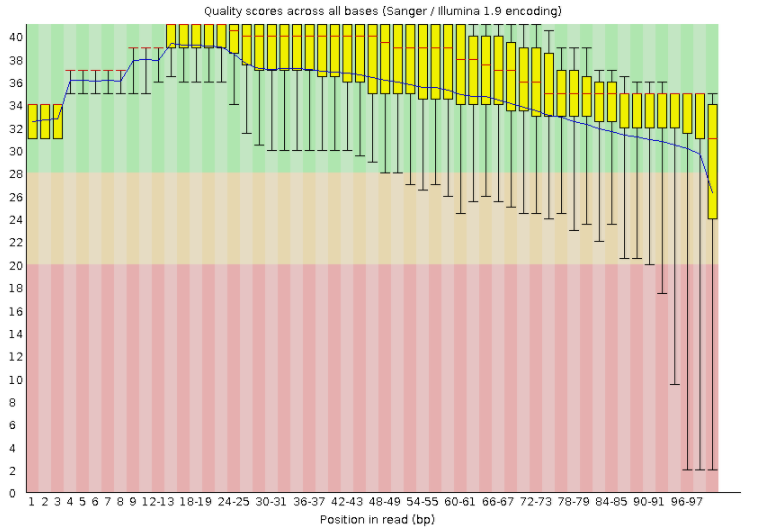
Программа картирования была запущена с параметрами -x (путь к индексу) -U (путь к чтениям) --no-spliced-alignment (запрет на картирование с разрывами) --no-softclip (кртирование без подрезания чтений).
Далее необходимо было проанализировать, полученное выравнивание. Для этого я использовала программу Samtools. Она работает с файлами в формате SAM.
| Команда | Функция | Выдача |
| samtools view align1.sam -bo align1.bam | Программа переводит файл в формат bam | align1.bam |
| samtools sort align1.bam -T sorted.txt -o sorted.bam | Сортировка выравнивания чтений и референса по координате в референсе | sorted.bam |
| samtools index sorted.bam | Индексирование отсортированного выравнивания | sorted.bam |
| samtools idxstats sorted.bam > totalread.txt | Запись числа откартировавшихся чтений | totalread.txt |
Выяснилось, что на хромосому откартировался 2101 рид. 40 ридов не были откартированы вообще.
Часть III: анализ SNP
| Команда | Функция | Выдача |
| samtools mpileup -uf chr9_2.fasta sort.bam > snp.bcf | Создание файла с полиморфизмами | snp.bcf |
| bcftools call -cv snp.bcf -o snp.vcf | Определения различий | snp.vcf |
В результате были найдены 63 snp. Из них были выбраны 3 штуки и описаны в таблице. У 1 высокое качество прочтения и хорошее покрытие.
| Координата | Тип полиморфизма | В референсе | В чтениях | Покрытие в этом месте | Качество покрытия |
| chr 9:117552885 | замена | T | C | 73 | 221.999 |
| chr 9:136130610 | замена | G | A | 3 | 4.13269 |
| chr 9:136131592 | замена | G | C | 7 | 36.0081 |
Далее необходимо было аннотировать полученные SNP. Это произвелось с помощью программы ANNOVAR.
Подготовка входных файлов включала удаление инделей из snp.vcf и использование скрипта convert2annovar.pl (perl /nfs/srv/databases/annovar/convert2annovar.pl -format vcf4 /nfs/srv/databases/ngs/vasidze/snp.vcf > /nfs/srv/databases/ngs/vasidze/snp.avinput).
Затем была проведена аннотация с помощью команд:
- dbnsp: perl /nfs/srv/databases/annovar/annotate_variation.pl -filter -out rs.snp -build hg19 -dbtype snp138 snp.avinput /nfs/srv/databases/annovar/humandb/
- 1000genomes: perl /nfs/srv/databases/annovar/annotate_variation.pl -filter -out rs.1000genomes -buildver hg19 -dbtype 1000g2014oct_all snp.avinput /nfs/srv/databases/annovar/humandb/
- GWAS: perl /nfs/srv/databases/annovar/annotate_variation.pl -filter -out rs.gwas -build hg19 -dbtype gwasCatalog snp.avinput /nfs/srv/databases/annovar/humandb/
- Clinvar: perl /nfs/srv/databases/annovar/annotate_variation.pl -filter -out rs.clinvar -dbtype clinvar_20150629 -buildver hg19 snp.avinput /nfs/srv/databases/annovar/humandb/
- Refgene: perl /nfs/srv/databases/annovar/annotate_variation.pl -out rs.refgene -build hg19 snp.avinput /nfs/srv/databases/annovar/humandb/
Из всех SNP 56 имеют rs, 7 не имеют.
Для рассмотрения выдачи Clinvar можете проследовать по ссылке: выдача clinvar
Выдача GWAS:
| Координата | Gwas |
| chr 9:117552885 | Crohn's disease |
| chr 9:117553249 | Inflammatory bowel disease,Ulcerative colitis |
| chr 9:124906723 | Obesity-related traits |
| chr 9:136131188 | Coagulation factor levels,Tumor biomarkers |
| chr 9:136131322 | mean corpuscular hemoglobin concentration |
| chr 9:136131415 | End-stage coagulation |
| chr 9:136132754 | Malaria |
| chr 9:136132908 | Venous thromboembolism,Malaria |
| chr 9:136137065 | Venous thromboembolism,D-dimer levels,Activated partial thromboplastin time |
| chr 9:136137106 | Coagulation factor levels |
В БД RefSeq SNP подразделяется на exonic, splicing, ncRNA, UTR5 , UTR3, intronic, upstream, downstream, intergenic.
В ходе поиска по RefSeq было установлено, что 3 snp относятся к UTR3, 14 к exonic, 43 к intronic и 2 к downstream.
Помимо этого проводился поиск по базе данных dbsnp. В результате было получено 3 файла .log, .dropped и .filtered. В последнем содержались 7 snp.
Поиск по базе данныз 1000g также дал нам три файла, аналогичные предидущим. В файле .filtered содержатся 7 snp.
Сводная информация по всем аннотациям в трех банка представлена в файле pr11.xlsx
© Raldugina Vasilisa 2016