Ралдугина Василиса Студентка Факультета биоинженерии и биоинформатики МГУ имени М.В. Ломоносова  |
Обо мне |
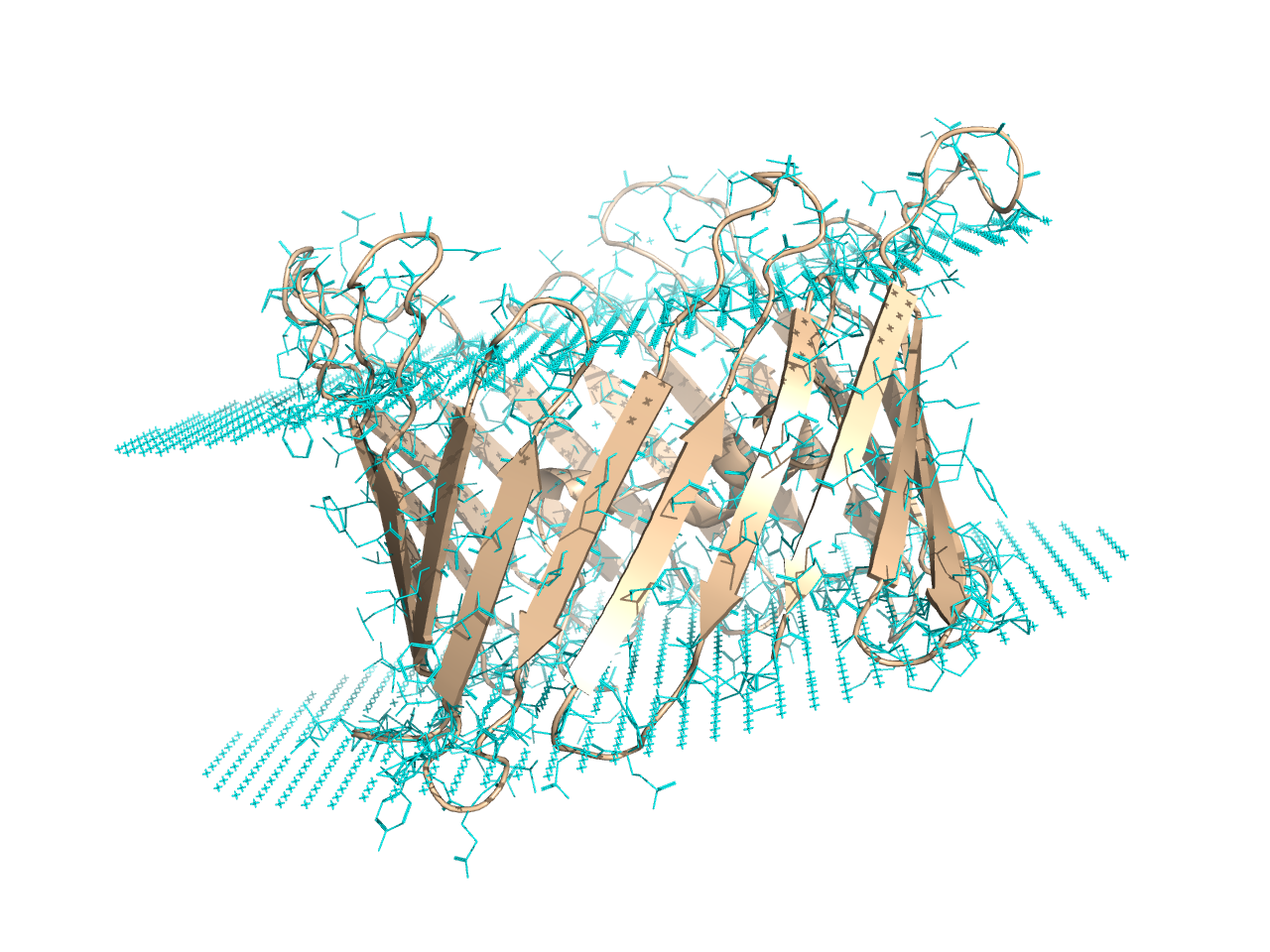
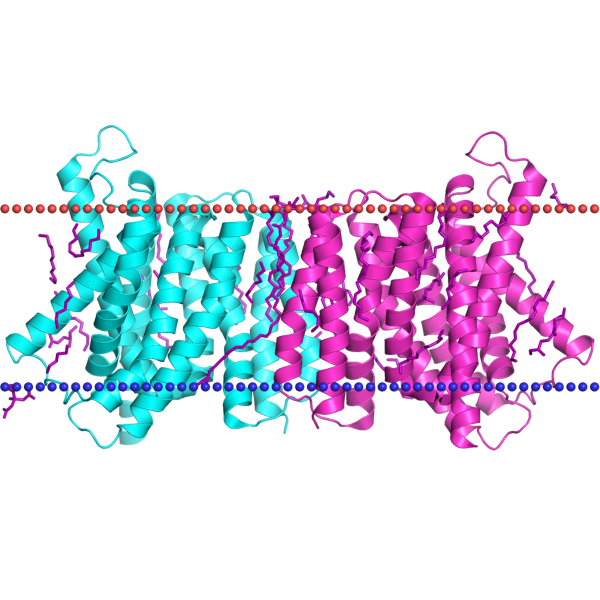
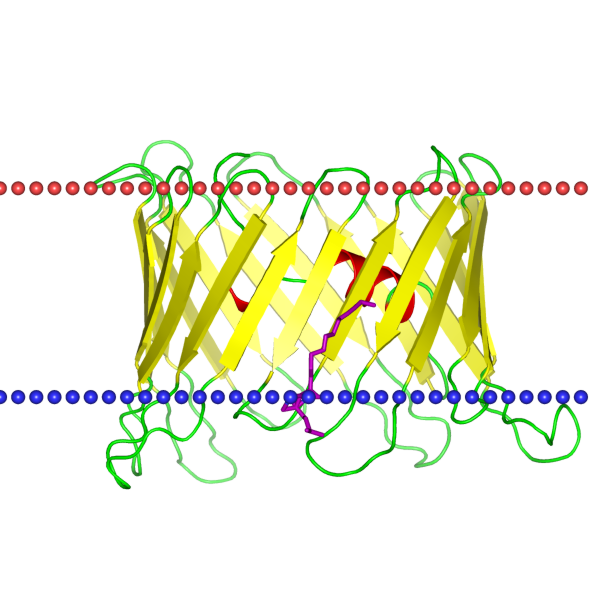
Мембранные белкиБаза данных OPM Для выполнения задания я выбрала белок 5Y79 - триозофосфатный / фосфатный транслокатор в комплексе с 3-фосфоглицератом из организма Galdieria sulphuraria (Рис. 1). Затем с помощью поиска по уровням классификации было необходимо найти любой белок, в трансмембранной части которого находятся бета-листы и описать оба белка по заданным параметрам. В качестве белка с бета-листами был выбран 3EMN - белок 1 потенциал-зависимого анион-селективного канала (Mus musculus). В таблице ниже приведены описания белков, а также изображения их расположения по отношению к мембране. Красным цветом показана внешняя часть мембраны, а синим - внутренняя.
Анализ предсказания трансмембранных спиралей
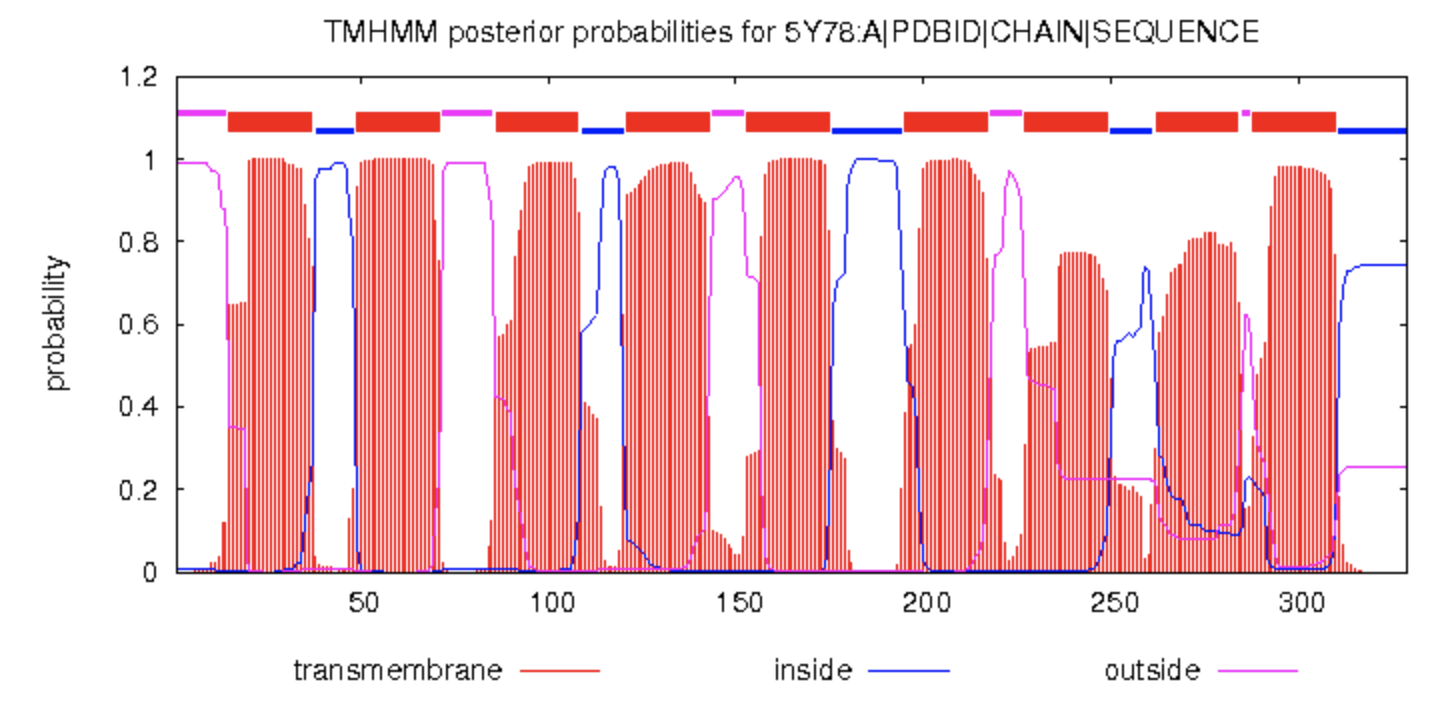
В данном задании было необходимо оценить корректность работы сервисов
TMHMM и
Phobius, предназанченнных для предсказания трансмембранных
участков белков. Для этого оба сервиса были запущены для белка 5Y79 (цепь А), и полученные результаты
были сохранены в текстовом и графическом видах.
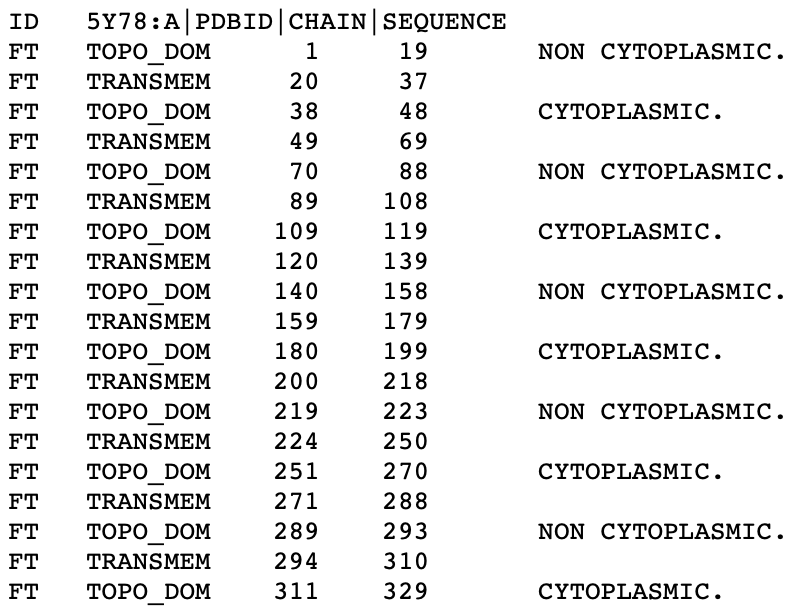
Рассмотрим теперь выдачу Phobius. В тестовом формате заданы следующие обозначения: TRANSMEM - трансмембранная часть, CYTOPLASMIC - часть белка, обращенная в цитоплазму, NON CYTOPLASMIC - часть белка, обращенная наружу. Интересующие нас участки находятся в полях TRANSMEM. В графическом формате все аналогично предыдущей программе с некоторым изменением цветовой схемы: серый - трансмембранная часть белка, зеленый - цитоплазматическая, синий - наружняя. Как и TMHMM, Phobius предсказал 9 трансмембранных спиралей, при наличии 10. "Верные" спирали вновь имеют не совсем правильные координаты примерно с такой же погрешностью.
Таким образом, для исследуемого белка обе программы сработали одинаково плохо. Оба сервиса предсказали на одну трансмембранную часть меньше, чем указано в БД OPM и вычислили неточные границы. База данных TCBD
В следующем задании было необходимо найти описания исследуемых белков в базе данных
TCBD (Transporter Classification Database).
Эта база предоставляет детальную классификацию мембранных транспортных белков, объединяя
в себе функциональные и филогенетические данные. В ней представлена информация для более чем
600 семейств транспортных белков. Транспортные системы классифицируются на основе 5 критериев,
каждому из которых соответсвует один из 5 символов TC-кода.
В базе данных приводится подробное описание всех крупных систематических групп до семейства включительно. Белок 3EMN - зависимый от потенциала анион-селективный канал 1 (VDAC-1) представляет собой бета-бочковый белок, который у человека кодируется геном VDAC1, расположенным на хромосоме 5. Он формирует ионный канал во внешней митохондриальной мембране, а также во внешней клеточной мембране. В митохондриях это позволяет АТФ диффундировать в цитоплазму. В клеточной мембране он участвует в регуляции объема. Внутри всех эукариотических клеток митохондрии ответственны за синтез АТФ среди других метаболитов, необходимых для выживания клеток. Следовательно, VDAC1 обеспечивает связь между митохондриями и клеткой, обеспечивая баланс между метаболизмом клеток их гибелью. Помимо метаболического проникновения, VDAC1 также действует как каркас для белков, таких как гексокиназа, которые в свою очередь могут регулировать метаболизм. VDAC1 может быть вовлечен в рак и болезнь Альцгеймера. Димеризация VDAC играет роль в митохондриальной метаболической регуляции и апоптозе в ответ на подкисление цитозолей во время клеточного стресса, и участвует. Ингибирование гиперэкспрессии VDAC1 и вставки плазматической мембраны в бета-клетки сохраняет секрецию инсулина при диабете. Семейство поринов пластид и митохондрий (The Mitochondrial and Plastid Porin (MPP) Family) Порины семейства MPP обнаружены в эукариотических органеллах (митохондрии многих эукариот, а также хлоропласты и пластиды растений). Лучше всего охарактеризованы представители семейства MPP - потенциал-зависимые порины анион-селективного канала (VDAC) в наружной мембране митохондрий. Эти порины имеют расчетный диаметр канала 2,5-3 нм. Было отмечено чрезмерное окисление цистеинов и сукцинилирование цистеинов в VDAC. VDACs играют роль в формировании переходной поры проницаемости митохондрий (PTP), что важно для гомеостаза Ca2 + и запрограммированной клеточной гибели. PTP запускается притоком Ca2 + в митохондрии, а VDAC проницаем для Ca2 +. Он также регулируется различными соединениями, такими как глутамат, НАДН и нуклеотиды. VDAC имеет два сайта связывания нуклеотидов. © Raldugina Vasilisa 2016 |
||||||||||||||||||||||||||||||||||||||||