Мини-обзор бактерии вида
Nitrosomonas eutropha C91
Аннотация
Нитрифицирующие бактерии играют большую роль в формирование экосистем, в связи с их участием в цикле азота. В данной работе будет анализироваться геном одного из представителей нитрифицирующих бактерий из рода Nitrosomonas. Обработав таблицу локальных особенностей генома, а также таблицу с геномом по каждому из репликонов, нами были получены новые сведения о некодирующих областях генома, нуклеотидном составе бактерии и выдвинуты предположения о областях ориджина и терминатора репликации.
Введение
Nitrosomonas eutropha C91 - это грамотрицательная автотрофная нитрифицирующая бета-протеобактерия, окисляющая аммиак(NH3) в аэробной среде до нитрита(NO2-). Обнаруживается в почве с высоким содержанием азота и на очистных сооружениях. По видимому данные бактерии предпочитают среду с высоким содержанием азота. Нитрификация проходит в две стадии. Первая - это окисление аммиака до гидроксиламина(NH2OH) под воздействием фермента монооксогеназы аммиака(AMO), который требует присутствия в среде кислорода и окислителя в лице убихинона. Вторая стадия протекает благодаря гидроксиламиномоноредуктазе(HAO), гидроксиламин превращается в нитрит, выделяя при этом электроны, половина из которых возвращается в AMO, а оставшаяся часть регенерирует NADH, необходимый для фиксации углерода [1]. Несмотря на автотрофность Nitrosomonas eutropha C91 некоторые исследования выявили ее способность к хемотрофии на селективных органических соединениях, что предположительно позволяет использование данный вид бактерии в биоремедиации [1]. Еще одним преимуществом данной бактерии является ее устойчивость к тяжелым металлам [2]. В связи с наличием у Nitrosomonas eutropha C91 практического применения, бактерия представляет интерес для дальнейшего изучения.
Классификация бактерии Nitrosomonas eutropha C91:
Домен: Bacteria
Отдел: Pseudomonadota
Класс: Betaproteobacteria
Порядок: Nitrosomonadales
Семейство: Nitrosomonadaceae
Род: Nitrosomonas
Вид: Nitrosomonas eutropha C91
Материалы и методы
В данном проекте использовались таблицы с геномом бактерии Nitrosomonas eutropha C91, взятые с сайта The National Center for Biotechnology Information(NCBI). Анализ данных проводился в таких программах как Bash, Google Sheets. Помимо этого применялся язык программирования Python, код был написан с помощью сайта google collaboratory. Для оценки параметра GC-skew использовался сайт GenSkew.
Результаты
Распределение закодированных в геноме белков в соответствии с их длинами:
На основании составленной нами гистограммы (рис. 1) мы можем заметить, что
подавляющее число белков состоит из 40-430 аминокислотных остатков, при
дальнейшем увеличении длины белка, наблюдается значительный спад их количества
Так, начиная с длины белка в 580 а. о. количество разнообразных последовательностей
в каждом кармане гистограммы не превышает 30. Белки с длиной более чем 1090
аминокислот были сгруппированы как выбросы, для облегчения анализа гистограммы.
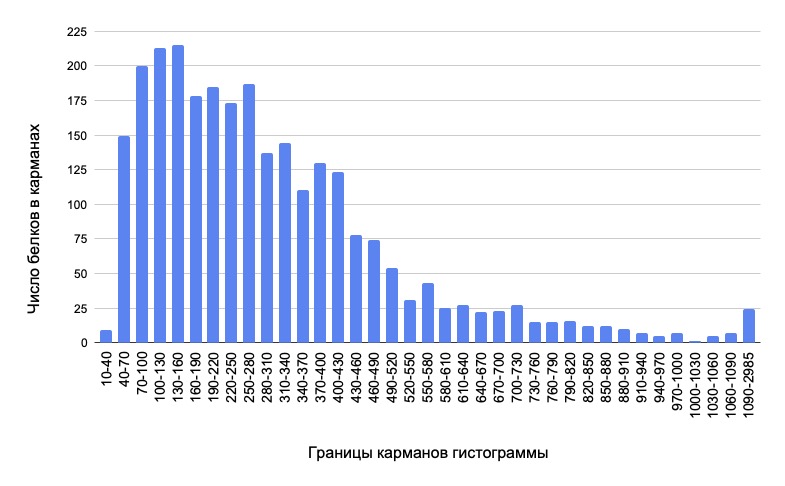 Рис. 1. Гистограмма, оценивающая количество бактериальных белков в зависимости от
размеров их аминокислотных последовательностей
Рис. 1. Гистограмма, оценивающая количество бактериальных белков в зависимости от
размеров их аминокислотных последовательностей
Распределение генов белков и различных типов РНК по репликонам:
Из представленной таблицы (см. таблица 1) видно, что в изученной нами бактерии
помимо хромосом содержатся два типа плазмид, каждая из которых несет около 60
белок кодирующих участков. Первая плазмида кодирует 59 CDS, а вторая 64, что составляет от общего числа белок кодирующих последовательностей примерно 2.2% и
2.4% соответственно.
Несмотря на небольшие размеры, плазмиды в организмах бактерий часто играют
большую роль, так, они несут гены помогающие выжить в среде, содержащей
различные токсичные вещества. Исследование [1] показало выживание бактерий в
условиях с содержанием ароматических соединений, а именно крезола, являющегося
токсичным для других живых существ. Возможно гены помогающие выжить в таких
условиях содержатся в плазмидах.
В свою очередь последовательности, кодирующие разнообразные типы РНК
содержатся только в хромосомах, что доказывает невозможность существования
плазмид в отдельности от клетки.
Таблица 1. Количество различных генов на разных репликонах.
| белок кодирующие последовательности | транспортная РНК | рибосомальная РНК | некодирующие РНК | Трнаспортно матричная РНК | |
|---|---|---|---|---|---|
| хромосома | 2570 | 41 | 3 | 3 | 1 |
| плазмида p1 | 59 | 0 | 0 | 0 | 0 |
| плазмида p2 | 64 | 0 | 0 | 0 | 0 |
Расстояние между белок кодирующими последовательностями на плюс-цепи
наибольшей хромосомы
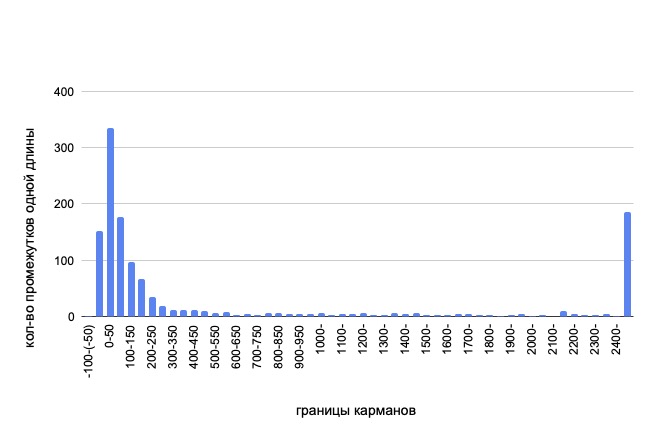
Рис. 2. Диаграмма, оценивающая количественное распределение нуклеотидов,
находящихся между двумя белок кодирующими цепями
Данная задача интересна для нас, так как геном, помимо кодирующих последовательностей, включает в себя большое количество регуляторных фрагментов, оказывающих влияние на жизнедеятельность клетки, синтез нерегуляторных РНК, процессы трансляции и транскрипции. Проанализировав приведенную нами гистограмму (рис. 2), можно с легкостью заметить, что подавляющая часть белок кодирующих последовательностей удалены друг от друга на расстоянии от 0 до 50 нуклеотидных пар. При увеличении количества нуклеотидов между CDS идет резкое снижение вероятности такого исхода. Уже при расстоянии от 100 до 150 нуклеотидов, количество таких случаев падает практически в два раза, а начиная с отметки в 450 нуклеотидов частота промежутков не превышает 10, однако стоит заметить, что несмотря на малое количество промежутков со схожей длиной, разнообразие промежутков с увеличением нуклеотидов тоже увеличивается Так, количество расстояний между белок кодирующими последовательностями свыше 450 нуклеотидов составляет 354 случая, что от общего количество (1268 промежутков) практически 30%. Максимально большое расстояние 41152 нуклеотида. Частично объяснить полученные данные можно опираясь на предыдущий пункт, где мы выявили наличие в составе хромосомы участков, кодирующих рибосомальные РНК, транспортные РНК и прочих.Большое количество и разнообразие исследуемых промежутков между CDS указывает на их значимую роль в геноме бактерии. Помимо сверхбольших промежутков, интерес вызывают участки, где перекрываются белок кодирующие фрагменты, в составе кольцевой хромосомы их также большое количество (335 штук) и наибольший из них равен перекрыванию в 53 нуклеотида. Перекрывание генов может говорить об участии их в одном процессе, когда важна совместная регуляции или о последовательном синтезе веществ, играющих роль в одном метаболическом процессе. Интересно также заметить, что некодирующие последовательности составляют в общем 55% от всей кольцевой хромосомы, что сильно меньше чем у эукариот, но больше многих других бактерий.
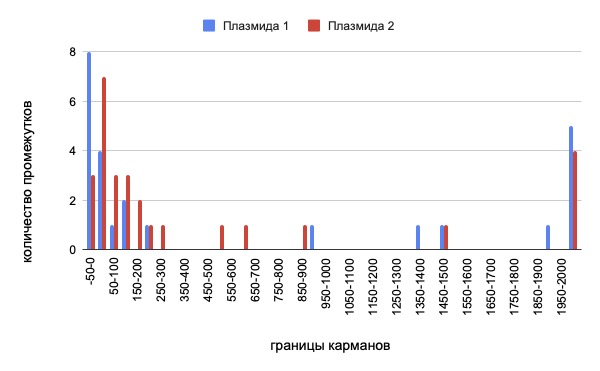
Рис. 3. Диаграмма, отражающая количество разнообразных промежутков, разделяющих белок кодирующие последовательности двух плазмид, в зависимости от количество нуклеотидов в их составе
Дополнительно нами были проанализированы и сравнены промежутки между белок кодирующими последовательностями у двух плазмид, входящих в состав Nitrosomonas eutropha C91 (см. рис. 3) Несмотря на небольшое количество промежутков в составе плазмид, общий вид диаграммы у них очень схож с таковым у хромосомы бактерии. Однако, можно заметить, что содержание перекрывающихся генов в плазмиде 1 сильно выше, чем в плазмиде 2 и в процентном соотношение к общему числу промежутков превышает таковое у основной кольцевой ДНК, это может говорить о большем участии плазмиды 1 в метаболических путях.
Оценка процентного содержания нуклеотидов по репликонам:
Проанализировав нуклеотидный состав бактерии(таблица 2) мы заметили, что
процентное содержание нуклеотидов с аденином и тимином выше, чем GC
нуклеотидов, а значит число двойных водородных связей тоже выше, что играет роль
при подборе праймера и температуре отжига. Процентное содержание пуринов в
среднем составляет 50.263% от общего количеств, что несколько противоречит правилу
Чаргаффа, но может быть объяснено наличием модифицированных оснований в
геноме.
Таблица 2. Распределение нуклеотидов на каждом из репликонов
| хромосома | плазмида p1 | плазмида p2 | |
|---|---|---|---|
| аденин | 25,77% | 25,33% | 25,57% |
| тимин | 25,75% | 24,87% | 24,75% |
| цитозин | 24,2% | 24,61% | 25,03% |
| гуанин | 24,28% | 25,19% | 24,65% |
| пурины | 50,05% | 50,52% | 50,22% |
Поиск участка ориджина и терминации:
Как уже было сказано выше, отличие GC пар от АT заключается в дополнительной
водородной связи между ними. Участки с наименьшим содержанием тройных
водородных связей, с большей долей вероятности являются участками начала
репликации, а участки с наибольшим содержанием этих пар - терминации.
Для данного задания был использован показатель GC-skew. Он заключается в оценке
соотношения гуанина и цитозина на определенном интервале.
GC-skew = (C - G)/(C + G)
После подсчета GC-skew на интервале берется интеграл функции и по найденным
значениям строится график, максимум которого соответствует точке
терминации,минимум точке начала репликации.
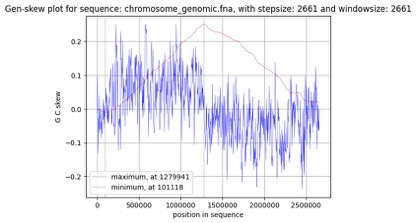
Рис. 4. График параметра GC-skew для хромосомы
Оценка нуклеотидного состава хромосомы (рис. 4) показала, что точке ориджина соответствует участок близ 101118 нуклеотида, а точке репликации около 1279941 нуклеотида. Дополнительно нами была проведена оценка для каждой из плазмид.
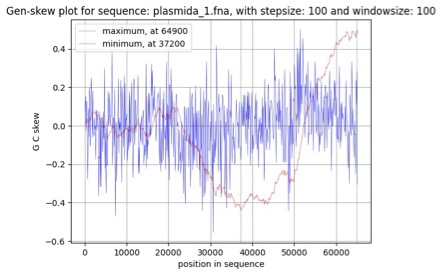
Рис. 5. График параметра GC-skew для плазмиды p1
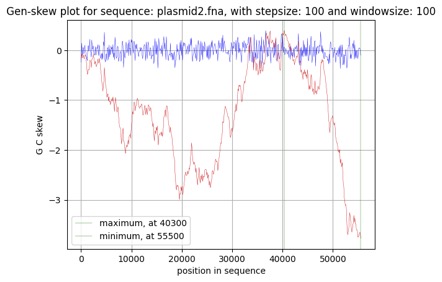
Рис. 6. График параметра GC-skew для плазмиды p2
Плазмида p1(рис. 5) хоть и имела менее выраженные пики на графике (возможно из-за меньшего нуклеотидного состава плазмиды), все же показала достаточно релевантные данные. Точка ориджина - это окрестность 37200 нуклеотида, а точка терминации - 64900 нуклеотида. Вывод о правдивость полученных данных мы сделали на основании знаниях о процессах протекания репликации. После начала репликации, ДНК-полимеразы движутся в две разные стороны от точки репликации и встречаются примерно на противоположном конце кольцевой ДНК, в точке терминации. Полученные нами данные совпадают с данной концепцией. Однако оценка GC-skew для плазмиды p2 (рис. 6) продемонстрировала другие результаты, согласно графику точка начала репликации и конца слишком близки, что маловероятно. Из этого можем сделать вывод, что данный метод оценки подходит не для всех геномов.
Заключение
В данном обзоре нами были получены новые данные о геноме бактерии Nitrosomonas eutropha C91, в частности установлен нуклеотидный состав генома, выявлены предположительные области ориджина и терминатора для репликонов, получены сведения о некодирующих областях генома и о размерах протеома. По мнению автора, бактерия интересна для дальнейшего изучения, в связи с недостатком данных о протеоме бактерии и участии плазмид бактерии в физиологических процессах.
Сопроводительные материалы
- Систематика бактерии с сайта NCBI
- Таблицы с геномом Nitrosomonas eutropha C91
- Ссылка на Google Sheets с анализом генома на предмет промежутков между белок кодирующими последовательностями (страница diagramma и distance_between_p1_p2)
- Ссылка на Google Sheets c гистограммой длин белков (страница prot_len_hist)
- Ссылка на программу Python вычисляющая количество нуклеотидов (код отдельный для каждого репликона)
- Ссылка на сайт для расчета GC-skew:
Список литературы
- Kjeldal H, Pell L, Pommerening-Röser A, Nielsen JL. Influence of p-cresol on the proteome of the autotrophic nitrifying bacterium Nitrosomonas eutropha C91. Arch Microbiol. 2014 Jul;196(7):497-511. doi: 10.1007/s00203-014-0985-z. Epub 2014 Apr 29. PMID: 24777776.
- Stein LY, Arp DJ, Berube PM, Chain PS, Hauser L, Jetten MS, Klotz MG, Larimer FW, Norton JM, Op den Camp HJ, Shin M, Wei X. Whole-genome analysis of the ammonia-oxidizing bacterium, Nitrosomonas eutropha C91: implications for niche adaptation. Environ Microbiol. 2007 Dec;9(12):2993-3007. doi: 10.1111/j.1462-2920.2007.01409.x. PMID: 17991028.