


 |
 |
 |
Из всех PDB структр, полученных методом ЯМР в 2014 году и имеющих более 1 модели, была выбрана структура 2MBZ, состоящая из 10 моделей, включающих в себя полипептид из 144 аминокислот и пептид из 12 остатков.Для дальшейшего рассмотрения возьмем только цепь А из 144 а.о.(Рис.1)
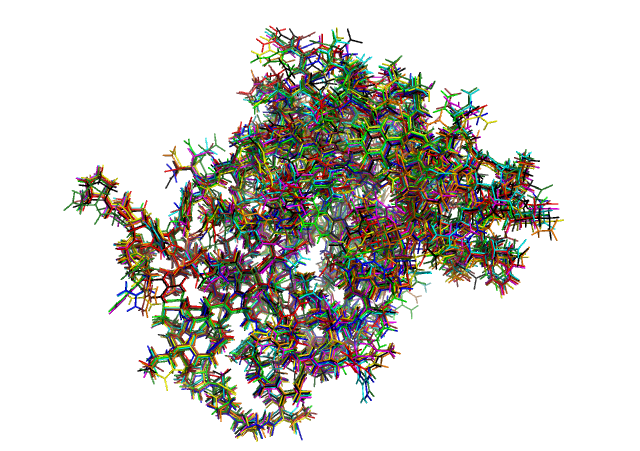
Рис.1: Изображений всех моделей цепи А структуры 2MBZ, каждая обозначена своим цветом.
В одной из моделей была найдена водородная связь 162 аргинина и 166 глутамата(Рис.2).
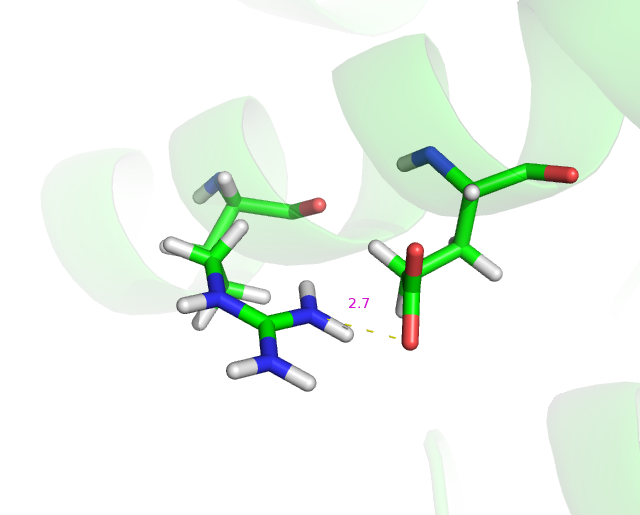
Рис.2: Взаимодействие NH1 атома 162 аргинина и OE2 атома 166 глутамата второй модели.
При рассмотрении третьей модели расположение глутамата почти не изменяется, однако аргинин разворачивается своей гуанидиновой группой почти на 90°.(Рис.3)
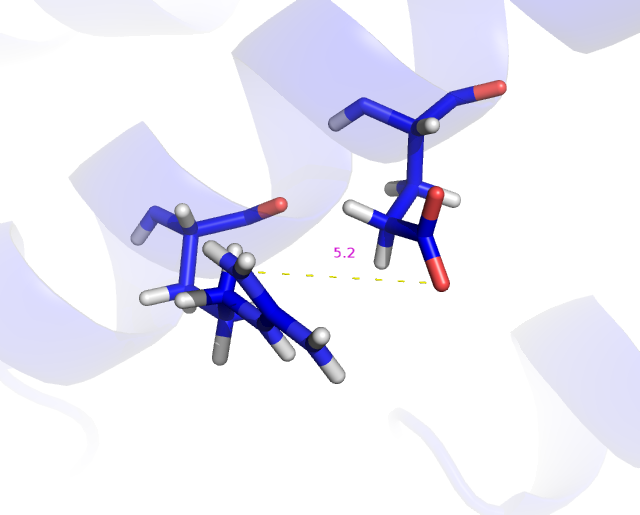
Рис.3: Визуализация расстояния между NH1 атомом 162 аргинина и OE2 атомом 166 глутамата 3 модели.
На 4 модели расположение уже сильно отличается от такого во второй модели, также расстояние между NH1 атомом аргинина и OE2 атомом глутамата нельзя считать пригодным для образования водородной связи.
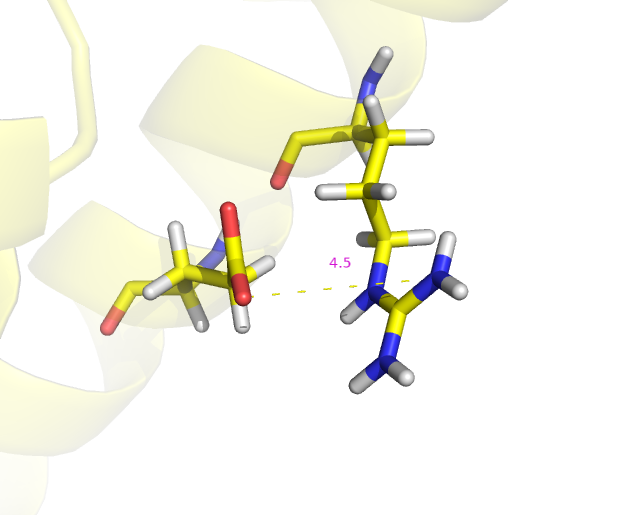
Рис.4: Визуализация расстояния между NH1 атомом 162 аргинина и OE2 атомом 166 глутамата 4 модели.
Структура L-треонин альдолазы E.сoli(3wlx), разрешенная 15 ноября 2013 года и имеющее разрешение 2.51 Å, состоит из двух асимметрических единиц (цепей A и B) и четырех биологических.(Рис.5)
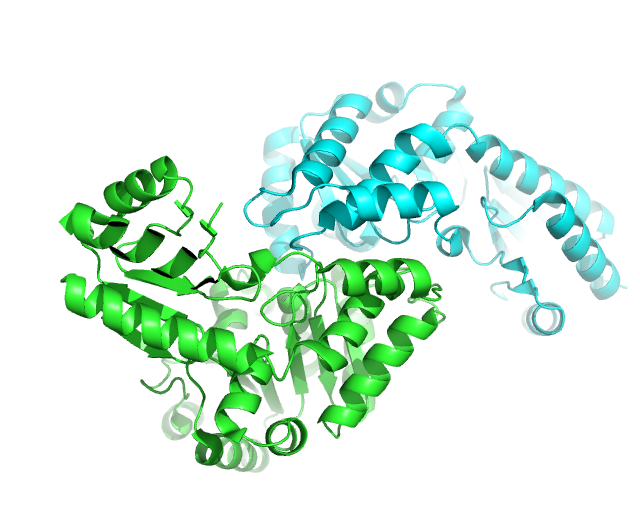
Рис.5: Структрура 3WXL, разные копии асимметрических изображены зеленым и циановым цветом.
Водородная связь возможна между остатками 202 пролина и 230 остатком глутамина разных цепей.(Рис.6-7)
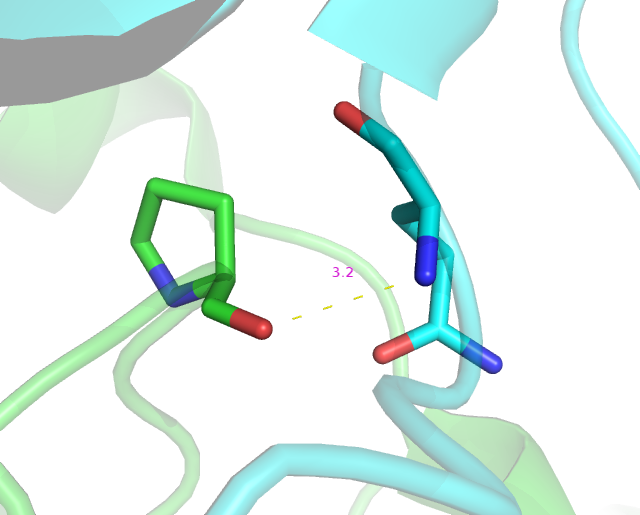
Рис.6: Взаимодействие 202 пролина цепи А(зеленым) и 230 глутамина цепи B(циановым).
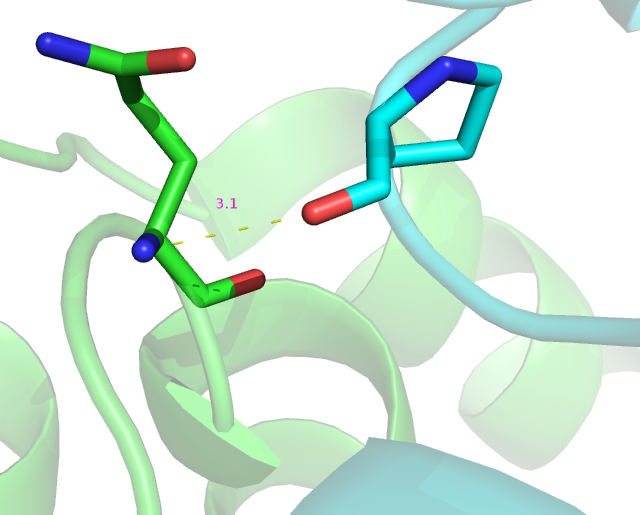
Рис.7: Взаимодействие 230 глутамина цепи А(зеленым) и 202 пролина цепи B(циановым).
© Butusova Anna,2014