


 |
 |
 |
Структура 7GPB содержит молекулу гликоген фосфорилазы, состоящий из четырех цепей. Структура была разрешена 15 октября 1992 года, последние исправления были внесены 13 июля 2011. Разрешени - 2.90 Å.
Особенностью данной структуры является положение в пространстве атомов остова индольного кольца триптофанов, а именно 67 триптофана. (Рис.1)
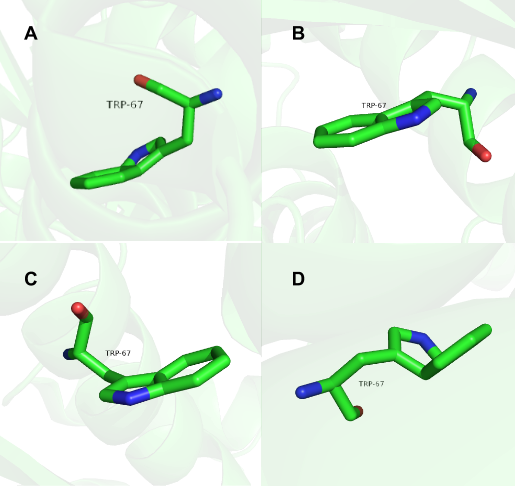
Рис.1: Визуализация 67 триптофана цепей А, B, C, D.
Как видно на Рис.1 боковая цепь триптофана представляет собой ароматическую систему двух колец, которая по правилу Хюккеля должна представлять одну плоскость, построенную на атомах углерода. Однако не во всех триптофанах это наблюдается, а именно индолы цепей A и D не вписываются в одну плоскость, к тому же аминокислотные остатки триптофана цепей C и B также не образуют одну плоскость (но отклонение от плоскости не настолько велико, как в цепх A и D). Если посмотреть на B-факторы данных аминокислотных остатков, то получится, что температурные факторы индола триптофана 67 цепи D(самое искаженное) варьируются от 31 до 53, когда у неискаженного тритофа 182 цепи А(Рис.2) они принимают значения от 18 до 28.
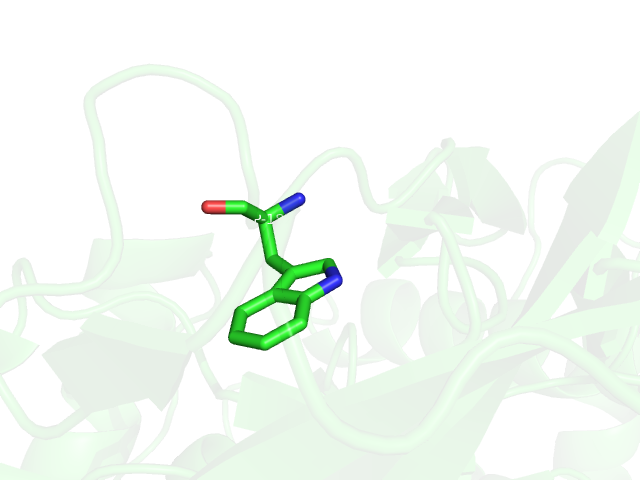
Рис.2: Визуализация 182 триптофана цепи А.
Структура 1gt0 предстявляет двуцепочечную молекулу ДНК и две цепи транксрипционных фактором POU и HMG. Впервые эта структура была аннонсирована 31 января 2003 года, последнее изменение было представлено 14 ноября 2012.
Разрешение структуры составлят 2.60 Å. Особенность данной структуры состоит в том, что в цепи С (POU) отсутствуют аминокислотные остатки с 78 по 96.(Рис.3)
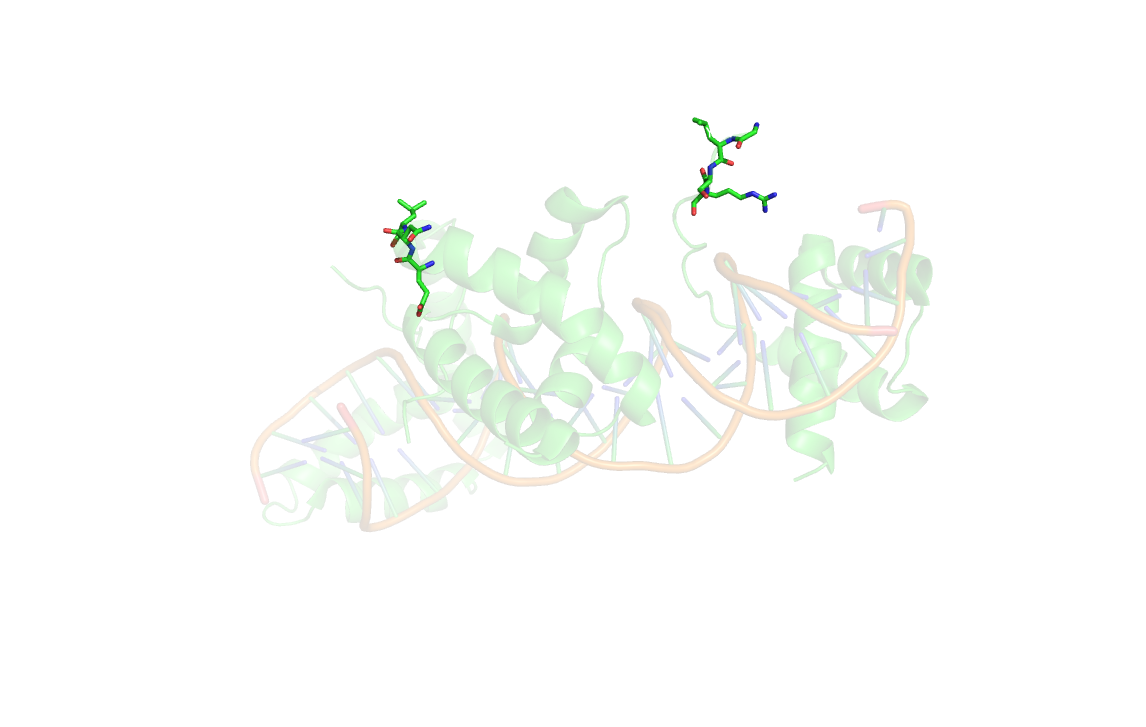
Рис.3: Структура 1gt0. Аминоклотные остатки с 75 по 100 подписаны и обозначены "sticks".
Также заметно, что при визуализации электронной плотности вокруг амиинокислотных остатков с 75 по 100, "пропавшие остатки" не имеют ЭП. Интересно заметить, что ЭП вокруг 100 аргинина не описывает "радикал" а.о. Это ставит под сомнение качество вписывания того остатка в полученные результаты.(Рис.4)
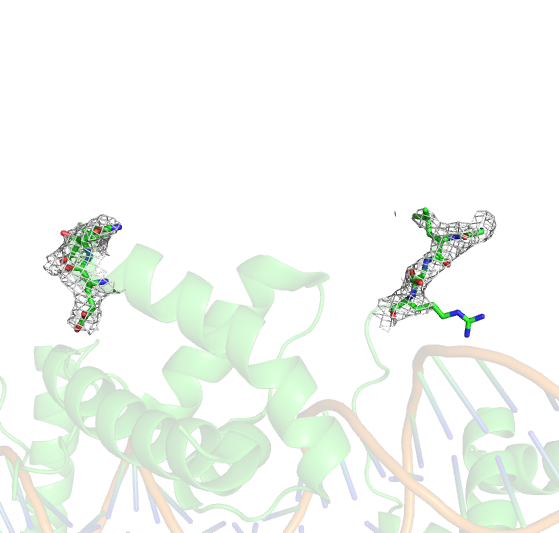
Рис.4: Визуализация электронной плотности вокруг 75-100 аминокислотных остатков с уровнем подрезки σ=1.
Если рассмотерть значения температурного фактора на "пропавшем" участке, то видно, что остатки с 73 по 75 и с 97 по 100 имеют высокие значения B-фактора. (Рис.5)Следовательно, можно предположить, что участок цепи с 78 по 96 отсутствует из-за высокой подвижности.
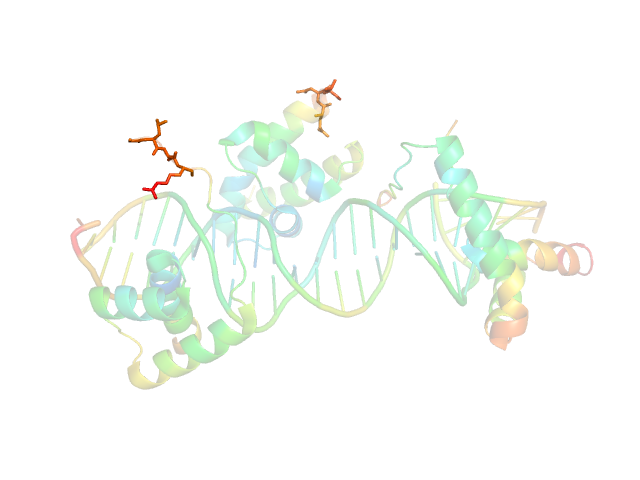
Рис.4: Визуализация значений B-фактора, остатки с 75 по 100 показаны sticks.
Структура 2B5A описывает контрольный элемент C.BCII системы рестрикции-модифиации. Данная структура была разрешена 28 сентября 2005 года, а последнее исправление датируется 13 июлем 2011 годом, разрешение же структуры составляет 1.54 Å
Особенность данной структуры заключается в том, что 21 глутамина цепи С имеет несколько конформаций. (Рис.6)
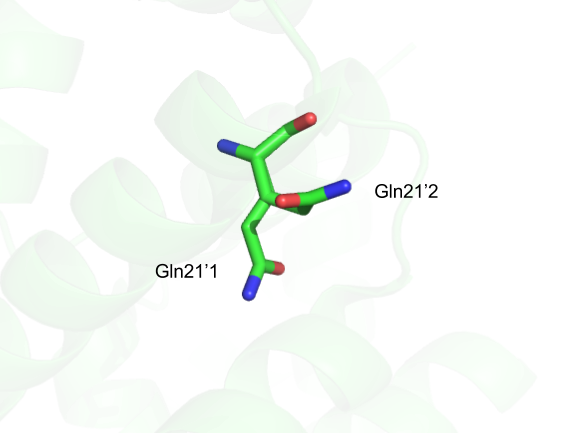
Рис.6: Визуализация двух конформаций 21 глутамина цепи С.
При изображении электронной плотности вокруг 21 глутамина видно, что действительно вокруг одного из остатков есть скопление плотности, а у другого ЭП описывает только амидную группу глутамина, но не γ-С.(Рис.7)
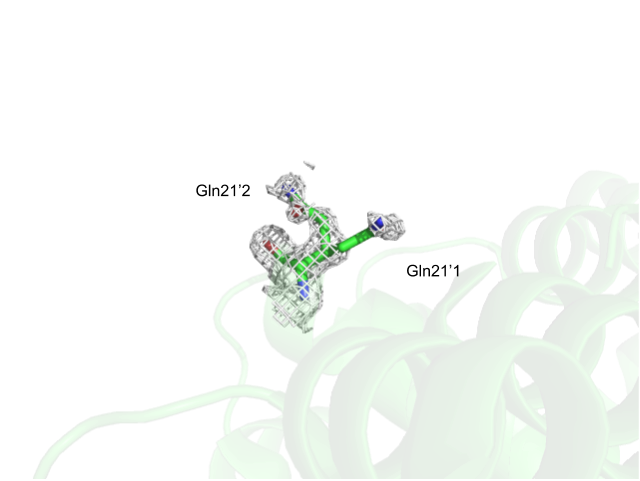
Рис.7: Визуализация электронной плотности двух конформаций 21 глутамина цепи С с уровнем подрезки σ=1.
В PDB-файле для атомов, принадлежащих разным корформациям, приведены значения occupancy равное 0.5.
ATOM 1405 CA AGLN C 21 19.364 32.425 32.992 0.50 19.11 C ATOM 1406 CA BGLN C 21 19.326 32.397 33.057 0.50 20.53 C ATOM 1409 CB AGLN C 21 17.931 32.039 33.379 0.50 20.64 C ATOM 1410 CB BGLN C 21 17.973 31.950 33.643 0.50 22.06 C ATOM 1411 CG AGLN C 21 17.034 33.216 33.781 0.50 20.74 C ATOM 1412 CG BGLN C 21 16.993 31.438 32.609 0.50 23.71 C ATOM 1413 CD AGLN C 21 17.055 34.359 32.789 0.50 24.73 C ATOM 1414 CD BGLN C 21 15.641 31.013 33.167 0.50 26.46 C ATOM 1415 OE1AGLN C 21 17.097 34.149 31.567 0.50 20.63 O ATOM 1416 OE1BGLN C 21 15.470 30.787 34.370 0.50 32.44 O ATOM 1417 NE2AGLN C 21 17.048 35.589 33.309 0.50 17.33 N ATOM 1418 NE2BGLN C 21 14.666 30.890 32.270 0.50 27.89 NCледовательно, в половине ячеек присутствует одна конформация, а в другой половине - другая. Возможно поэтому авторы структуры решили положить в файл оба варианты 21 глутамина.
Используя Advanced search на сайте PDB, были найдены две структуры с разрешением до 1 Å и от 2Å до 2.5Å, полученные метором РСА, а также со сходной длиной полипептидной цепи. Результатом поиска являются модели 4LBS с разрешением 0.76 Å и длиной цепи 316 ак.о., 4TYG - 2.40 Å и 311 ак.о.. Для более точного стравнения были выбраны структуры белков, не сильно отличающихся по длине цепи.
Для характеристики температурных факторов эти данные были извченены из pdb-файлов и построена гистограмма.(Рис.8)
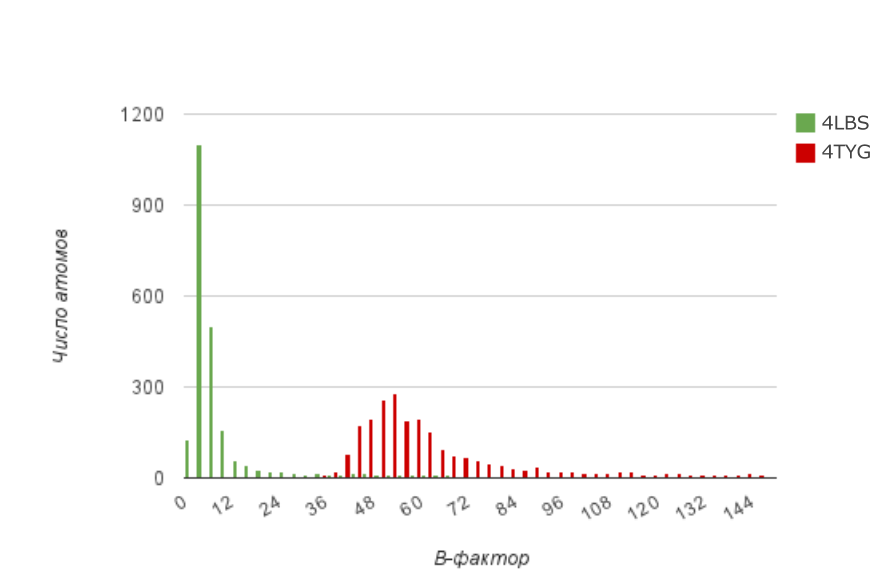
Рис.8: Распределение B-факторов у структуры 4LBS с высоким разрешением(зеленый) и 4TYG с низким разрешением(красный).
По этим результатам можно сделать вывод, что B-факторы у более точной структуры меньше, чем у структуры с низким разрешением. Это логично, так как температурный фактор отражает, насколько сильно восстановленная электронная плотность размазана вокруг атома. То есть, чем выше разрешение, тем лучше различаются детали и лечге вписывать атомы в ЭП.
Коэффииенты заполнения также у двух структур с разным разрешением отличаются (Рис.9), а именно:
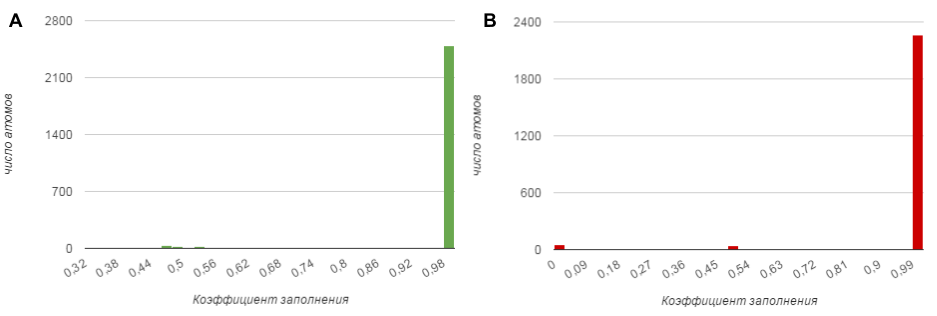
Рис.9: Гистограмма распределения коэффициентов у структуры с высоким(A) и низким(B) разрешением.
© Butusova Anna,2014