Анализ ГТФ-3′,8-циклазы бактерии Octadecabacter antarcticus 307
Выбор белка и общая информация
Поиск аннотированных белков бактерии Octadecabacter antarcticus 307 осуществлялся при помощи запроса organism_id:391626 (Organism: Octadecabacter anatarcticus 307). Стоит отметить, что все белки в базе данных UniProtKB для данной бактерии аннотированы автоматически и не были проверены вручную.
Для дальнейшей работы был выбран относительно хорошо аннотированный белок (Annotation score: 3, для Octadecabacter antarcticus 307 отсутствуют белки с Annotation score больше 4) с ID M9R2Y3_9RHOB - ГТФ-3′,8-циклаза, фермент, осуществляющий катализ образования дополнительного цикла в молекуле гуанозинтрифосфата по SAM-радикальному механизму (Рис. 1). Данная реакция является частью пути биосинтеза молибдоптерина (Рис. 2).
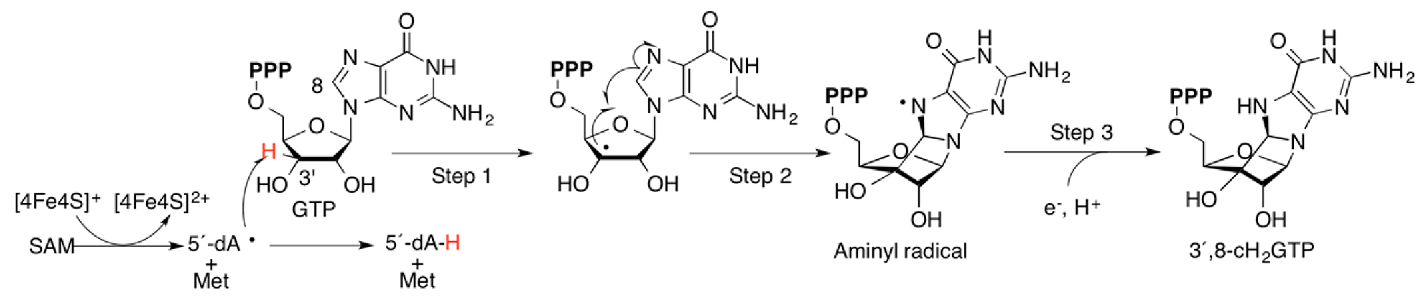
Последовательность данного белка состоит из 334 аминокислотных остатков, а молекулярная масса составлет примерно 38 кДа. Фермент содержит 2 железо-серных кластера (4Fe-4S) в качестве кофактора, а также имеет сайты связывания S-аденозилметионина (SAM) и ГТФ.
Кластеры похожих белков
Для анализируемого белка кластер UniRef100 содержал только последовательность данного фермента, UniRef90 - 3 белковые последовательности, UniRef50 - 3327 последовательностей.
Можно предположить, что размеры кластеров могут быть использованы для оценки распространенности и консервативности белка: размеры кластеров положительно коррелируют с распространенностью, а отношения размеров UniRef100 к UniRef90, UniRef100 к UniRef50 и UniRef90 к UniRef50 - с консервативностью белка.
Для проверки этого предположения можно проанализировать кластеры похожих последовательностей для консервативных белковых продуктов генов домашнего хозяйства рассматриваемой бактерии (Табл. 1).
| Белок | ID | UniRef100 | UniRef90 | UniRef50 |
|---|---|---|---|---|
| ГТФ-3′,8-циклаза | M9R2Y3_9RHOB | 1 | 3 | 3 327 |
| Репликативная ДНК-хеликаза | M9R551_9RHOB | 1 | 12 | 1 598 |
| ДНК-топоизомераза 1 | M9R9F8_9RHOB | 1 | 2 | 1 159 |
| Праймаза | M9R3E6_9RHOB | 1 | 6 | 1 953 |
| ДНК-лигаза | M9R5X0_9RHOB | 1 | 1 | 1 692 |
Как можно видеть из таблицы, очевидной корреляции между отношениями размеров кластеров и консервативностью белка, а также между размерами кластеров и распространенностью белка не наблюдается. Так количество записей в кластерах для ГТФ-3′,8-циклазы в 2 раза превышает таковое для генов домашнего хозяйства, а отношения между размерами кластеров для генов домашнего хозяйства явно не отличаются от таковых для анализируемого белка. Это объяснимо, поскольку большая часть записей в UniProtKB созданы и аннотированы автоматически и не проверены людьми.
Таким образом, несмотря на то, что распространенность и консервативность белка влияет на размеры кластеров похожих последовательностей, сами по себе размеры кластеров являются плохими маркерами для оценки обсуждаемых показателей.
Поиск связанных белков
1. Поиск ферментов различных классов, использующих S-аденозилметионин (SAM) при катализе, в роде Octadecabacter. Для поиска использовались следующие запросы: (keyword:KW-0949) AND (ec:N) AND (taxonomy_id:53945), где N - номер класса фермента.
Среди оксидоредуктаз (EC: 1) было обнаружено 13 записей, соответствующих запросу. В них описываются белки, участвующие в анаболизме тетрапирролов, например, копропорфириноген-III-оксидаза (S-аденозилметионин в данном случае выступает как один из субстратов реакции).
В базе данных UniProtKB были найдены 254 записи, соответствующие трансферазам (EC: 2). Большая часть записей включает описание ферментов-метилтрансфераз, что ожидаемо, поскольку SAM - один из самых распространенных переносчиков метильных групп. Однако среди результатов имелись и такие ферменты, как биотинсинтаза и липоилсинтаза, осуществляющие катализ по SAM-радикальному механизму [2, 3].
Гидролазы (EC: 3), соответствующие запросу, обнаружены не были. Однако для других бактерий были обнаружены ферменты, содержащие SAM в роли кофактора (запрос: (cc_cofactor_chebi:"CHEBI:15414") AND (ec:3)), к примеру, эндонуклеазы рестрикции типа III.
Для лиаз (EC: 4), были найдены 12 записей, 6 из которых соответствовали ГТФ-3′,8-циклазе различных видов рода Octadecabacter.
Изомеразы (EC: 5) и лигазы (EC: 6), удовлетворяющие условиям запроса, отсутствовали.
2. Поиск ферментов Octadecabacter antarcticus 307, содержащих молибдоптерин в качестве кофактора. Поисковый запрос выглядел следующим образом: (organism_id:391626) AND (cc_cofactor_chebi:"CHEBI:25372") AND (taxonomy_id:53945).
Данному запросу соответствуют 2 записи в UniProtKB: каталитическая субъединица метионинсульфоксидредуктазы, восстанавливающая окисленные остатки метионина мембранных белков за счет электронов из пула хинонов дыхательной цепи, и нитратредуктаза.
3. Поиск других ферментов Octadecabacter antarcticus 307, участвующих в биосинтезе молибдоптерина. Поисковый запрос выглядел следующим образом: (organism_id:391626) AND (cc_pathway:"molybdopterin biosynthesis").
Помимо ГТФ-3′,8-циклазы (moaA2) по данному запросу были найдены 4 записи: синтаза циклического пираноптерина (moaC); каталитическая субъединица молибдоптеринсинтазы (moaE); белок, участвующий в биосинтезе молибдоптерина, B (moaB) и молибдоптерин-молибдентрансфераза (moeA). Однако, в пути биосинтеза молибдопетрина участвуют также ферменты, кодируемые генами moaD, moeB и mogA (Рис. 2).
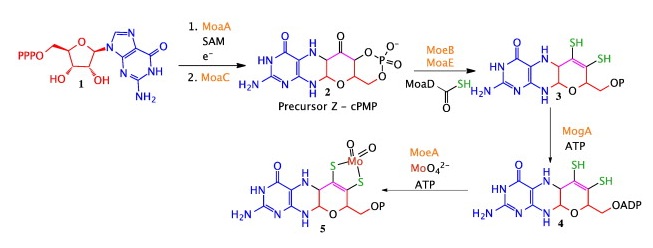
Гены moaD и moeB были найдены отдельными поисковыми запросами: (organism_id:391626) AND (gene:moaD) для moaD и (organism_id:391626) AND (gene:moeB) для moeB. Однако эти белки плохо аннотированы (Annotation score: 1) и для них не указаны метаболические пути, в которых они принимают участие. Ген mogA найден не был.
Поиск источника аннотации
Поиск значений кодов ECO осуществлялся при помощи сервиса EMBL-EBI Ontology Lookup Service
В качестве функции рассматриваемого белка указан катализ циклизации ГТФ в (8S)-3′,8-цикло-7,8-дигидрогуанозин 5′-трифосфат, код ECO:0000256. Данный код указывает на то, что в качестве доказательства автоматически созданого утверждения используется совпадение с модельной последовательностью (match to sequence model evidence used in automatic assertion). Далее указан код "правила" (HAMAP-Rule), в соответствии с которым алгоритм HAMAP определил функцию анализируемого фермента. Так в HAMAP rule MF_01225 имеются 4 шаблонные проверенные вручную последовательности ГТФ-3′,8-циклаз других бактерий.
Ген кодирующий ГТФ-3′,8-циклазу имеет название moaA2, для этой информации указан код ECO:0000313, который является маркером того, что данные, использованные для автоматического утверждения, были импортированы из внешнего источника (imported information used in automatic assertion). Далее дана ссылка на запись в базе данных EMBL-EBI.
Для рассматриваемого белка в таблице геномных особенностей указано наличие домена, принимающего участие в реализации SAM-радикального механизма. В данном случае указан код ECO:000259, что говорит о том, что как доказательство в автоматически созданном утверждении было использовано соответствие белка предсказательной модели в базе данных InterPro. Далее дана ссылка на профиль данного домена в базе данных PROSITE.
ЛИТЕРАТУРА И ИСТОЧНИКИ
Hover, Bradley M. and Ken Yokoyama. “C-Terminal glycine-gated radical initiation by GTP 3',8-cyclase in the molybdenum cofactor biosynthesis.” Journal of the American Chemical Society 137 9 (2015): 3352-9.
Lin, Steven & Cronan, John. (2011). Closing in on complete pathways of biotin biosynthesis. Molecular bioSystems. 7. 1811-21. 10.1039/c1mb05022b.
Neti, Syam & Sil, Debangsu & Warui, Douglas & Esakova, Olga & Solinski, Amy & Serrano, Dante & Krebs, Carsten & Booker, Squire. (2022). Characterization of LipS1 and LipS2 from Thermococcus kodakarensis : Proteins Annotated as Biotin Synthases, which Together Catalyze Formation of the Lipoyl Cofactor. ACS Bio & Med Chem Au. 2. 10.1021/acsbiomedchemau.2c00018.
Angad P. Mehta, Sameh H. Abdelwahed, Tadhg P. Begley, Molybdopterin biosynthesis—Mechanistic studies on a novel MoaA catalyzed insertion of a purine carbon into the ribose of GTP, Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, Volume 1854, Issue 9, 2015, Pages 1073-1077, ISSN 1570-9639, https://doi.org/10.1016/j.bbapap.2015.04.008.