 8 (926) 907 94 08
8 (926) 907 94 08
Всё на свете является чудом!
Особенности мембранных белков
Используя базу данных OPM, заполнили таблицу для трёх трансмембранных альфа-спиральных белков и трёх трансмембранных бета-баррелей (помимо требуемых параметров, добавили колонку со структурами белков, таким образом, подтвердив, что они известны):
| PDB код | Тип | Тип мембраны и организм | Толщина гидрофобной части мембраны в ангстремах (Å) | Медиана числа остатков в одном трансмембранном участке | Структура |
| 1h2s | спираль | мембрана архей; Natronomonas pharaonis | 30.5 ± 1.1 | 20 |
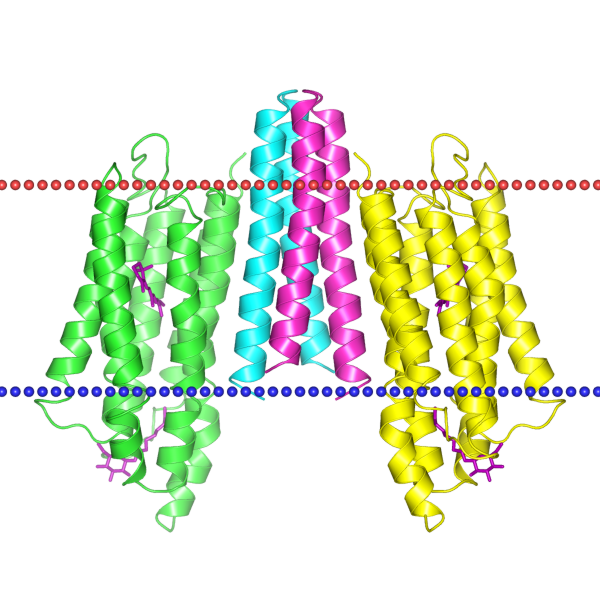 |
| 1ots | спираль | внутренняя мембрана грамотрицательных бактерий; Escherichia coli | 29.7 ± 0.8 | 18 |
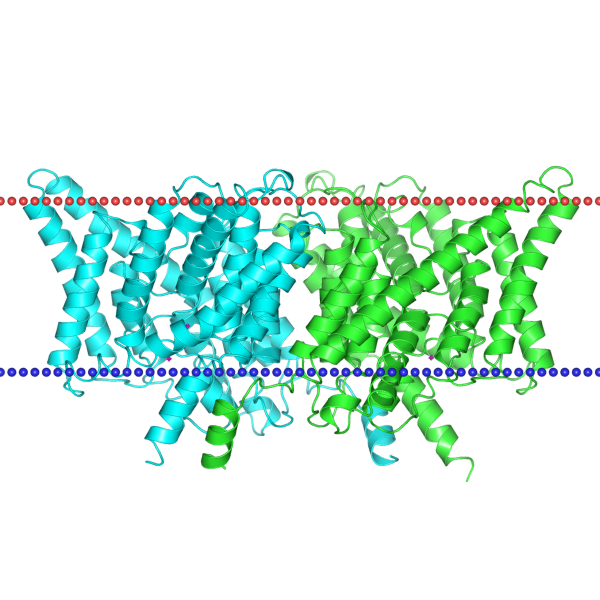
|
| 3qnq | спираль | внутренняя мембрана грамоположительных бактерий; Bacillus cereus | 29.6 ± 1.0 | 20 |
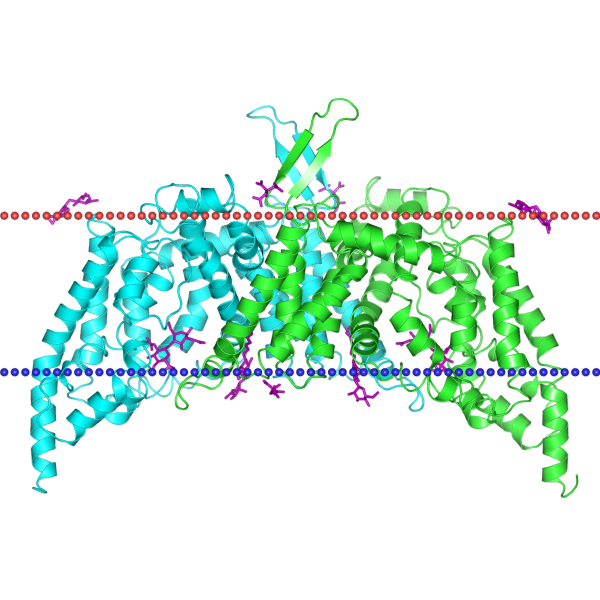
|
| 2qom | баррель | внешняя мембрана грамотрицательных бактерий; Escherichia coli | 25.1 ± 1.6 | 10 |
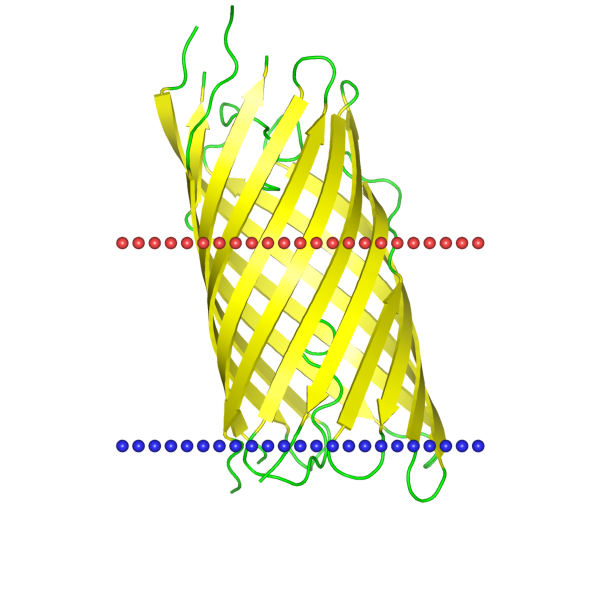
|
| 1pho | баррель | внешняя мембрана грамотрицательных бактерий; Escherichia coli | 24.1 ± 1.2 | 9 |
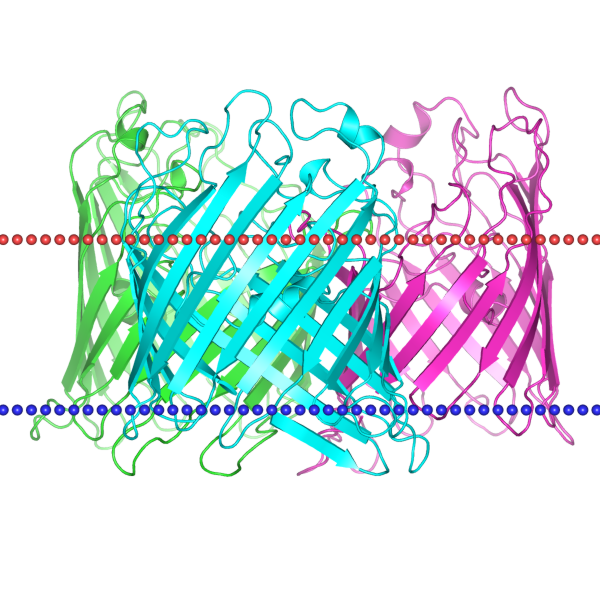
|
| 1uun | баррель | внешняя мембрана грамположительных бактерий; Mycobacterium smegmatis | 40.7 ± 2.1 | 9 |
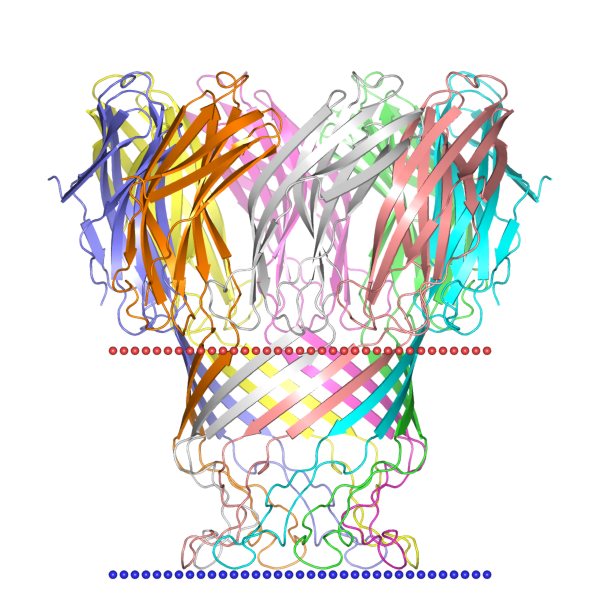
|
Интересно, что среднее число остатков в произвольных трансмембранных участках у альфа-спиральных белков вдвое больше, чем у бета-баррелей.
1. Отбор гомологов
Используя PSI-BLAST, произвели отбор гомологов заданного белка 3EAM (цепь А). Так как заданный белок из прокариотического организма (Gloeobacter violaceus), исключаем соответствующий филум (Cyanobacteria), найденный в Taxomomy Browser на NCBI. Определили порог на e-value ~ 1e-5, максимальное количество находок 1000. После четырёх итераций выбрали 12 гомологов из разных крупных таксономических групп, и затем отредактировали названия последовательностей-гомологов, оставив названия организмов и идентификаторы белков, а также добавив заданный белок 3EAM.
2. Анализ структуры выданного белка
Используя базы данных OPM и TCDB, заполнили таблицу с информацией о выданном белке 3EAM.
| PDB ID | Организм | Тип мембраны | TC-код | Наклон спиралей к нормали | Количество трансмембранных спиралей | Название белка |
| 3EAM | Gloeobacter violaceus | Внутренняя мембрана | 1.A.9.8.1 |
3 ± 0° Отдельно для четырёх субъединиц: 4°, 12°, 6°, 19°. |
22 (4 субъединицы) | Протон-ионный канал |
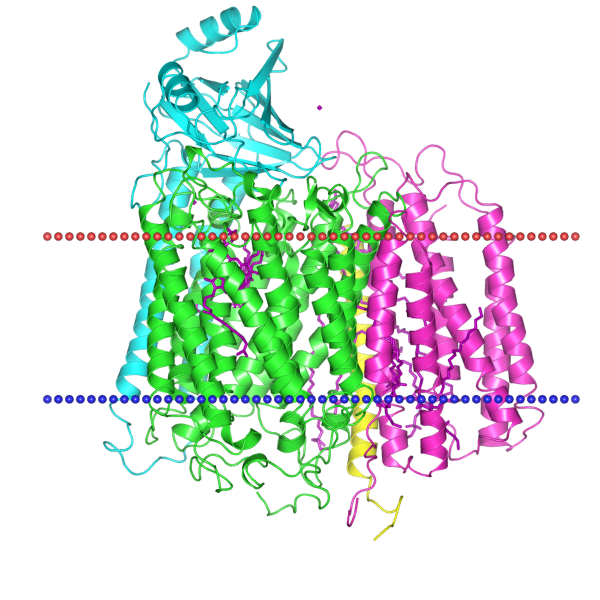
← структура
Описание каждого из полей TC-кода для белка 3EAM:
1.* – первичные активные транспортёры.
1.A.* – транспортёры, осуществляющие свою работу за счёт окислительно-восстановительных реакций.
1.A.9.* – Суперсемейство транспортирующих протоны цитохромовых оксидаз (COX).
1.A.9.8.1 – 4 компонента системы цитохром c-оксидазы (субъединицы I – IV, в том числе субъединица I – белок P33517).
3. Анализ множественного выравнивания трансмембранных белков
Было построено множественное выравнивание отобранных гомологов при помощи программы muscle. После чего результат загрузили в программу JalView. К выравниванию были добавлены аннотации TM_REAL и TM_PREDICTED. TM_REAL содержит указания на участки выравнивания отвечающие трансмембранным спиралям в белке со структурой 3EAM:A. TM_PREDICTED обозначает предсказанные с помощью TMHMM участки трансмембранных спиралей в гомологе COX1_HUMAN. После применения цветовой схемы, позволяющей визуально различать гидрофобные и гидрофильные остатки (Hydrophobicity: гидрофобные остатки выделены красным цветом), вместе с зависимостью интенсивности цвета от консервативности позиции (By Conservation, было использовано значение 20% в качестве порога) было получено следующее изображение:
Часть белка, ориентированная в n-сторону мембраны, расположена вверху. Участки, относящиеся к трансмембранным спиралям, консервативны (хотя встречаются небольшие фрагменты участков неконсервативных остатков), при этом наиболее часто в спиралях встречаются остатки лейцина, изолейцина, валина, аланина, фениалаланина, метионина, глицина и пролина (как видно, трансмембранные участки действительно состоят в основном из гидрофобных остатков). Среди участков между спиралями встречаются как консервативные участки, так и неконсервативные (относительно порога в 20% для цветового отображения консервативности).
Стоит отметить, что в трансмембранных спиралях также нередко встречаются остатки серина, аспарагина, тирозина (полярны), и даже гистидина (полярен и положительно заряжен) и глутаминовой кислоты (полярен и заряжен отрицательно). Эти остатки как правило консервативны (в особенности консервативны остатки гистидина), поэтому закономерно предположить, что их наличие связано с функциональной ролью белка.

Если сравнивать результаты программы TMHMM и реальную структурную информацию по совпадению на выравнивании, то можно отметить, что все трансмембранные спирали были предсказаны.
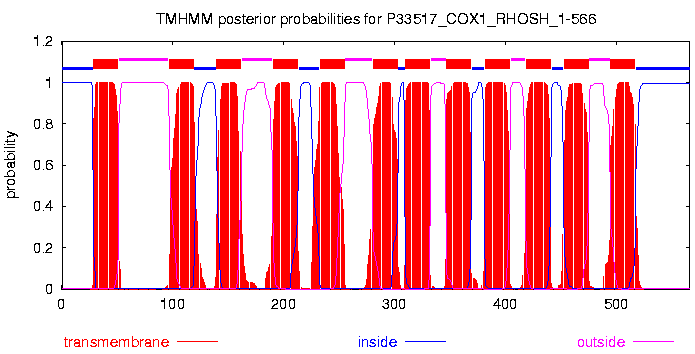
Присутствуют участки полного совпадения предсказаний и структурной информации, в большинстве же случаев трансмембранные участки смещены относительно друг друга в среднем на 3 позиции. Согласно создателям программы, TMHMM способна корректно предсказать 97-98% трансмембранных спиралей (источник). В данном случае программа показала неплохой результат, верно предсказав 92% трансмембранных участков.
4. Клетка размером с дыню
Проведём мысленный эксперимент: увеличим клетку до размера дыни. Если рассматривать клетку Escherichia coli, то линейные размеры её составляют примерно 0,5 μm × 2 μm (микрометров) (источник), а толщину мембраны можно считать равной 30 А (источник). Используя для расчёта «длину» клетки и размер дыни, равный 25см (источник) мы можем сделать заключение о том, что линейные размеры клетки при её увеличении до размера дыни следует увеличить в 1,25×105 раз. Тогда мембрана будет иметь толщину 0,0375 сантиметров (375 мкм). Для сравнения, толщина листа бумаги A4 примерно равна 105 мкм (источник). Таким образом, мембрану клетки, имеющей размеры дыни, можно сравнить со стопкой из 4 листов офисной бумаги.
5. Правило positive inside
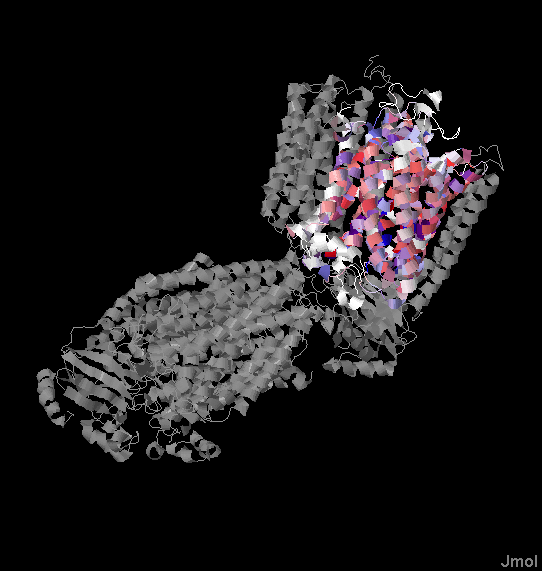
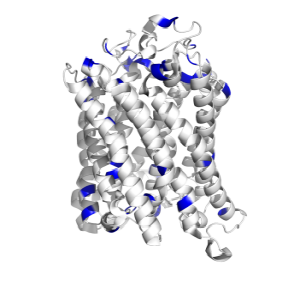
Для белка 3EAM (цепь A) можно выяснить, выполняется ли правило positive inside для трансмембранных белков, состоящее в том, что часть белка, расположенная с n-стороны от мембраны, содержит больше положительно заряженных остатков. Если рассмотреть остатки лизина, аргинина и гистидина в трансмембранных участках данного белка (это условие можно усилить консервативностью в гомологах) и определить с какой стороны мембраны число положительно заряженных остатков больше, то можно наблюдать чёткое следование расположения остатков этому правилу, что демонстрирует его универсальность в применении к трансмембранным белкам.
Для визуальной демонстрации удобнее всего воспользоваться трёхмерной структурной белка. На изображениях ниже приведена структура цепи A белка 3EAM. Синий и красный слои на первом изображении обозначают n- и p-стороны мембраны соответственно. На втором изображении в структуре белка, расположенного аналогичным образом (n-стороне соответствует верх изображения), синим цветом выделены остатки лизина, аргинина и гистидина. Видно, что с n-стороны мембраны положительно заряженных остатков больше, чем с p-стороны.

6. Предсказание бета-баррели по последовательности
В качестве трансмембранной баррели с известной 3D структурой был использован белок VDAC-1 канала 2JK4, который расположен во внешней мембране митохондрий человека. В качестве гомолога был использован найденный белок B3MJX1_DROAN из Drosophila ananassae. В качестве сервисом для предсказания были использованы BOCTOPUS и PRED-TMBB. В целом с предсказанием лучше справился первый сервис, предсказание второго не содержит некоторых трансмембранных участков. Один из участков был пропущен двумя использованными сервисами для предсказания.

7. Гидрофобность остатков бета-баррели, обращённых в мембрану
С помощью сервиса SheeP можно определить, какие остатки белка 2JK4 "смотрят" наружу от бета-листа. На составленной карте, приведённой на изображении ниже (при клике на картинку - оригинальный размер), красным выделены остатки, боковые цепи которых "смотрят" наружу баррели, жёлтым – внутрь.
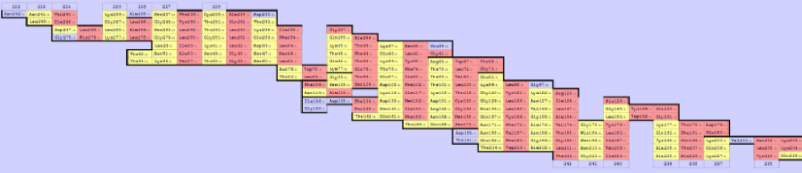
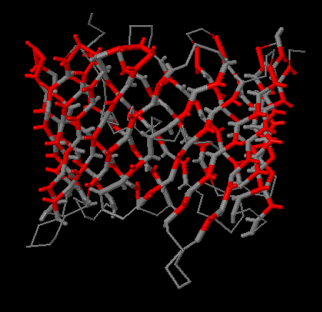
Изображение 3D структуры, на котором смотрящие наружу
боковые цепи указаны красным цветом, приведено слева.
Как видно, большинство (74%) обращённых наружу остатков гидрофобны.
Однако встречаются и полярные (гистидин, глутамин, аргинин, лизин,
глутаминовая кислота, аспарагин, серин). Как правило, они расположены
ближе к одной из сторон мембраны, входя в состав "перегибов" бета-листов.
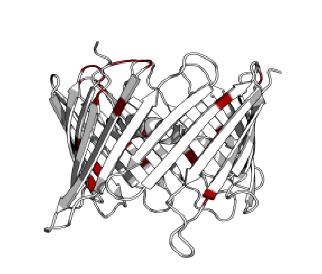
На изображении слева такие остатки (полярные остатки, обращённые наружу
по результатам анализа структуры с помощью сервиса SheeP) обозначены
рубиновым цветом.
| Главная | Об авторе | Учебные семестры | Проекты автора | Друзья | Ссылки партнеров | Extra | Контакты |
Mneff © 2011-2013