8 (926) 907 94 08
8 (926) 907 94 08
Всё на свете является чудом!
Поисковая система Pubmed
1. Регистрация на сайте NCBI
- заходим на сайт PubMed и проходим по ссылке "Sign In"
- выбираем ссылку "Register for an account" и затем регистрируемся, заполняя необходимые поля
2. Составление запросов и сохранение подходящих статей в коллекции
- при помощи поисковой системы PubMed ищем интересующую нас информацию
- чтобы найти подходящие и полезные нам статьи пришлось составлять различные поисковые запросы
Для наглядности результаты представлены в виде таблицы:
|
Запрос |
Запрос в Query
Translation |
Запрос в Translation |
All – (число
найденных публикаций) |
Free
Full
Text
- (число открытых
публикаций) |
Reviews – (число
найденных обзоров) |
|
(N6) AND (acetyllysine) |
N6[All Fields] AND
(acetyl[All Fields] AND
("lysine"[MeSH Terms] OR
"lysine"[All Fields])) |
lysine
"lysine"[MeSH Terms] OR
"lysine"[All Fields] |
37 |
12 |
1 |
|
(N6) AND (acetyllysine)
AND (histone) |
N6[All Fields] AND
(acetyl[All Fields] AND
("lysine"[MeSH Terms] OR
"lysine"[All Fields]))
AND ("histones"[MeSH
Terms] OR "histones"[All
Fields] OR "histone"[All
Fields]) |
lysine
"lysine"[MeSH Terms] OR
"lysine"[All Fields]
histone
"histones"[MeSH Terms]
OR "histones"[All
Fields] OR "histone"[All
Fields] |
1 |
- |
- |
|
(N6) AND (acetyllysine)
AND (human) |
N6[All Fields] AND
(acetyl[All Fields] AND
("lysine"[MeSH Terms] OR
"lysine"[All Fields]))
AND ("humans"[MeSH
Terms] OR "humans"[All
Fields] OR "human"[All
Fields]) |
lysine
"lysine"[MeSH Terms] OR
"lysine"[All Fields]
human
"humans"[MeSH Terms] OR
"humans"[All Fields] OR
"human"[All Fields] |
8 |
2 |
1 |
|
(N6)AND(acetyllysine)AND((histone)OR(human)) |
N6[All Fields] AND
(acetyl[All Fields] AND
("lysine"[MeSH Terms] OR
"lysine"[All Fields]))
AND (("histones"[MeSH
Terms] OR "histones"[All
Fields] OR "histone"[All
Fields]) OR ("humans"[MeSH
Terms] OR "humans"[All
Fields] OR "human"[All
Fields])) |
lysine
"lysine"[MeSH Terms] OR
"lysine"[All Fields]
histone
"histones"[MeSH Terms]
OR "histones"[All
Fields] OR "histone"[All
Fields]
human
"humans"[MeSH Terms] OR
"humans"[All Fields] OR
"human"[All Fields] |
8 |
2 |
1 |
|
histone H4 & human &
acetyllysine[Title/Abstract] |
("histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields]) AND
("humans"[MeSH Terms] OR
"humans"[All Fields] OR
"human"[All Fields]) AND
acetyllysine[Title/Abstract] |
histone H4
"histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields]
human
"humans"[MeSH Terms] OR
"humans"[All Fields] OR
"human"[All Fields] |
13 |
6 |
2 |
|
histone h4 & acetylation |
("histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields]) AND ("acetylation"[MeSH
Terms] OR "acetylation"[All
Fields]) |
histone h4
"histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields]
acetylation
"acetylation"[MeSH
Terms] OR "acetylation"[All
Fields] |
6314 |
3140 |
843 |
|
histone h4[TiAb] &
acetylation & lys12 |
histone h4[TiAb] AND ("acetylation"[MeSH
Terms] OR "acetylation"[All
Fields]) AND lys12[All
Fields] |
acetylation
"acetylation"[MeSH
Terms] OR "acetylation"[All
Fields] |
9 |
6 |
0 |
|
H4K12 & acetylation |
H4K12[All Fields] AND ("acetylation"[MeSH
Terms] OR "acetylation"[All
Fields]) |
acetylation
"acetylation"[MeSH
Terms] OR "acetylation"[All
Fields] |
31 |
18 |
0 |
|
histone h4 k12
acetylation |
("histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields]) AND
k12[All Fields] AND ("acetylation"[MeSH
Terms] OR "acetylation"[All
Fields]) |
acetylation
"acetylation"[MeSH
Terms] OR "acetylation"[All
Fields]
histone h4
"histones"[MeSH Terms]
OR "histones"[All
Fields] OR ("histone"[All
Fields] AND "h4"[All
Fields]) OR "histone
h4"[All Fields] |
50 |
29 |
0 |
При получении списков статей после ввода запросов, затем очень помогала ссылка "Related citation", которая выдавала нам связанные статьи.
По мере поиска и добавления интересующих статей в коллекцию, сформировалась следующая коллекция
публикаций: Коллекция №1 (предварительная - 15 статей).
После отбора публикаций, наиболее отвечающих поставленной теме, мы получаем следующую коллекцию из
публикаций: Коллекция №2 (окончательная - 5 статей).
В Коллекции №1 также есть очень полезные нам статьи, но мы не используем их в обзорах из-за отсутствия полного текста.
3. Создание возможностей доступа к коллекциям публикаций
- заходим в "My NCBI"
- в блоке "Collections" для необходимых нам коллекций, переходим по ссылке "Private"
- указали для данной коллекции - "Public"
- скопировали полученные ссылки на наши коллекции
4. Информация о посттрансляционной модификации N6-acetyllysine в 12-м остатке гистона H4 и об общем понятии слова "гистон"
Введение
Хромосомная ДНК упакована в компактную структуру с помощью специализированных белков. Все ДНК-связывающие белки эукариот подразделяются на два класса: гистоны - структурные белки эукариотических хромосом и негистоновые хромосомные белки . Комплекс обоих классов белков с ядерной ДНК эукариотических клеток называется хроматином . Гистоны являются уникальной характеристикой эукариот и присутствуют в огромных количествах на клетку (около 60 миллионов молекул каждого типа на клетку).
Гистоны - относительно небольшие белки с очень большой долей положительно заряженных аминокислот (лизина и аргинина); положительный заряд помогает гистонам крепко связываться с ДНК (которая заряжена сильно отрицательно) независимо от ее нуклеотидной последовательности. Возможно, гистоны только изредка диссоциируют от ДНК и таким образом, вероятно, оказывают влияние на любой процесс, происходящий на хромосомах.
Пять типов гистонов распадаются на две главных группы - нуклеосомные гистоны и Н1 гистоны .
Гистоны образуют семейство высококонсервативных основных белков, которые разделяются на пять больших классов, названных H1 , H2A , H2B , H3 и H4 . Гистоны H1 более крупные (около 220 аминокислот) и оказались менее консервативными в ходе эволюции. Гистон H1 сильно обогащен остатками Lys, для гистонов H2A и H2B характерно умеренное содержание Lys, полипептидные цепи гистонов H3 и H4 богаты Arg. Внутри каждого класса гистонов (за исключением H4) на основании аминокислотных последовательностей различают несколько субтипов этих белков. Гистоны H3 и Н4 принадлежат к наиболее консервативным белкам. Такая эволюционная консервативность предполагает, что для функции данных гистонов важны почти что все их аминокислоты.
N- концевая часть данных гистонов может быть обратимо модифицирована в клетке за счет ацетилирования отдельных остатков лизина, что убирает положительный заряд лизинов.
Описание статей
|
№ |
Описание |
Цитаты |
Полный текст |
|
3 |
“Collaboration
between the essential
Esa1 acetyltransferase
and the Rpd3 deacetylase
is mediated by H4K12
histone acetylation in
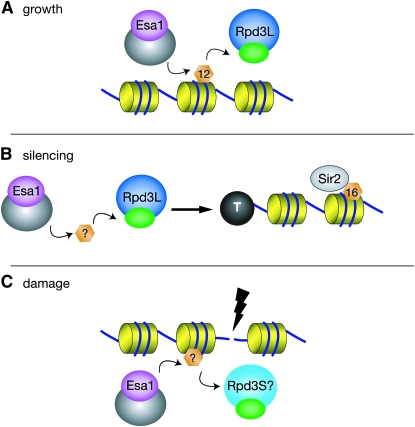
Saccharomyces cerevisiae.” Модификации гистонов, которые регулируют хроматин, зависят от процессов, катализируемых многочисленными комплексами. В Saccharomyces cerevisiae ферменты Esa1 и Rpd3 имеют противоположные ферментативные активности и являются каталитическими субъединицами различных модификаций хроматинового комплекса. Они играют ключевую роль в таких процессах, как регуляция транскрипции и репарации ДНК. Блокировка роста Esa1 происходила из-за нарушения Rpd3L, зависящего от 12-ого остатка гистона Н4 .
Модель изображает важную
роль Esa1 и Rpd3L в
координации
динамического
ацетилирования H4K12. На
рисунке (А): Esa1 и
Rpd3L контролируют
H4K12Ac для основной
транскрипции,
способствуя выживаемости
и росту клеток. На
рисунке (B): Esa1 и
Rpd3L способствуют рДНК
и теломерным глушителям.
Эта связь проходит не
только через H4K12Ac,
но и через другие. Sir2
деацетилирование H4K16
происходит уже после
действия Esa1 и Rpd3L.
На рисунке (C): Esa1 и
Rpd3S, но не Rpd3L,
могут управлять
ацетилированием в местах
повреждения ДНК. |
«Histone modifications
that regulate
chromatin-dependent
processes are catalyzed
by multisubunit
complexes.»;
« In Saccharomyces
cerevisiae, Esa1 and
Rpd3 have opposing
enzymatic activities and
are catalytic subunits
of multiple chromatin
modifying complexes with
key roles in processes
such as transcriptional
regulation and DNA
repair.»;
«The suppression of
esa1's growth defect by
disruption of Rpd3L was
dependent on lysine 12
of histone H4.»;
«A model depicting a
critical role for Esa1
and Rpd3L in
coordinating the dynamic
acetylation of H4K12.
(A) Esa1 and Rpd3L
control H4K12Ac for
general transcriptional
targets contributing to
cell viability and
growth. (B) Esa1 and
Rpd3L contribute to rDNA
and telomeric silencing.
This relationship is not
mediated specifically
through H4K12
acetylation, but likely
through a number of
other targets. Sir2
deacetylation of H4K16
appears downstream of
the role for Esa1 and
Rpd3L. (C) Esa1 and
Rpd3S, but not Rpd3L,
may control acetylation
at sites of DNA damage.» |
|
4 |
“K12-biotinylated
histone H4 is enriched
in telomeric repeats
from human lung IMR-90
fibroblasts.”
Ковалентные модификации
гистонов играют важную
роль в регуляции
истощения теломер и
клеточного старения.
Биотинилирование
остатков лизина (K) в
гистонах при помощи
holocarboxylase
синтетазы (ЖКХ),
является новым
механизмом регулирования
структуры хроматина и
экспрессии генов.
Биотинилирование K12 в
гистоне H4 (H4K12bio)
является маркером
гетерохроматина.
Предположили, что
H4K12bio также
обогащенный теломер. Для
исследования мы взяли
лёгочные фикобласты
человека IMR-90 и
умертвлённые
гиперэкспрессивные
клетки человека IMR-90
теломеразы (hTERT),
чтобы изучить
биотинилирование
гистонов у молодых и
стареющих клеток.
Исследования показывают,
что один из трех
гистонов H4 молекул в
теломерах -
биотинилированный на K12
в клетках hTERT.
Обилие
H4K12bio
в теломерах снизилось на
42% на протяжении
стареющих теломер в
истощённых клетках
IMR-90,
избыточная экспрессия
теломеразы предотвратила
потерю
H4K12bio.
Возможно, вмешивающиеся
факторы, такие как
снижение экспрессии ЖКХ
и биотин-перевозчики,
были официально
исключены из данного
исследования. В
совокупности эти данные
свидетельствуют о том,
что
H4K12bio
обогащается в теломерных
повторах и представляют
собой новый неизвестный
эпигенетический знак о
клеточном старении. |
«Covalent modifications
of histones play a role
in regulating telomere
attrition and cellular
senescence.
Biotinylation of lysine
(K) residues in histones,
mediated by
holocarboxylase
synthetase (HCS), is a
novel diet-dependent
mechanism to regulate
chromatin structure and
gene expression.»;
«…biotinylation of K12
in histone H4 (H4K12bio)
is a marker for
heterochromatin…»;
«…we hypothesized that
H4K12bio is also
enriched in telomeres»;
«We used human IMR-90
lung fibroblasts and
immortalized IMR-90
cells overexpressing
human telomerase (hTERT)
in order to examine
histone biotinylation in
young and senescent
cells.»
«…studies
suggest that one out of
three histone H4
molecules in telomeres
is biotinylated at K12
in hTERT cells.»;
«The abundance of
H4K12bio in telomeres
decreased by 42% during
telomere attrition in
senescent IMR-90 cells;
overexpression of
telomerase prevented the
loss of H4K12bio.
Possible confounders
such as decreased
expression of HCS and
biotin transporters were
formally excluded in
this study.
Collectively, these data
suggest that H4K12bio is
enriched in telomeric
repeats and represents a
novel epigenetic mark
for cell senescence.» |
Заключение
Ознакомившись со всеми найденными статьями, подытожим результаты изучения посттрансляционной модификации N6-acetyllysine в 12-м остатке гистона H4.
Ацетилирование остатков лизина в N-концевых "хвостиках" (tails) гистона H4 (в нашем случае 12-ого остатка) нейтрализует его положительный заряд и соответственно блокирует ассоциацию с витками нуклеосомной ДНК. Это, в свою очередь, декомпактизует структуру как самой нуклеосомы , так и хроматина в целом и, кроме того, освобождает внешнюю поверхность витков ДНК для взаимодействий с регуляторными факторами.
| Главная | Об авторе | Учебные семестры | Проекты автора | Друзья | Ссылки партнеров | Extra | Контакты |
Mneff © 2011-2012