Задание 1
Предсказанная ViennaRNA структура:
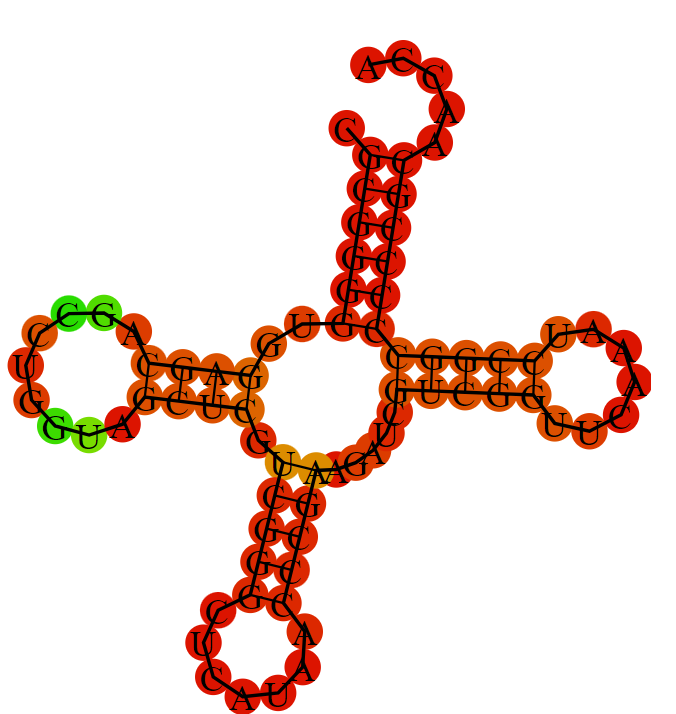
| Тип структуры | find_pair | Einverted | ViennaRNA |
|---|---|---|---|
| Акцепторный стебель | 5’-1-7-3’ 5’-66-72-3’ | 5’-2-7-3’ 5’-67-72-3’ | 5’-2-7-3’ 5’-67-72-3’ |
| D-стебель | 5’-10-13-3’ 5’-22-25-3’ | - | 5’-10-13-3’ 5’-22-25-3’ |
| Антикодоновый стебель | 5’-49-53-3’ 5’-61-65-3’ | - | 5’-49-53-3’ 5’-61-65-3’ |
| T-стебель | 5’-26-31-3’ 5’-39-44-3’ | - | 5’-26-31-3’ 5’-39-44-3’ |
| Общее число канонических пар | 20 | 6 | 20 |
Задание 2
Команды для выбора множеств атомов в JMol:
select set1, chain R+Y and name O3'+O4'+O5'
select set2, chain R+Y and name OP1+OP2
select set3, chain R+Y and symbol N
Последовательные скрипты для демонстрации разных множеств:
1) hide all
show cartoon, chain M+R+Y
2) hide all
show sticks, chain R+Y
3) set sphere_scale, 0.5
show spheres, set1
4) hide spheres, set2
show spheres, set3
Используя скрипт, нашла контакты атомов белка:
contacts with polar unpolar total
desoxyribose residues 1 12 13
phosphoric acid residues 7 5 12
nucleobases, major groove 2 3 5
nucleobases, minor groove 2 1 3
В основном белок взаимодействует с большой бороздкой и остатками дезоксирибозы.
Результат работы nucplot:
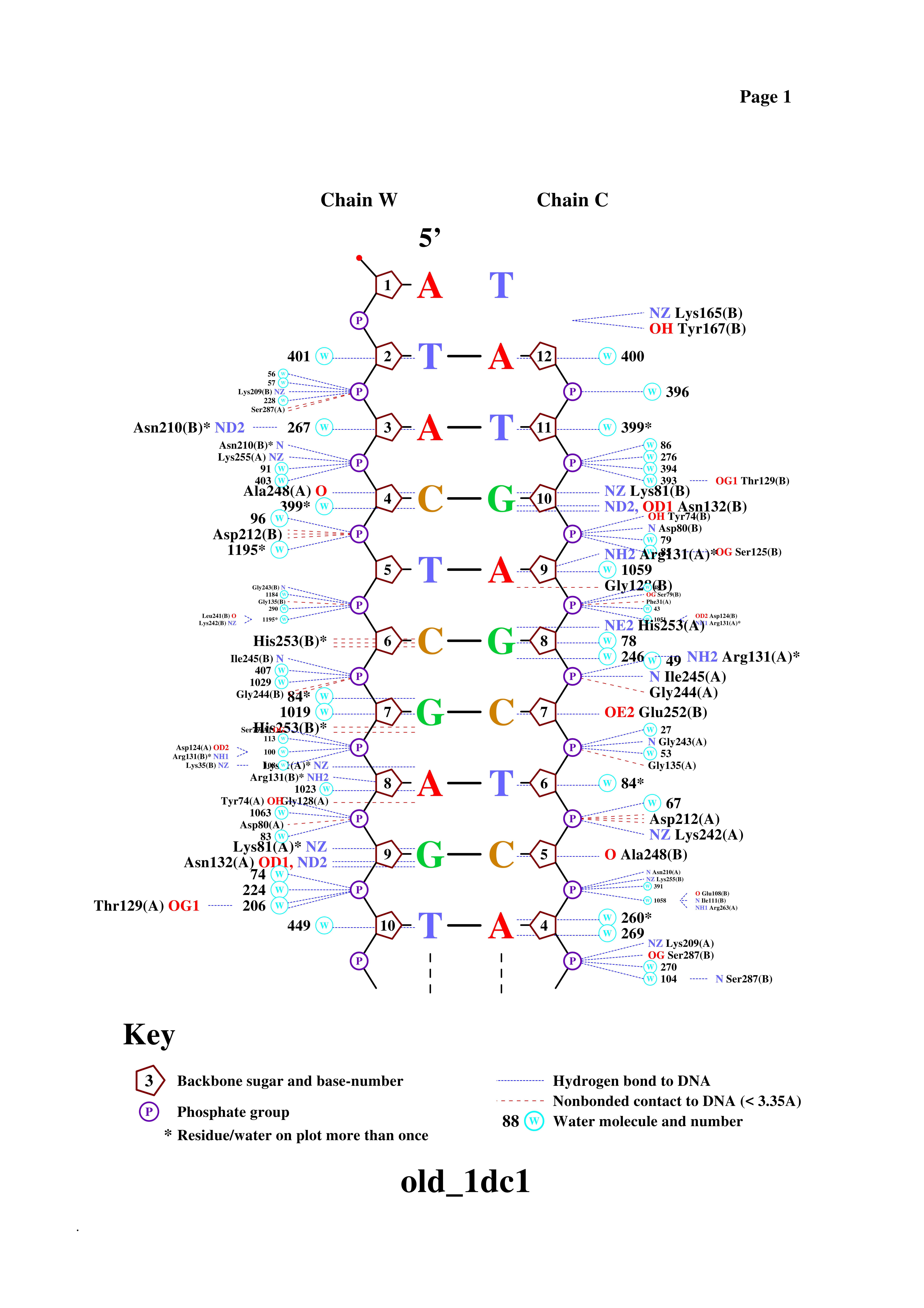
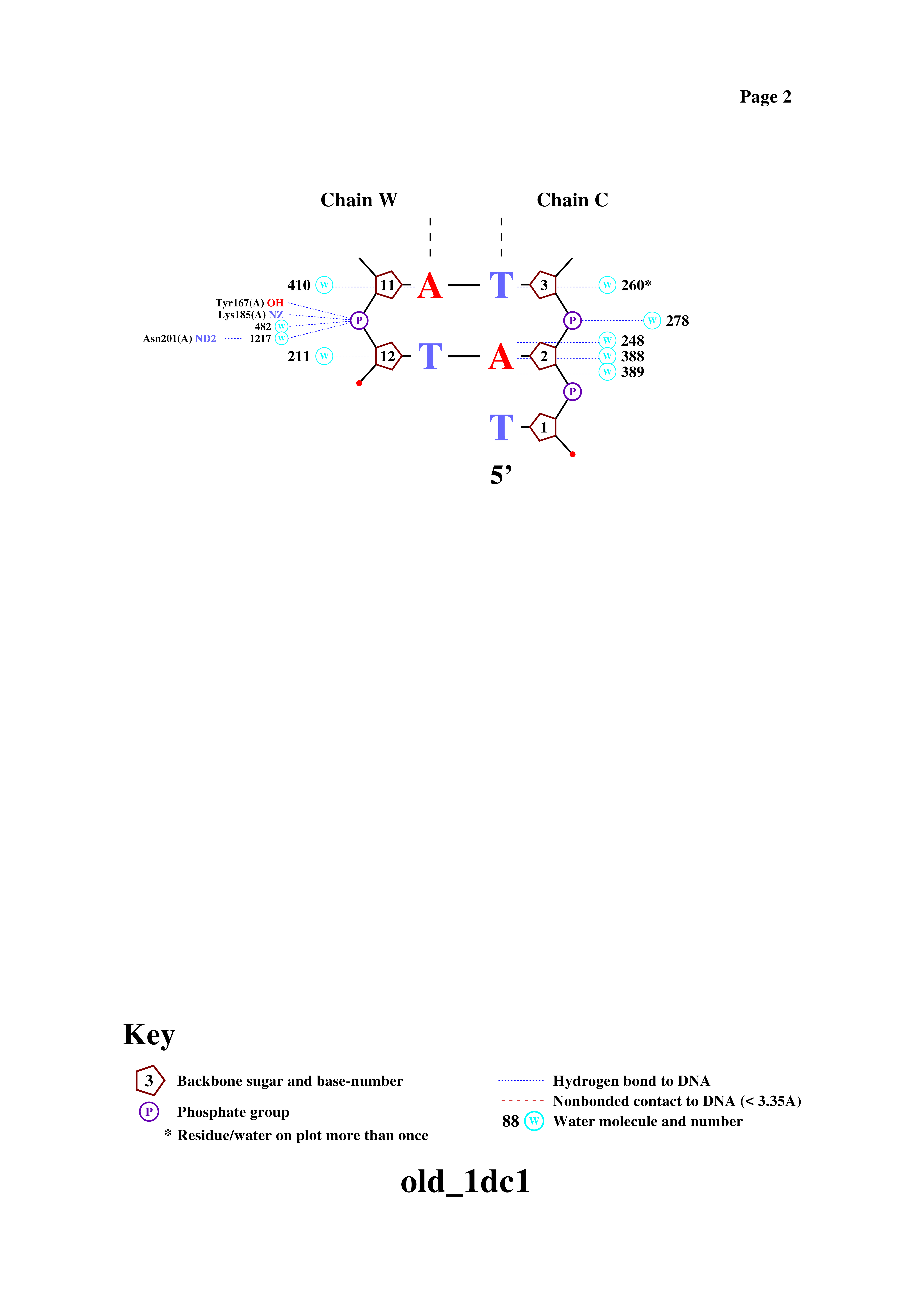
На этих рисунках видно, в каком месте какая аминокислота взаимодействует с сахарофосфатным остовом.
Судя по выводу nucplot, наиболее важна аминокислотa Arg131 - она образует аж шесть водородных связей, судя по файлу old_1dc1.bond
Фрагмент файла old_1dc1.bond:
**** Hydrogen Bonds ***************************
Donor Acceptor Distance
LYS B 209 NZ A W 3 O1P 2.48
ASN B 210 N C W 4 O1P 2.76
LYS A 255 NZ C W 4 O2P 2.73
C W 4 N4 ALA A 248 O 2.61
GLY B 243 N C W 6 O1P 2.67
ILE B 245 N G W 7 O1P 2.88
SER A 79 OG A W 8 O2P 2.69
ARG B 131 NH2 A W 8 O4* 2.86
LYS A 81 NZ A W 8 N7 2.99
TYR A 74 OH G W 9 O1P 2.64
LYS A 81 NZ G W 9 O6 2.84
G W 9 N2 ASN A 132 OD1 2.88
ASN A 132 ND2 G W 9 N3 2.89
LYS A 185 NZ T W 12 O1P 2.74
TYR A 167 OH T W 12 O2P 2.92
LYS A 209 NZ A C 4 O1P 2.76
SER B 287 OG A C 4 O1P 2.65
ASN A 210 N C C 5 O1P 2.81
LYS B 255 NZ C C 5 O2P 2.93
C C 5 N4 ALA B 248 O 2.73
LYS A 242 NZ T C 6 O1P 2.62
GLY A 243 N C C 7 O1P 2.70
C C 7 N4 GLU B 252 OE2 2.97
ILE A 245 N G C 8 O1P 2.90
Логично, что это именно аргинин, потому что он положительно заряжен и очень хороший донор водородных связей. Его положительный заряд может взаимодействовать с отрицательно заряженным сахарофосфатным остовом.