Задача — предсказать двумя способами топологию мембранного белка и сравнить предсказание с 3D-структурой его близкого гомолога.
| Название | Белок для исследования | Белок-прототип | |||
| SwissProt ID | SwissProt AC | SwissProt ID | SwissProt AC | PDB ID | |
| Glycerol uptake facilitator (глицеринпроводящий канальный белок) | GLPF_PSEAE | Q51389 | GLPF_ECOLI | P0AER0 | 1ldf |
Последовательности белков в формате Fasta были взяты из базы SwissProt, выравнивания получены программой Needle с параметрами по умолчанию и обработаны в GeneDoc. Они будут приведены ниже.
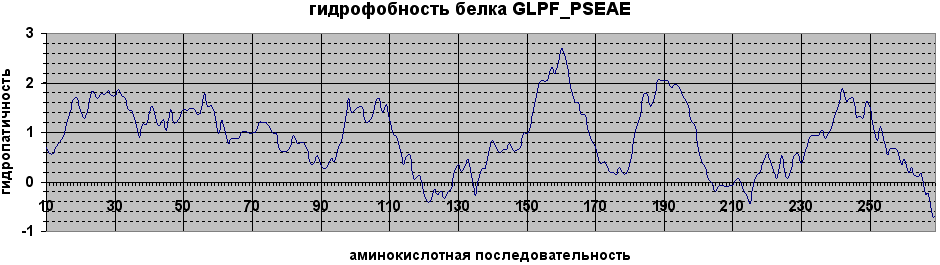
Был построен профиль гидрофобности белка по последовательности с помощью программы pepwindow пакета EMBOSS командой
pepwindow -graph data -length 19(размер скользящего окна 19). Остальные данные задавались в диалоговом режиме.
По полученным данным был построен график в Excel и определены вероятные трансмембранные сегменты как участки последовательности по 9 аминокислот в обе стороны от точек, в которых значение гидропатичности более 1,8.
Предсказание TMHMM по аминокислотной последовательности, опции по умолчанию: ![]()
Кроме предсказанных мембранных участков, на графике, выданном TMHMM, мы можем видеть предположительно внутренние и внешние участки, а также вероятности, что участок является внешним, внутренним или трансмембранным.
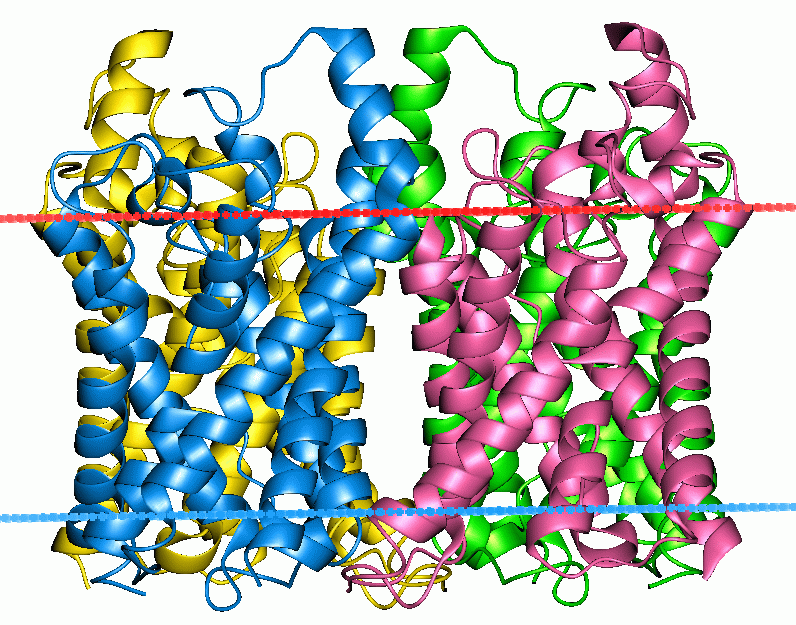
Описание трансмембранных сегментов было найдено в БД OPM (Orientations of Proteins in Membranes database) по идентификатору PDB.
Положение белка GLPF_ECOLI в мембране по данным OPM:
 |
 |
Ниже приведены картинки, полученные по PDB-структуре 1ldf с помощью RasMol. Условные границы мембраны состоят из искуственно добавленных атомов ("dum"), стороны мембраны обозначены так же как и в OPM (красным — периплазматическая, синим — цитоплазматическая). Раскраска белка — по структуре (structure).
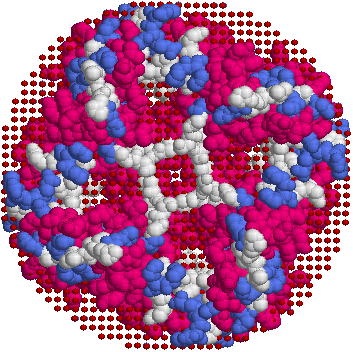 | 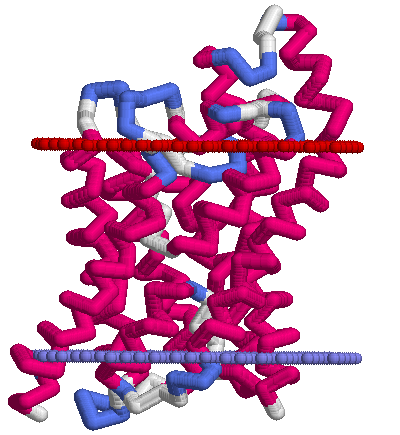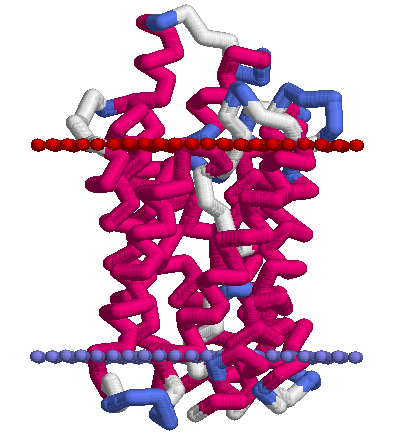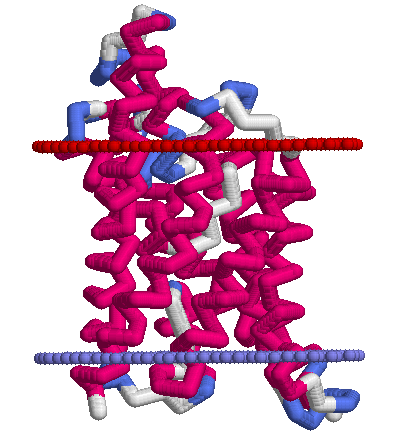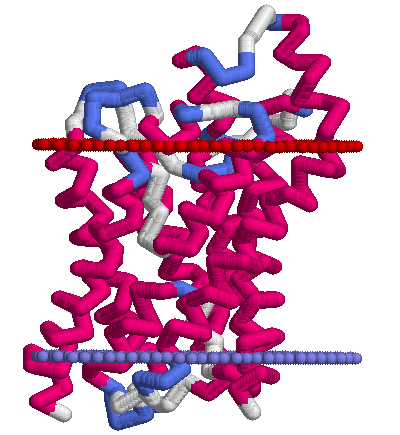 |
| Тетрамер белка, вид сверху (с периплазматической стороны мембраны) | Мономер, вид сбоку |
Топология белка глицеринпроводящего канала:
| Предсказание трансмембранных сегментов почти вручную | Предсказание с помощью TMHMM | Локализация белка в мембране по данным ОРМ | ||||
| Номер трансмембранного сегмента | начало | конец | начало | конец | начало | конец |
| 1 | 19 | 40 | 15 | 37 | 14 | 34 |
| 2 | - | - | 42 | 61 | 44 | 62 |
| 3 | - | - | 65 | 82 | 72 | 78 |
| 4 | - | - | 89 | 111 | 89 | 110 |
| 5 | 144 | 172 | 147 | 169 | 148 | 169 |
| 6 | 180 | 204 | 181 | 203 | 182 | 198 |
| 7 | - | - | - | - | 207 | 219 |
| 8 | 233 | 251 | 236 | 258 | 236 | 254 |
Выравнивание последовательностей. Ниже собственно выравниваний приведена предсказанная структура: строка Manual соответствует предсказанию "почти вручную", TMHMM — по TMHMM, OPM — трансмембранные участки определялись по БД OPM, а внешние и внутренние петли — по PDB-структуре для белка-прототипа. При определении "почти вручную" внутреннее или внешнее положение петли определялось в соответствии с правилом von Hejne: цитоплазматические (внутренние) петли между мембранными сегментами содержат больше положительно заряженных остатков (H, K, R), чем внешние петли.
Мембранные сегменты обозначены как "H", внешние петли как "-", внутренние петли как "+", петли, находящиеся внутри мембраны, обозначены как "=". ![]()
Сравнение двух предсказанных топологий и положения белка в мембране:
| По профилю гидрофобности | По TMHMM | ||
| Всего предсказано остатков в спиралях (N) | 95 | 153 | |
| Из них | По данным ОРМ находятся внутри мембраны (A) | 71 | 125 |
| Из них - "торчащие" из мембраны остатки на концах спиралей (по данным PDB-структуры) (B) | 3 | 5 | |
| Вообще не имеют никакого отношения к трансмембранным спиралям (C) | 24 | 28 | |
| Число непредсказанных остатков, которые по данным ОРМ находятся в мембране (D) | 69 | 15 | |
| Точность предсказания, A/N | 0,747 | 0,817 | |
| Сверхпредсказание, C/N | 0,253 | 0,183 | |
| Недопредсказание, D/(L-N), где L-длина последовательности (L=279) | 0,375 | 0,119 | |
Вывод: при предсказании "вручную" не было определено много мембранных фрагментов. Это может объясняться тем, что белок является транспортёром, то есть некоторые из трансмембранных спиралей соприкасаются с гидрофильными молекулами и поэтому менее гидрофобны, чем следовало бы ожидать.