1.Введение
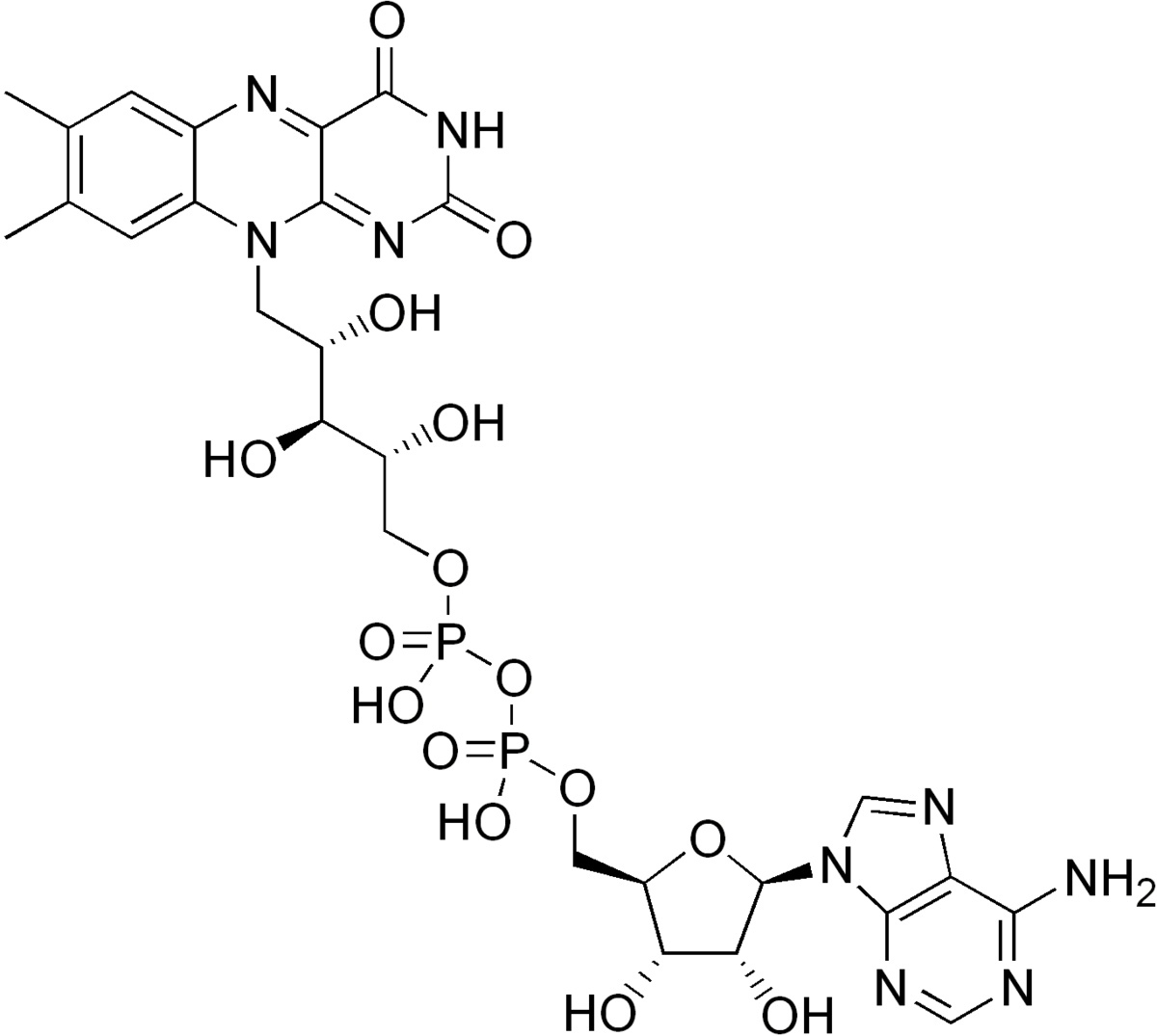
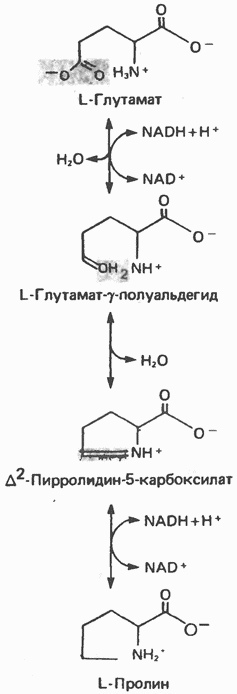
Пролин – дегидрогеназа (EC:1.5.5.2) – это фермент, который участвует в двухстадийном превращении пролина в глутамат, катализируя первую стадию. Кофактором пролин – дегидрогеназы является FAD (рисунок 1). Структура белка состоит из двух цепей, каталитический центр фермента имеет форму цилиндра, на карбоксильных концах которого и происходит связывание кофактора FAD с каждой белковой цепью.[1] В Thermus thermophiles, откуда фермент был получен, он катализирует следующую реакцию: a quinone + L-proline = (S)-1-pyrroline-5-carboxylate + a quinol + H+ (рисунок 2). [2]
Thermus thermophiles – это грамотрицательные бактерии из семейства Thermaceae, порядка Thermales [3], которые являются важным модельным объектом в биоинженерии, биотехнологии и других областях науки. Этот организм обитает в условиях с экстремально высокими температурами (от 65 до 72 градусов Цельсия), впервые Thermus thermophiles был найден в геотермальном источнике города Изу, Япония. Типовой штамм бактерии - HB8.[4] Этот вид бактерий хорошо подвержен воздействию различных растворителей, а также механизм работы пролин – дегидрогеназы в Thermus thermophiles сходен с таковым в эукариотических клетках, поэтому для выделения данного фермента используют именно Thermus thermophiles. [1]
На данном апплете представлены цепи пролин – дегидрогеназы, покрашенные в разные цвета (color chain), а также молекулы FAD (select FAD, cpk 70, wireframe 50, color cpk). Скрипт Вы можете увидеть по следующей ссылке: Скрипт
2.Таблица с информацией о белке
В данной таблице представлена общая информация о белке, полученная с помощью Uniprot.
| Характеристика белка | Результаты | |
|---|---|---|
| UniProtKB | Swiss-Prot | |
| UniProt ID | PRODH_THET2 | |
| UniProt AC | Q72IB8 | |
| EMBL AC | AE017221; AAS81556.1; -; Genomic_DNA | |
| Gene names | TT_C1214 | |
| Length | 307 AA | |
| RecName | Full: Proline dehydrogenase Short: PRODH EC: 1.5.5.2 |
|
| Известна структура всего белка. | ||
Таблица 1. Информация о белке.
3.Результаты поисковых запросов к UniProt
В этом разделе обсуждаются результаты поисковых запросов в UniProt. Запросы и результаты можно посмотреть по ссылке в таблице 2.
При помощи UniProt мы изучали:
- представленность пролин – дегидрогеназы у разных систематических групп;
- представленность белков в целом и пролин – дегидрогеназ в частности у Thermus Thermophilus;
- поиск информации о способе получения белка и информации о его функциях;
- биотехнологическое значение Thermus Thermophilus.
Выводы по данным запросам:
Пролин – дегидрогеназа широко представлена у разного рода организмов (запрос 1), она встречается как и у бактерий (запросы 2-6), так и у эукариотических организмов (запрос 12). У Thermus Thermophilus имеется большое разнообразие белков (запрос 7), в том числе 9 различных пролин – дегидрогеназ (запрос 8), однако только пролин – дегидрогеназа (EC:1.5.5.2) представлена в UniProt в секции Swiss-Prot, то есть информация о ней проверена и дополнена. Как видно из запросов 9 и 10, ген TT_C1214 кодирует в семействе Thermaceae только один фермент, этот ген ассоциирован исключительно с пролин – дегидрогеназой (EC:1.5.5.2) (запрос 13). Запросы 14 – 16 показывают, что в исследованиях был выделен и изучен данный конкретный белок, были предсказаны его функции, а также при исследовании работы белка была использована информация о гомологичных белках. Поскольку Thermus Thermophilus имеет важное значение, как модельный объект в биологии, был также сделан 17 запрос. Он показал, что в биоинженерии используется термостабильная ДНК – полимераза I, выделяемая из данной бактерии.
Таблица 3. Исследование кластеров UniRef.
| Раздел UniRef | Cluster ID | Cluster name | Size | Swiss - Prot | UniParc |
|---|---|---|---|---|---|
| UniRef50 | UniRef50_Q72IB8 | Cluster: Proline dehydrogenase | 77 | 1 | 76 |
| UniRef90 | UniRef90_Q72IB8 | Cluster: Proline dehydrogenase | 15 | 1 | 14 |
| UniRef100 | UniRef100_Q72IB8 | Cluster: Proline dehydrogenase | 3 | 1 | 2 |
Выводы по UniRef:
В результаты запросов было выявлено, что изучаемый белок в каждом кластере является репрезентативной последовательностью. Таким образом, именно он используется для аннотации всего кластера, то есть указываются его название и длина. Это значит, что изучаемая последовательность представляет собой проверенную вручную (находящуюся в базе данных Swiss - Prot), аннотированную, выделенную из модельного организма аминокислотную последовательность. Также важно отметить, что исследуемая последовательность не является самой длинной, что обычно предпочтительно для репрезентативной.
Кластер Uniref50 довольно большой (size 77), что говорит о распространённости нашего белка. Однако в основном исследуемый белок встречается у других видов рода Thermus, что говорит о небольшом разнообразии таксонов, в которых его можно встретить.
4.Сравнение протеомов
Довольно часто термостабильные бактерии являются модельными объектами в биологии. Кроме исследуемой Thermus thermophiles, широко используется Methanocaldococcus jannaschii - строго говоря, термостабильная метаногенная архея.[5] Это также первая архея, чей геном был полностью отсеквенирован и изучен. В работе было проведено сравнение этих широко используемых модельных объектов, изучены их протеомы и представленность различных видов белков в них. Результаты можно увидеть в таблице 4.
Таблица 4. Сравнение протеомов.
| Организм | ID протеома | Общее количество белков | Количество белков в Swiss - Prot | Трансмембранные белки | Ферменты | Термостабильные белки |
|---|---|---|---|---|---|---|
| Thermus thermophilus (strain HB27 / ATCC BAA-163 / DSM 7039) | UP000000592 | 2200 | 376 | 385 | 733 | 5 |
| Methanocaldococcus jannaschii (strain ATCC 43067 / DSM 2661 / JAL-1 / JCM 10045 / NBRC 100440) | UP000000805 | 1787 | 1787 | 294 | 582 | 48 |
Увидеть запросы можно по ссылке.
Как видно из результатов работы, в Thermus thermophiles больше белков, однако только их маленькая часть (376) находится в базе Swiss - Prot, то есть аннотирована и описана. В архее же в Swiss - Prot находятся все белки (поскольку это часто используемый модельный объект). В изучаемой бактерии больше трансмембранных белков и ферментов, чем в Methanocaldococcus, однако в архее больше термостабильных белков, что можно объяснить обитанием в более суровых условиях, сходных с условиями на поверхности ранней Земли.[6]
5.Дополнительная информация, полученная с помощью UniProt
Первая запись о пролин – дегидрогеназе была сделана 5 июля 2004 года, до 2016 года все записи о белке делались автоматически (TrEMBL), но, начиная с 84 записи, фермент записывается в секции Swiss-Prot. Последняя запись была сделана 7 апреля 2021 года. Всего на странице UniProt нашего белка 106 записей, можно найти информацию как в формате txt, так и в формате fasta.
UniProtKB может дать много сведений о изучаемом белке. В поле CC находится информация о различных функциях и свойствах фермента. В строчке FUNCTION содержится краткое описание процессов, где принимает участие белок, в CATALYTIC ACTIVITY написана реакция, катализируемая пролин – дегидрогеназой, COFACTOR включает в себя информацию о FAD, ACTIVITY REGULATION – о путях регуляции фермента. В строчке BIOPHYSICOCHEMICAL PROPERTIES находятся различные физико – химические характеристики белка (например, константа Михаэлиса - Ментен для L- пролина равна 27 mM, электродный потенциал равен -75 mV). В PATHWAY указаны метаболические пути, где участвует пролин – дегидрогеназа. SUBUNIT описывает четвертичную структуру (гомодимер), SIMILARITY содержит в себе информацию о семейству, к которому принадлежит фермент.
В поле FT содержится информация о вторичной структуре белка. Там указывается, какие участки аминокислотной последовательности образуют альфа – спираль, поворот или остаются в виде цепи. Также там можно найти данные об активном сайте фермента и кофакторе FAD.
6.Литература
- Structure and Kinetics of Monofunctional Proline Dehydrogenase from Thermus thermophiles - Tommi A.White, NavasonaKrishnan, Donald F.Becker, John J.Tanner – Journal of Biological Chemistry, Volume 282, Issue 19, 11 May 2007, Pages 14316-14327
- Structural basis for the inactivation of Thermus thermophilus proline dehydrogenase by N-propargylglycine - Tommi A White, William H Johnson Jr, Christian P Whitman, John J Tanner - Biochemistry. 2008 May 20; 47(20):5573-80
- Таксономия Thermus thermophiles
- Description of Thermus thermophilus (Yoshida and Oshima) comb. nov., a Nonsporulating Thermophilic Bacterium from a Japanese Thermal Spa – Tairo Oshima and Kazutomo Imahori - INTERNATIONAL JOURNAL OF SYSTEMATIC AND EVOLUTIONARY MICROBIOLOGY, Volume 24, Issue 1, First Published: 01 January 1974
- Hemoproteins in Dissimilatory Sulfate- and Sulfur-Reducing Prokaryotes - Guy D. Fauque, Larry L. Barton, in Advances in Microbial Physiology, 2012
- A Genetic System for Methanocaldococcus jannaschii: An Evolutionary Deeply Rooted Hyperthermophilic Methanarchaeon - Dwi Susanti, Mary C. Frazier and Biswarup Mukhopadhyay - Front Microbiol. 2019; 10: 1256.