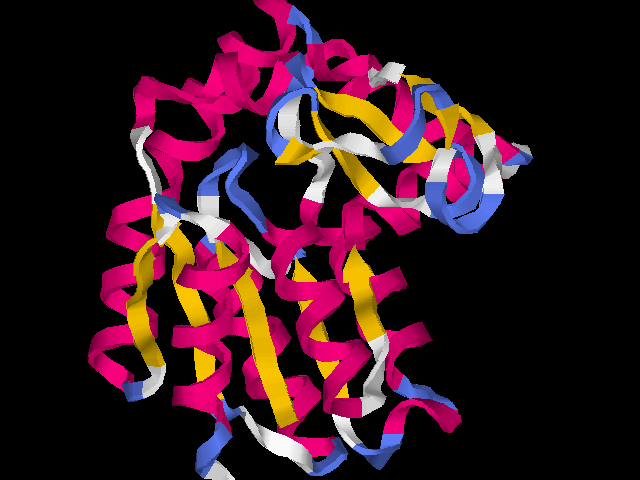
Общий вид структуры белка:

Для исследования выбраны следующие элементы вторичной структуры:
Общий вид белка с подсвеченной α-спиралью:
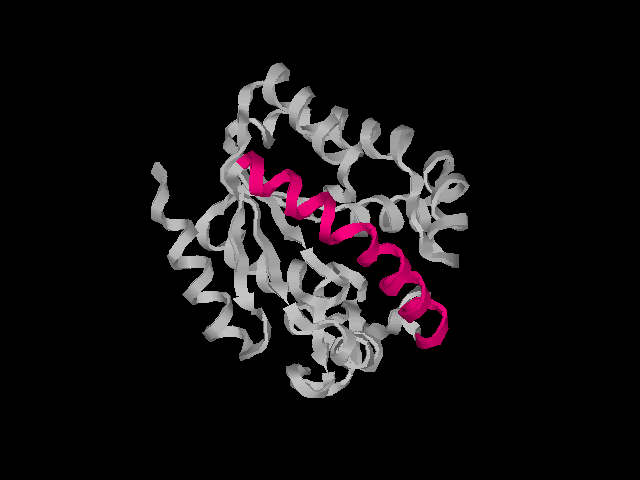
Только α-спираль:

Остов α-спирали с водородными связями:
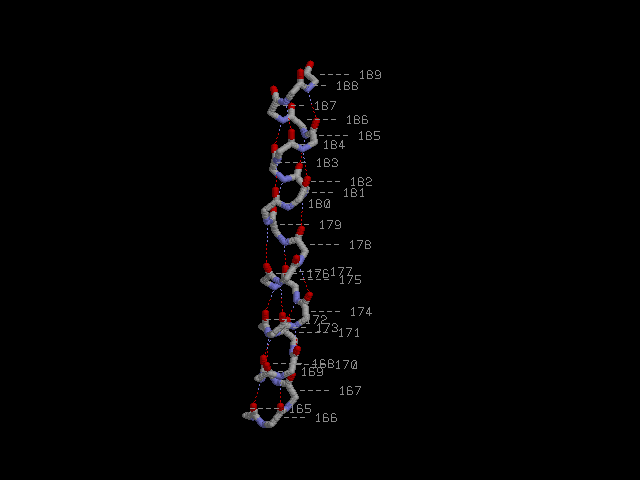
Паттерн водородных связей: H(k.O, 4+k.N) при k = 165..185.
α-спираль и Cβ-атомы (красные шарики):
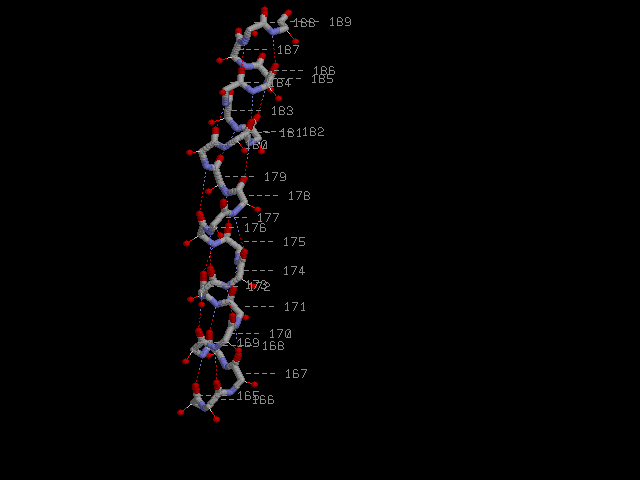
Все Cβ-атомы расположены снаружи спирали и направлены в сторону N-конца.
Скрипт, выводящий изображения α-спирали, можно загрузить здесь.
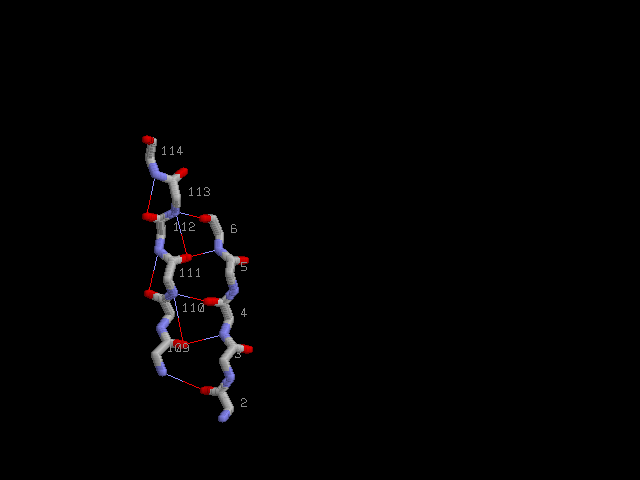
Параллельные β-тяжи с водородными связями:
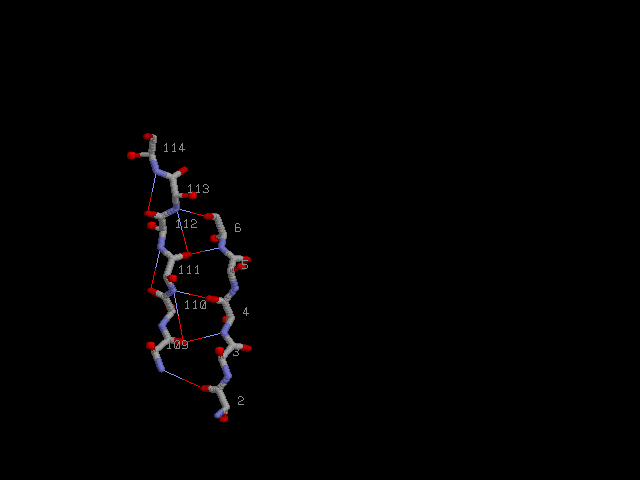
Параллельные β-тяжи с водородными связями и Cβ-атомами:
Антипараллельные β-тяжи с водородными связями:
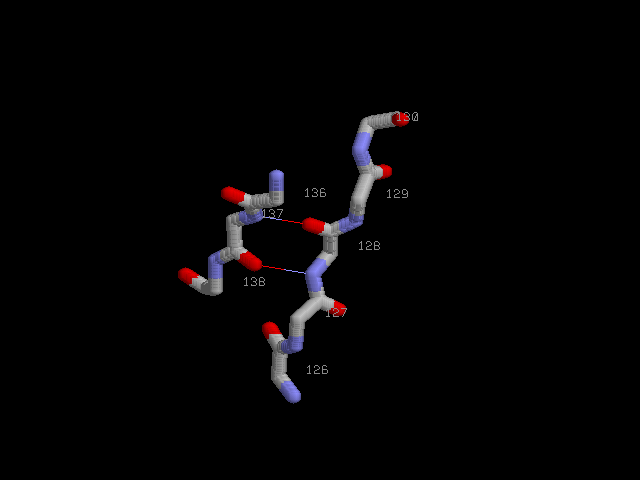
Антипараллельные β-тяжи с водородными связями и Cβ-атомами:

Для β-тяжей характерна следующая закономерность в расположении Cβ-атомов: атомы, выходящие из плоскости листа и уходящие за плоскость чередуются, причем соседние атомы β-тяжей ориентированы в одну сторону.
β-поворот на 180°:

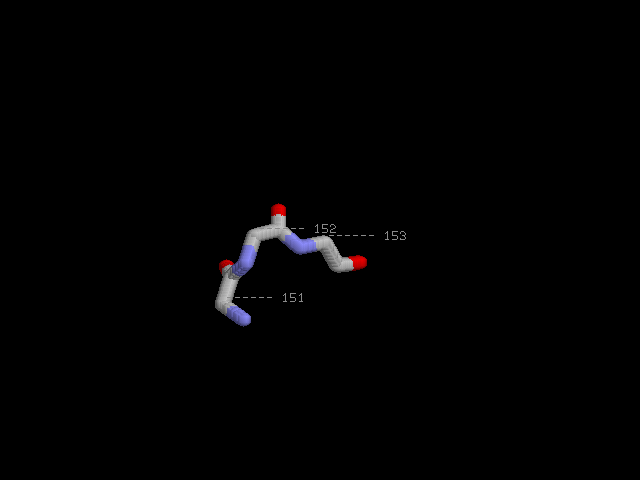
Поворот образован аминокислотными остатками Asp151 Lys152 Asp153.
Водородная связь отсутствует.