Серыми линиями на фоне рисунка отображается аминокислотный остов белка, непосредственно не контактирующий с молекулой глюкозы.
Рисунок был получен выделением аминокислотных остатков в окрестности молекулы глюкозы.
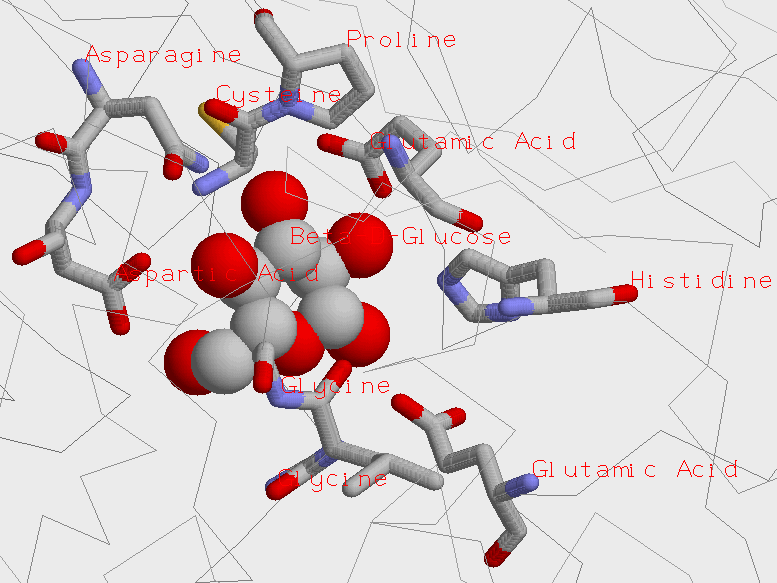
Изображение области связывания молекулы бета-D-глюкозы и белка глюкокиназа
 |
В центре изображена молекула глюкозы. Вокруг неё находятся остатки аминокислот, с ней взаимодействующие.
Серыми линиями на фоне рисунка отображается аминокислотный остов белка, непосредственно не контактирующий с молекулой глюкозы. Рисунок был получен выделением аминокислотных остатков в окрестности молекулы глюкозы. |
План генноинженерного эксперимента
Молекула глюкозы контактирует с остатками следующих аминокислот: гистидин, аспарагиновая кислота, аспарагин, глутаминовые кислоты, а также пролин, цистеин, глицины и лейцин.
Замена гистидина, глутаминовых кислот, аспарагина и аспарагиновой кислоты может привести к потере связывания белка с глюкозой. Их замена (практически всеми аминокислотами, кроме замены друг другом) вызовет потерю связи. Глутаминовая кислота также может быть заменена только аспарагиновой. Иначе связи остатка аминокислоты и глюкозы не будет.
При замене полярных гистидина и аспарагина, способных устанавливать водородные связи, на гидрофобные неполярные приведёт к нарушению способности связывания белка и глюкозы. Например, на цистеин, валин, фенилаланин, лейцин или изолейцин.
А замена гистидина на лизин к потере связывания не приведёт, т. к. он также полярный, подходит по размеру, также положительно заряжен, схожие гидрофил-гидрофобные свойства.
Без потери связывания аспарагин можно заменить на глутамин, т. к. эти аминокислоты отличаются друг от друга только на одну метиленовую группу и свойства практически совпадают. Также аспарагин можно заменить на серин, т. к. их свойства во многом схожи.
Пролин, цистеин, лейцин и глицины хоть и контактируют с молекулой глюкозы, но всё же находятся от неё на предельном для связи расстоянии и слабо связаны с ней. Все эти аминокислоты гидрофобны, кроме пролина, и неполярны. К потере сзязывания белка с молекулой глюкозы может привести только их замена на аминокислоты с резко противоположными свойствами. Например, замена глицина или лейцина на аргинин или серин.
Эти аминокислоты можно заменить на цистеин, изолейцин, валин, аланин или фенилаланин без потери связывания глюкозы с глюкокиназой.
На главную страницу первого семестра