На главную
На предыдущую страницу
Контакты 2'-DEOXY-THYMIDINE-5'-TRIPHOSPHATE с белком RIR1.
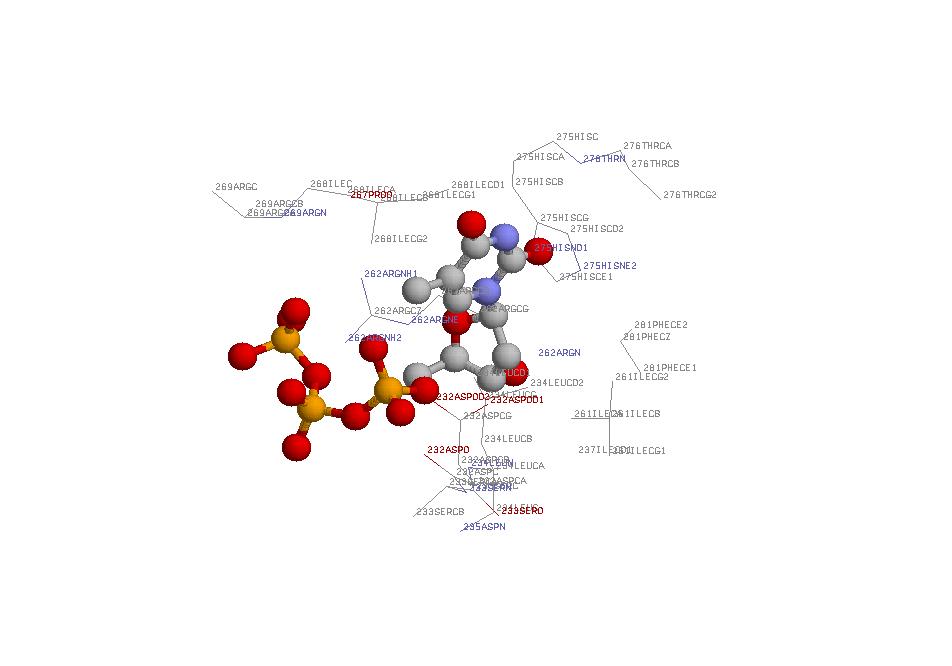
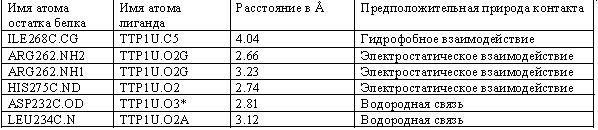
На мой взгляд, следующие замены аминокислотных остатков практически не изменят сродство белка к лиганду:
- Изолейцин 268 заменить на лейцин или валин
- Лейцин 234 можно менять практически на любой гидрофобный а/к остаток (желательно не очень активный,
т.к. в данном случае предугадать последствия значительно сложнее), потому что предполагаемая водородная
связь здесь образуется с атомом азота главной цепи белка.
- Аспарагиновую кислоту 232 наверняка можно заменить глутаминовой.
Следующие замены, по-видимому, будут сильно влиять на способность белка связывать данный лиганд:
- Можно заменить аргинин 262 на любую аминокислоту с алифатической боковой цепью, что не даст возможности
электростатическому взаимодействию. Если же заменять этот остаток остатком, скажем, серина, то сродство
белка к лиганду возрастет, т.к. между -OH группой аминокислоты и атомом TTP1U.O2G будет образовываться
водородная связь.
- Если аспарагиновую кислоту 232 заменить, например, на фенилаланин, то предполагаемой водородной связи
образовываться не будет, что значительно уменьшит сродство белка лиганду.

