Практикум 3-5
Структура в целом
Макромолекула является гипотетическим белком TA0289. Это гомодимер, т.е. белок состоит из двух идентичных по аминокислотному составу полимерный цепей (A и В)
В структуре преобладают α-спирали
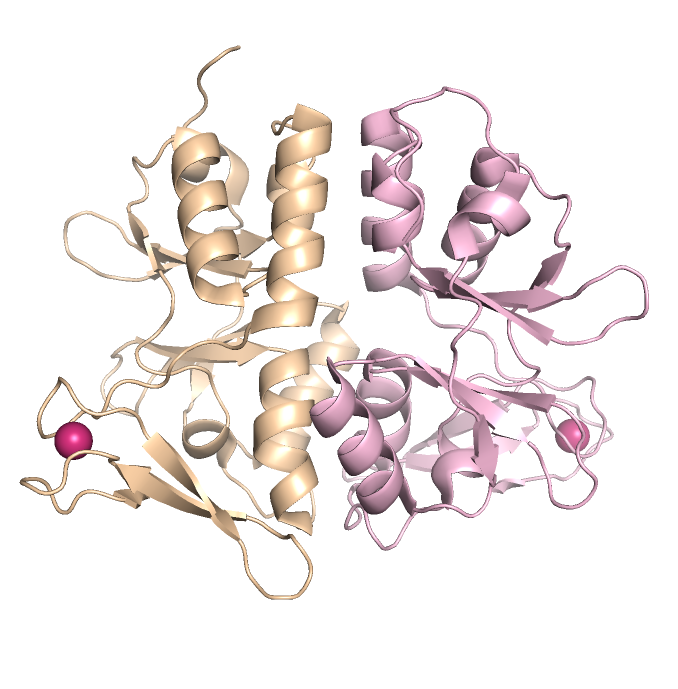
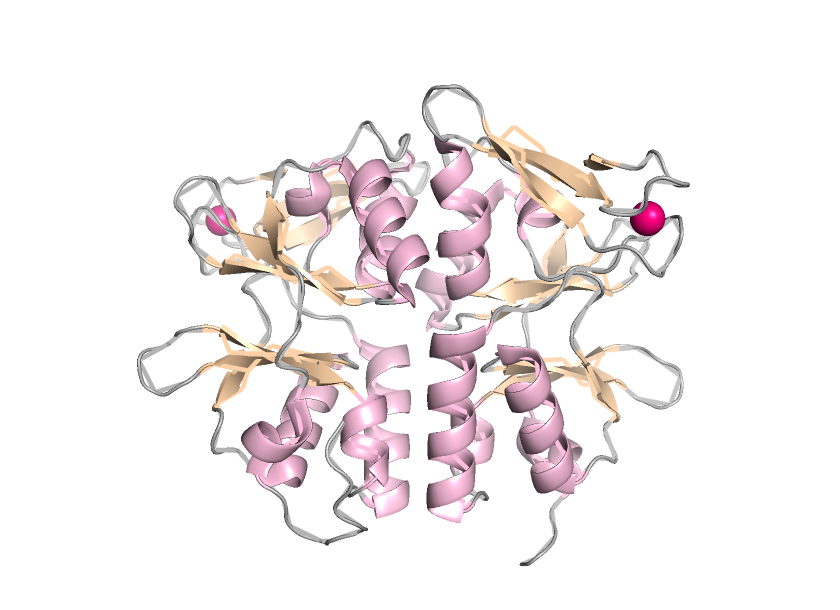
Отдельные цепи
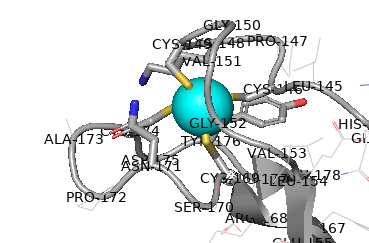
Белок принадлежит архее Thermoplasma acidophilum. TA0289 представляет собой димер из идентичных субъединиц. Два домена CBS соединяют две цепи, два домена цинковой ленты расположены по разные стороны комплекса. Четыре аминокислоты цистеина в каждой цинковой ленте координируют атом железа, показанный здесь ярко-розовым цветом
Функция белка до конца не изучена, но при очистке TA0289 приобретает красновато-фиолетовый цвет, это обусловлено связыванием ионов железа. Это похоже на белок рубредоксин, который содержит аналогичный участок связывания железа и при очистке приобретает такой же цвет. Так что исследователи предполагают, то белок TA0289 так же как и рубредоксин участвать в переносе электронов в биологических системах.
PDB id: 2qh1
UniProt id: Q9HLD9
Мутации: имеется одна мутация относительно UNIPROT в 129 аминокислоте: в UNIPROT стоит серин, а в PDB - пролин. Модифицированных аминокислотных остатков нет.
Малые молекулы
Последовательность содержит 2 малых молекулы: хлорид-ионы ( FE(II) ION, FE2)
Ссылки на файлы с соответствующими строками из PDB: ионы железа
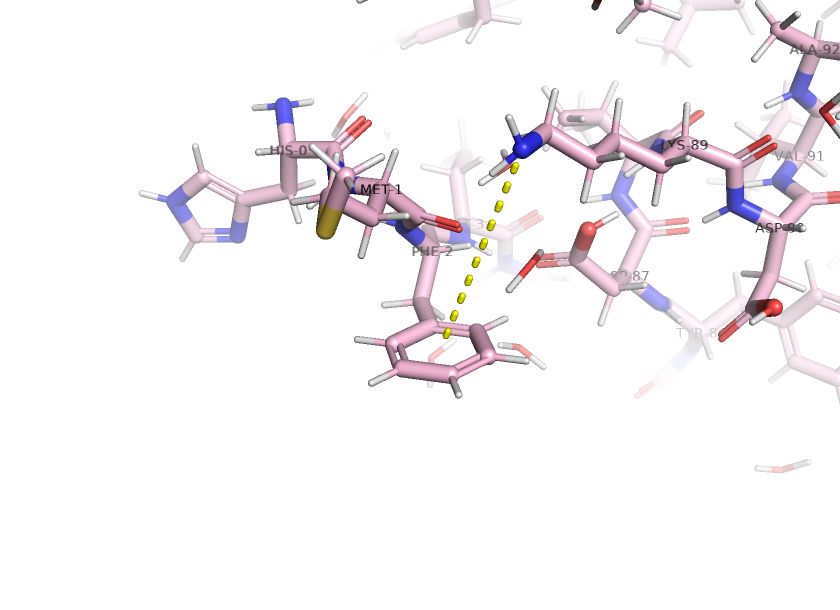
Взаимодействия между аминокислотными остатками
Водородная связь между атомами остова белка.
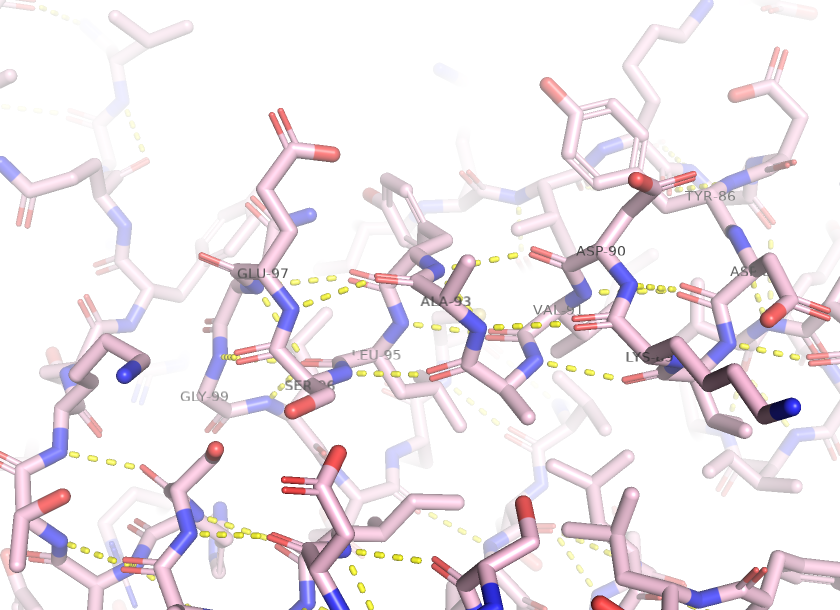
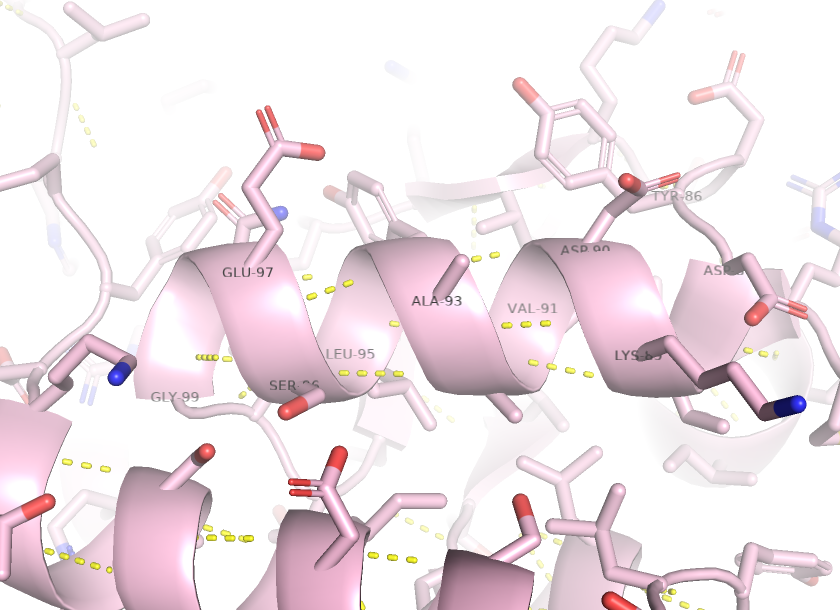
Водородная связь между атомами боковых радикалов.
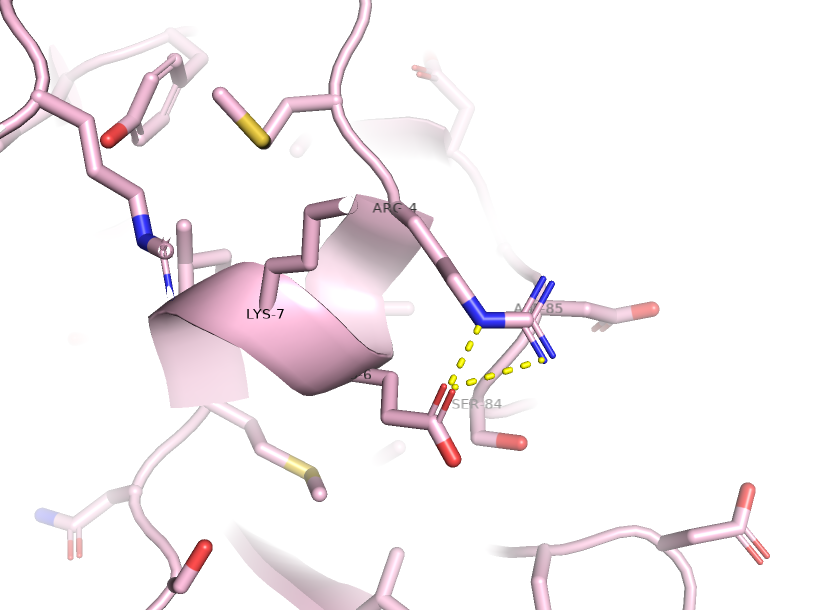
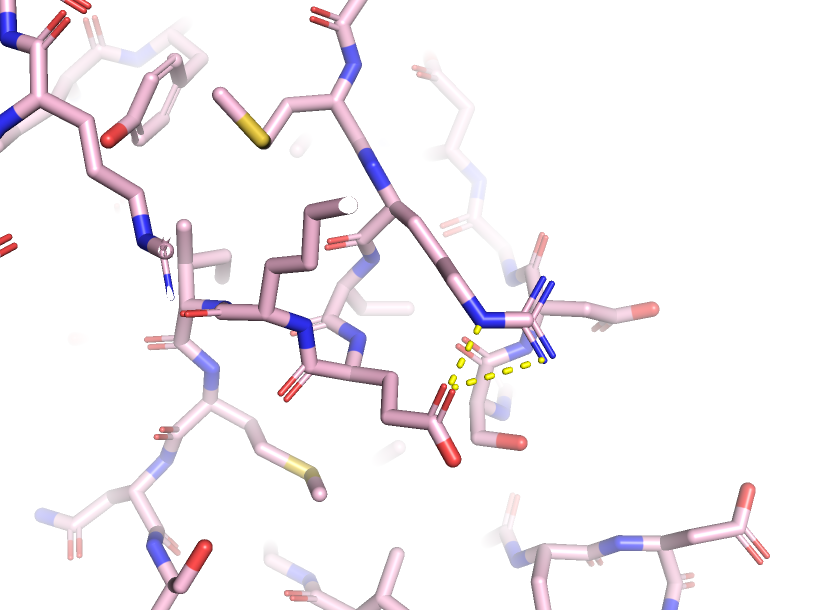
Солевые мостики
Цистеины находятся далеко друг от друга, дисульфидных мостиков не образуют

Стекинговые взаимодействия