|
Главная
I Семестр
II Семестр
III Семестр
IV Семестр
V Семестр
VI Семестр
Проекты
Обратная Связь
|
Гомологичное моделирование комплекса белка с лигандом
Цель данного занятия - ознакомиться с возможностями гомологичного моделирования комплекса белка с лигандом.
На этом занятии мы будем пользоваться пакетом Modeller для работы с белком лизоцимом из указанного организма. Используя известную структуру лизоцима форели в качестве образца, попробуем построить модель комплекса нашего белка с лигандом.
Программе MODELLER для моделирования структуры белков в качестве входных данных нужны: управляющий скрипт, файл pdb со структурой-образцом, файл выравнивания с дополнительной информацией.
Построим выравнивание последовательности из структуры 1lmp и белка лизоцим С из тюленя Уэдделла. Запустили программу Clustal и сохранили полученное выравнивание в формате PIR.
Далее немного модификацировали файл выравнивания:
Переименовали последовательность в файле выравнивания следующим образом:
| Было | Стало |
| >P1;uniprot|Q659U0|LYSC_LEPWE | >P1;seq |
| >P1;1LMP__|PDBID|CHAIN|SEQUENCE | >P1;1lmp |
После имени последовательности моделируемого белка добавили строчку:
sequence:ХХХХХ::::::: 0.00: 0.00
Эта строчка описывает входные параметры последовательности для modeller.
После имени последовательности белка-образца добавили:
structureX:1lmp_now.ent:1 :A: 132 :A:undefined:undefined:-1.00:-1.00
Эта строчка описывает, какой файл содержит структуру белка с этой последовательностью, номера первой и последней аминокислот в структуре, идентификатор цепи и т.д.
В конце каждой последовательности добавили символы: /.
Символ "/" означает конец цепи белка. Точка указывает на то, что имеется один лиганд (если бы было два лиганда стояли бы две точки).
В итоге получили следующий файл выравнивания: 1lmp_lepwe.pir
На следующем этапе модифицировали файла со структурой:
Удалили всю воду из структуры (в текстовом редакторе), всем атомам лиганда присвоили один и тот же номер "остатка" (MODELLER считает, что один лиганд = один остаток), модифицировали имена атомов каждого остатка, добавив в конец буквы A, B, C. Смысл операции в том, чтобы атомы остатка 130 имели индекс А, атомы остатка 131 имели индекс В и т.д.. После модификации имен атомов изменили номера остатков на 130.
Пример:
| Было | Стало |
| HETATM 1014 O7 NAG 130 | HETATM 1014 O7A NAG 130 |
| HETATM 1015 C1 NAG 131 | HETATM 1015 C1B NAG 130 |
В итоге получили следующий файл: 1lmp_now.ent
На следующем этапе cоздали управляющий скрипт: lysc_lepwe.py.
Была представляена следующая заготовка:
from modeller.automodel import *
class mymodel(automodel):
def special_restraints(self, aln):
rsr = self.restraints
for ids in (('OD1:98:A', 'O6A:131:A'),
('N:65:A', 'O7B:132:A'),
('OD2:73:A', 'O1C:133:A')):
atoms = [self.atoms[i] for i in ids]
rsr.add(forms.upper_bound(group=physical.upper_distance,
feature=features.distance(*atoms), mean=3.5, stdev=0.1))
env = environ()
env.io.hetatm = True
a = mymodel(env, alnfile='test1.ali', knowns=('1lmp'), sequence='seq')
a.starting_model = 1
a.ending_model = 5
a.make()
В скрипте отредактировали строчки, в которых указаны, какие водородные связи белка с лигандом должны быть В БУДУЩЕЙ МОДЕЛИ.
Номера остатков и имена нужных атомов были определены по выравниванию и по тому, какие водородные связи имеются в образце.
Критерий водородной связи: расстояние менее 3.5 ангстрем между азотом или кислородом белка с подходящими атомами лиганда.
Были найдены водородные связи в белке-образце. И по выравниванию определены остатки, которым они соответствуют в моем белке.
Также было изменено имя файла, содержащего выравнивание.
В итоге получили управляющий скрипт: lysc_lepwe.py.
Запустили исполнение скрипта командой:
mod9v7 lysc_lepwe.py &
В итоге получили, следующие модели:
При визуальным моделей, оказалось, что выглядят они практически одинаково. Поэтому для выяснения того, какая модель является лучшей, требуется более детальный анализ.
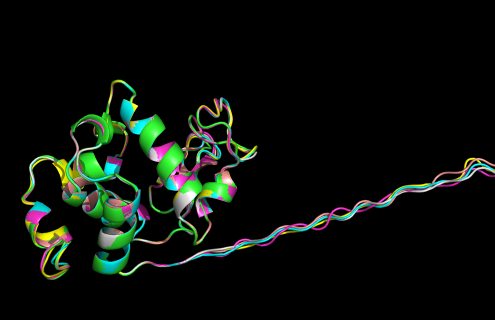
Теперь нужно проверить качество моделей и выбрать лучшую.
Инструменты для оценки качества структуры можно найти в веб интерфейсе WHATIF. Достаточно 2-3 инструментов. На этом сервере можно выбрать Build/check/repair model, потом перейти к Protein Model Check и загрузить поочередно наши модели.
В итоге получили следующие результаты:
-
==============
Structure Z-scores, positive is better than average:
1st generation packing quality : -2.706
2nd generation packing quality : -2.888
Ramachandran plot appearance : -0.562
chi-1/chi-2 rotamer normality : -1.261
Backbone conformation : -1.239
RMS Z-scores, should be close to 1.0:
Bond lengths : 0.922
Bond angles : 1.358
Omega angle restraints : 0.812
Side chain planarity : 0.486 (tight)
Improper dihedral distribution : 1.219
B-factor distribution : 0.341
Inside/Outside distribution : 1.065
==============
-
==============
Structure Z-scores, positive is better than average:
1st generation packing quality : -2.630
2nd generation packing quality : -2.931
Ramachandran plot appearance : 0.192
chi-1/chi-2 rotamer normality : -2.446
Backbone conformation : -0.991
RMS Z-scores, should be close to 1.0:
Bond lengths : 0.926
Bond angles : 1.318
Omega angle restraints : 0.768
Side chain planarity : 0.272 (tight)
Improper dihedral distribution : 1.241
B-factor distribution : 0.338
Inside/Outside distribution : 1.035
==============
-
==============
Structure Z-scores, positive is better than average:
1st generation packing quality : -2.773
2nd generation packing quality : -3.174 (poor)
Ramachandran plot appearance : -1.088
chi-1/chi-2 rotamer normality : -1.532
Backbone conformation : -1.636
RMS Z-scores, should be close to 1.0:
Bond lengths : 0.933
Bond angles : 1.365
Omega angle restraints : 0.818
Side chain planarity : 0.553 (tight)
Improper dihedral distribution : 1.111
B-factor distribution : 0.337
Inside/Outside distribution : 1.043
==============
-
==============
Structure Z-scores, positive is better than average:
1st generation packing quality : -2.669
2nd generation packing quality : -3.136 (poor)
Ramachandran plot appearance : -0.416
chi-1/chi-2 rotamer normality : -2.440
Backbone conformation : -0.839
RMS Z-scores, should be close to 1.0:
Bond lengths : 0.926
Bond angles : 1.319
Omega angle restraints : 0.779
Side chain planarity : 0.354 (tight)
Improper dihedral distribution : 1.179
B-factor distribution : 0.350
Inside/Outside distribution : 1.037
==============
-
==============
Structure Z-scores, positive is better than average:
1st generation packing quality : -2.693
2nd generation packing quality : -2.619
Ramachandran plot appearance : -0.507
chi-1/chi-2 rotamer normality : -2.178
Backbone conformation : -1.293
RMS Z-scores, should be close to 1.0:
Bond lengths : 0.933
Bond angles : 1.297
Omega angle restraints : 0.820
Side chain planarity : 0.494 (tight)
Improper dihedral distribution : 1.133
B-factor distribution : 0.313
Inside/Outside distribution : 1.061
==============
Будем сравнивать параметры Ramachandran plot appearance (карта Рамачандрана), Bond lengths (длины связей) и Bond angles (углы связей).
По первому параметры лучший результат показала 2 модель. По второму и третьему лучший результат показала 5 модель, хотя значения не так уж сильно отличаются.
Если выровнять последовательно попарно каждую модель с исходным белком-образцом, то получим следующие RMS:
- RMS = 0.187 (644 to 644 atoms)
- RMS = 0.173 (652 to 652 atoms)
- RMS = 0.194 (665 to 665 atoms)
- RMS = 0.183 (664 to 664 atoms)
- RMS = 0.182 (675 to 675 atoms)
Получили, что наилучшие значения RMS соответствуют 2 и 5 моделям.
Для выявления лучшей структуры сравним модели 2 и 5, используя параметр Fine Packing Quality Control из Structure validation, оказалось что
2 модель имеет z-score=-2.93, а 5 имеет z-score=-2.62. Это говорит о том, что 5 модель все же является лучше, чем 2 модель.
|
