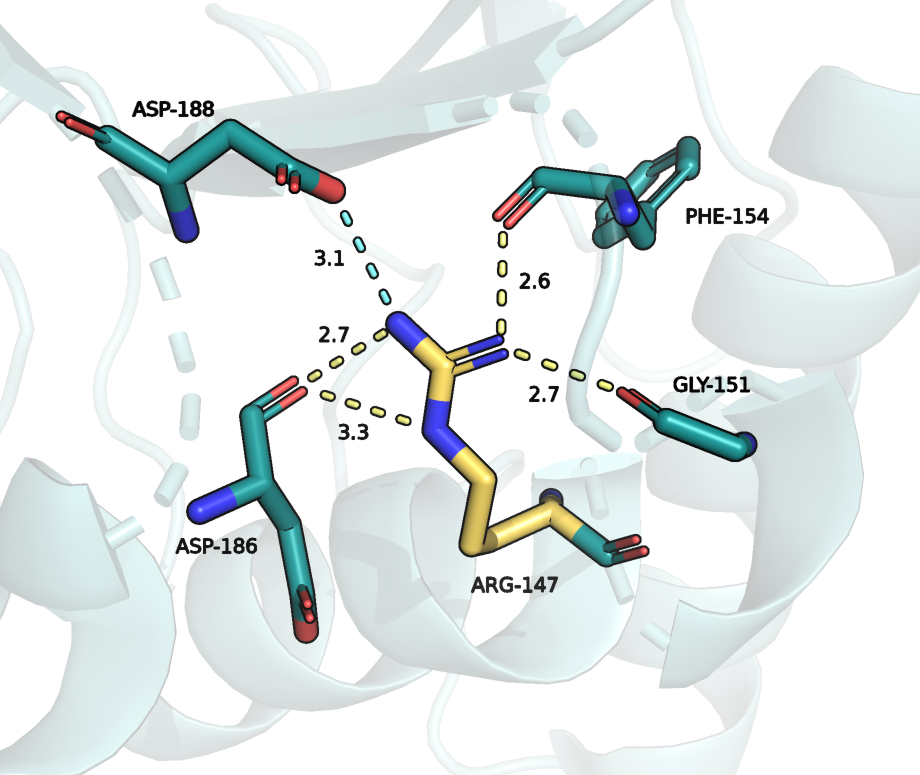
Атомы, выделенные синим - азот, красным - кислород.
Связи выделенные желтым - водородные, голубым - солевой мостик.
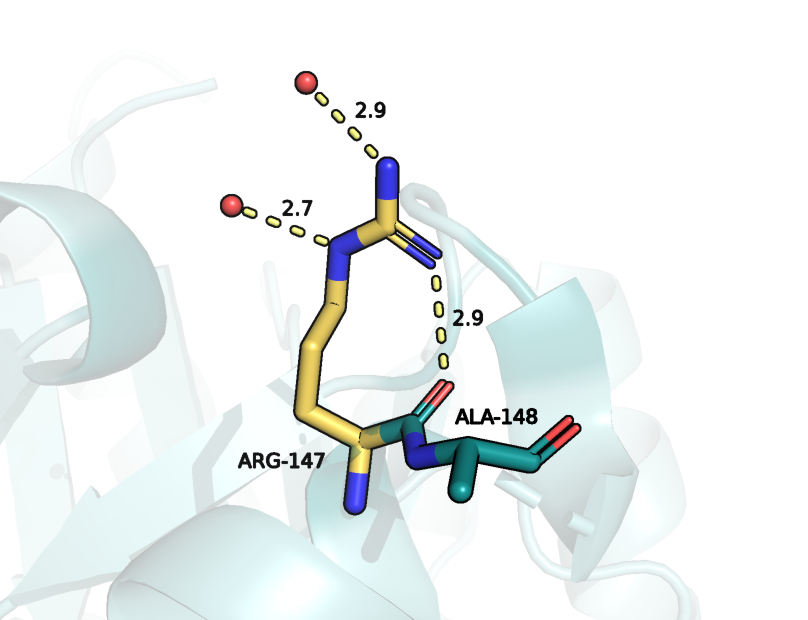
Атомы, выделенные синим - азот, красным - кислород.
Красные сферы - кислород из HOH.
Для работы нам был дан PDB ID (4AC1) и остаток Arg147,
у которого существуют альтернативные конформации (альтлоки).
Нам нужно было посмотреть, какие взаимодействия стабилизируют эти конформации.
|
Альтлок A: 1. Водородная связь с ASP-186. Длина - 3.3 ангстрем, желтая окраска. 2. Водородная связь с ASP-186. Длина - 2.7 ангстрем, желтая окраска. 3. Солевой мостик с ASP-188. Длина - 3.1 ангстрем, голубая окраска. 4. Водородная связь с PHE-154. Длина - 2.6 ангстрем, желтая окраска. 5. Водородная связь с GLY-151. Длина - 2.7 ангстрем, желтая окраска. |
Альтлок B: 1. Водородная связь с ALA-148. Длина - 2.9 ангстрем, желтая окраска. 2. Водородная связь с HOH (на рисунке представлен только кислород). Длина - 2.9 ангстрем, желтая окраска. 3. Водородная связь с HOH (на рисунке представлен только кислород). Длина - 2.7 ангстрем, желтая окраска. |

Атомы, выделенные синим - азот, красным - кислород. Связи выделенные желтым - водородные, голубым - солевой мостик. |

Атомы, выделенные синим - азот, красным - кислород. Красные сферы - кислород из HOH. |
На мой взгляд, стабильнее выглядит альтлок A, так как у него больше водородных связей,
чем у альтлока B, а также имеется солевой мостик.
Однако, по данным с сайта RCSB, occupancy обоих альтлоков составляет 0.5.
Я считаю, что это не так и конформация A должна иметь большую населенность.
(Данные с сайта RCSB мне показались довольно странным, так как просмотрев весь
текстовый формат PDB я не нашла ни одного другого альтлока со значениями отличными от 0.5 или 1).
Для данного задания мы использовали тот же PDB ID, что и в первом задании.
Здесь нам нужно было поработать с B-фактором.
"Размытие" ЭП от атома является следствием неопределенности в его точном положении,
и для оценки такого "размытия" нужен B-фактор.
Т.е. мы можем примерно, с некоторой точностью указать на одно положение, в отличие от альтлоков.
Такая неопределенность может быть следствием термической подвижности нашей структуры.
По сути, B-фактор выше в тех областях, которые более подвижны и отдалены от центра молекулы.
Что мы и видим на рисунке 3: отдаленные и более подвижные участки красные (высокий B-фактор),
а ближе к центру белка преобладает синяя окраска (низкий B-фактор).
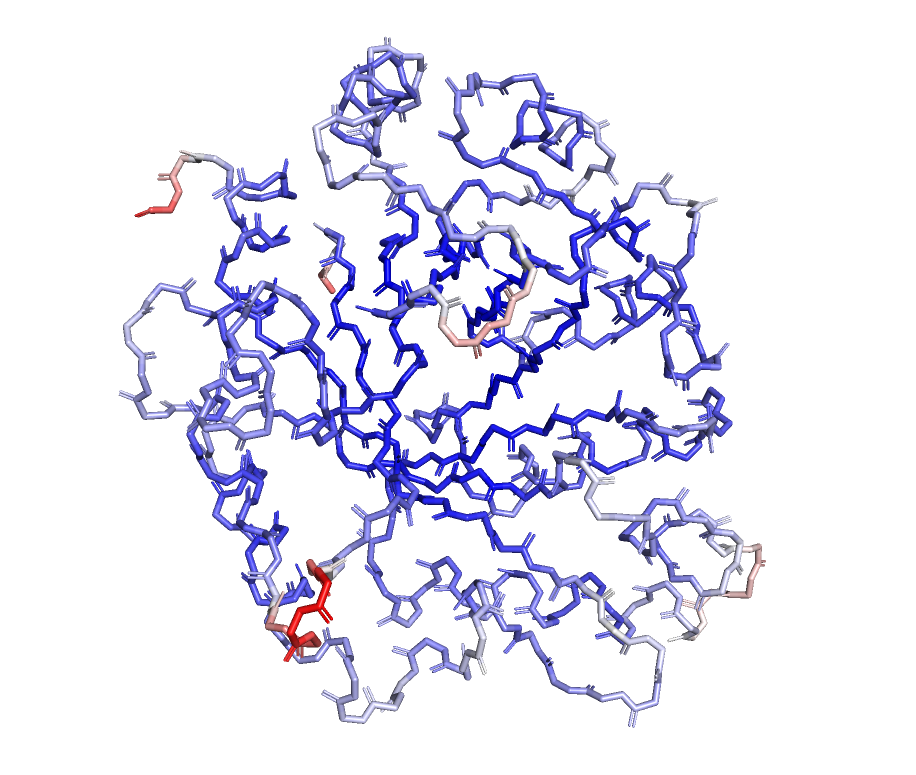
атомы с высоким B-фактором окрашены в красный, с низким - в синий.
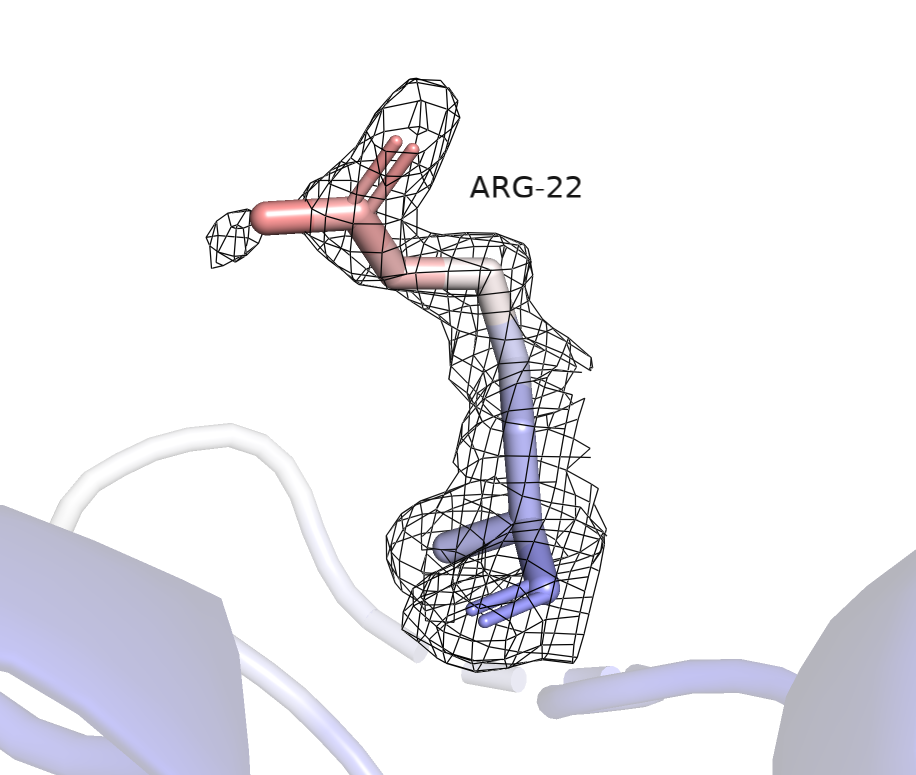
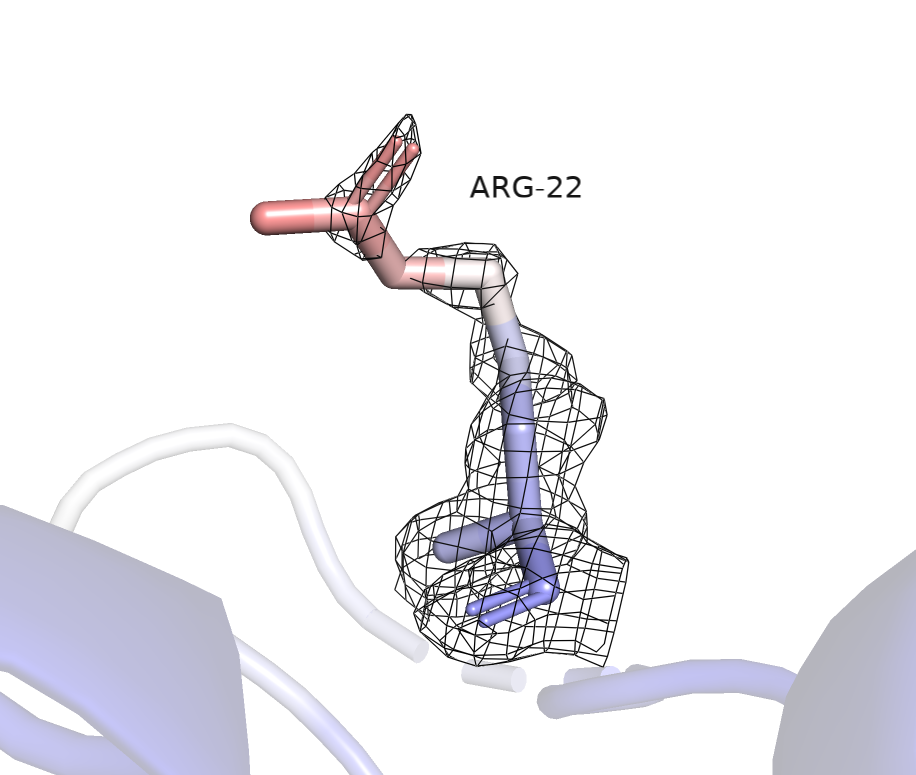
Далее был выбран остаток (ARG-22) с высоким B-фактором.
Его более красная окраска к концу говорит о том, что атомы бокового радикала довольно подвижны.
Также для ARG-22 была визуализирована ЭП на разных уровнях подрезки (0.5, 1, 2, 3).
На уровне подрезки 0.5 ЭП охватывает практически весь остаток (рисунок 4).
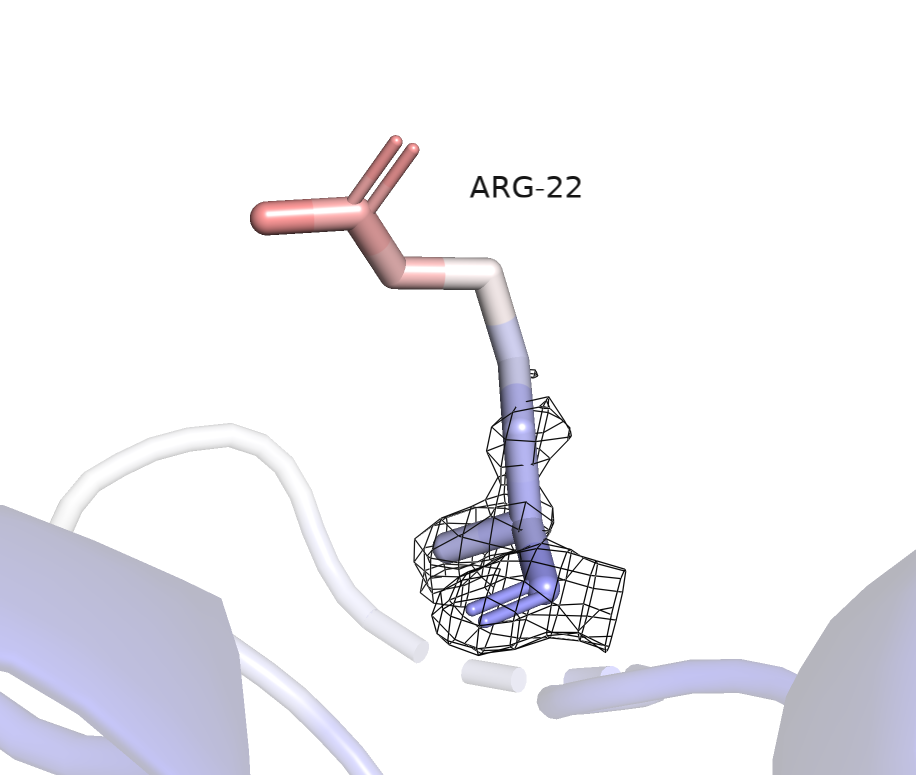
На уровне подрезки 1 ЭП частично исчезает с участка с высоким B-фактором (рисунок 5).
На уровне подрезки 2 ЭП полностью исчезает с участка с высоким B-фактором (рисунок 6).
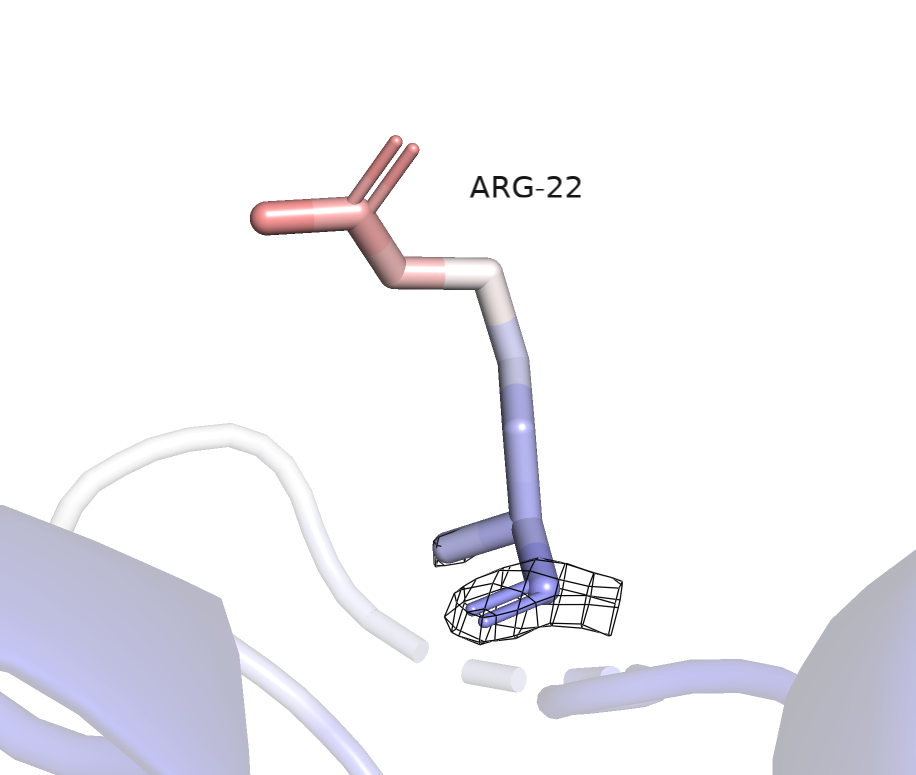
На уровне подрезки 3 ЭП остается только на участке с наиболее низким B-фактором (рисунок 7).
|
|
|
|
В этом задании нам нужно было восстановить кристалл, так как наш белок (PDB ID
4AC1) является его частью.
На рисунках 5 и 6 хорошо видно восстановленную структуру.
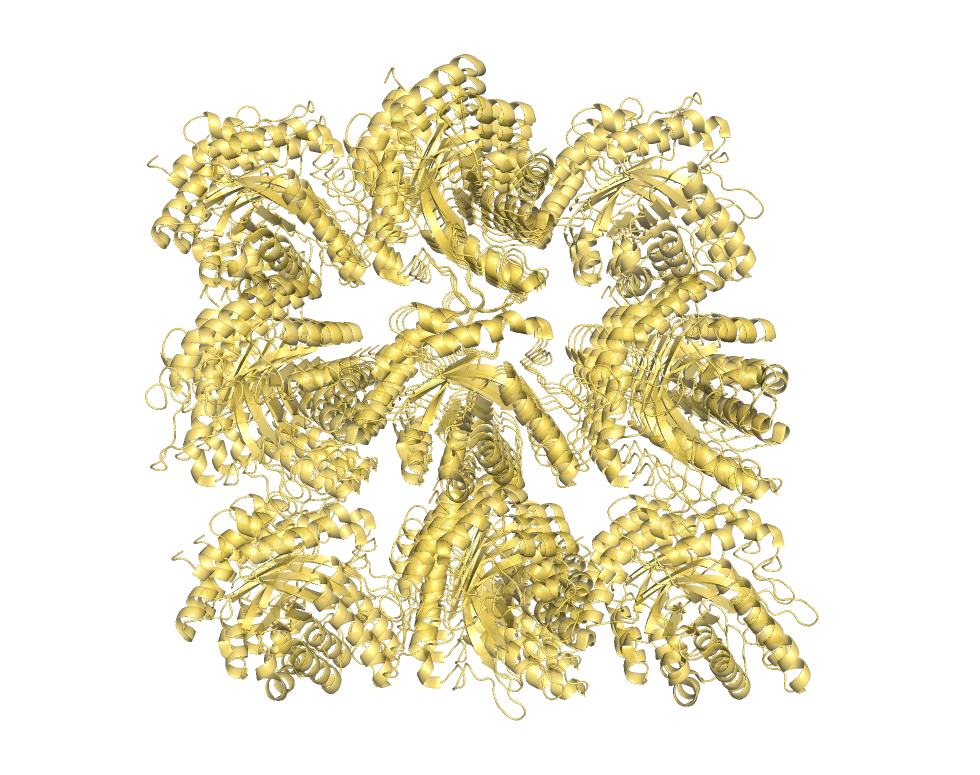
структура (отсечка 20 А). |

структура (отсечка 50 А). |
Далее были выбраны 6 соседей нашего белка, с которыми он взаимодействует.
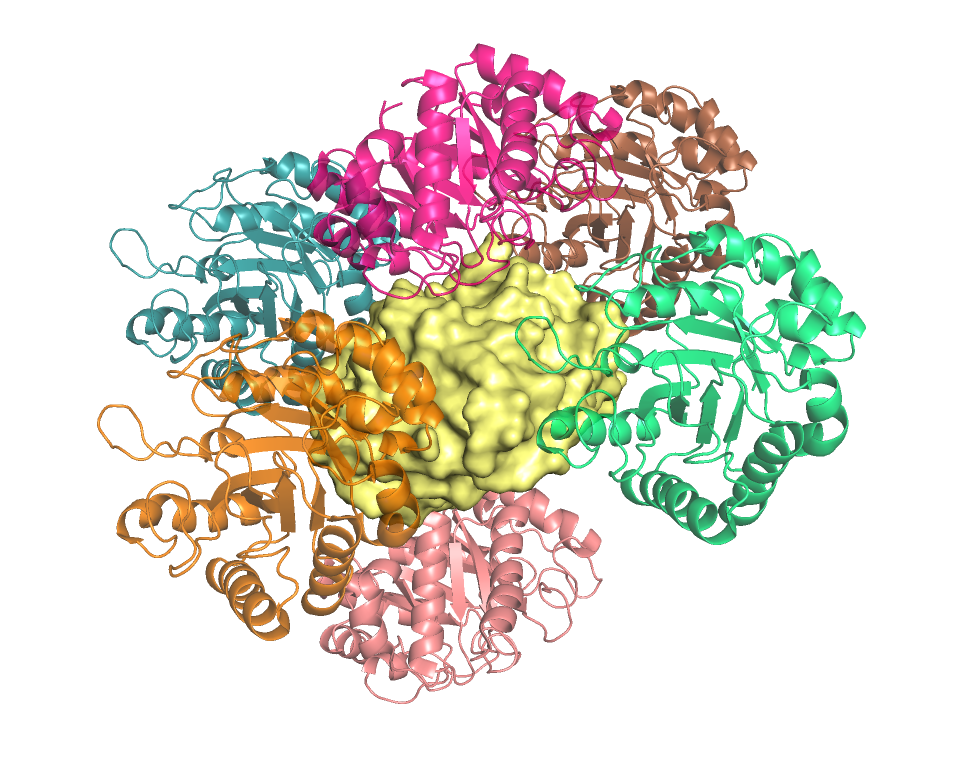
Желтым цветом показан изначальный белок.
Для данного белка и его соседей мы получили 3 уникальные зоны контакта.
Поэтому далее были рассмотрены взаимодействия в этих зонах.
С первым соседом (зеленым) взаимодействие может происходить
за счет образования водяного мостика между PRO-23 и HIS-109 (рисунок 1).
Длины связей между ними 2.7 и 2.8 ангстрем.
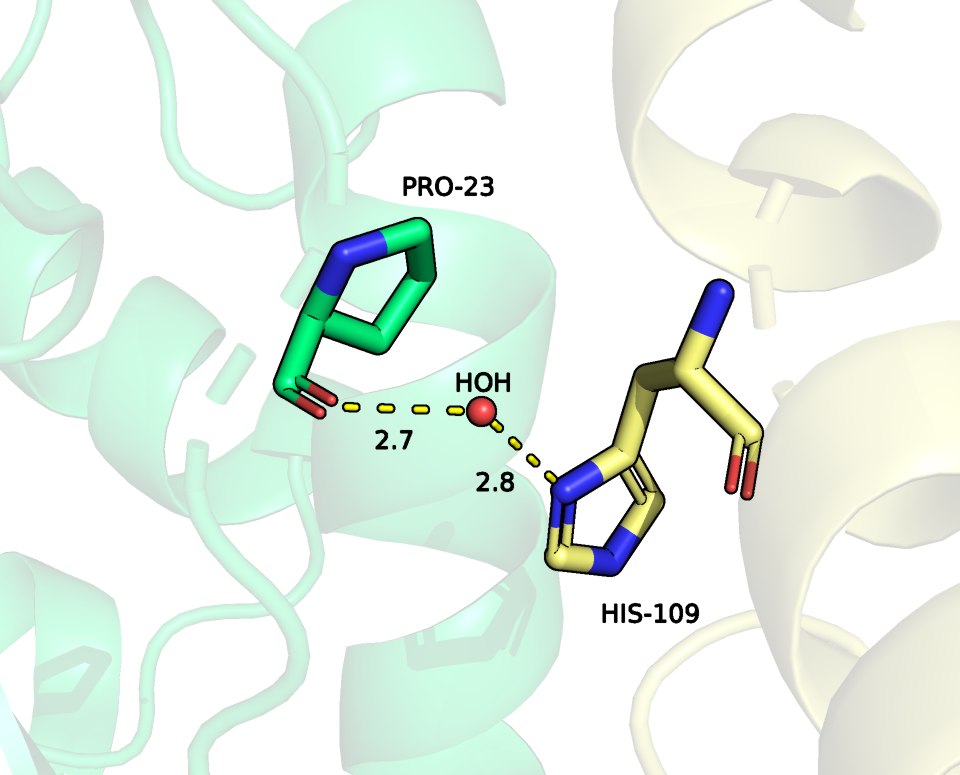
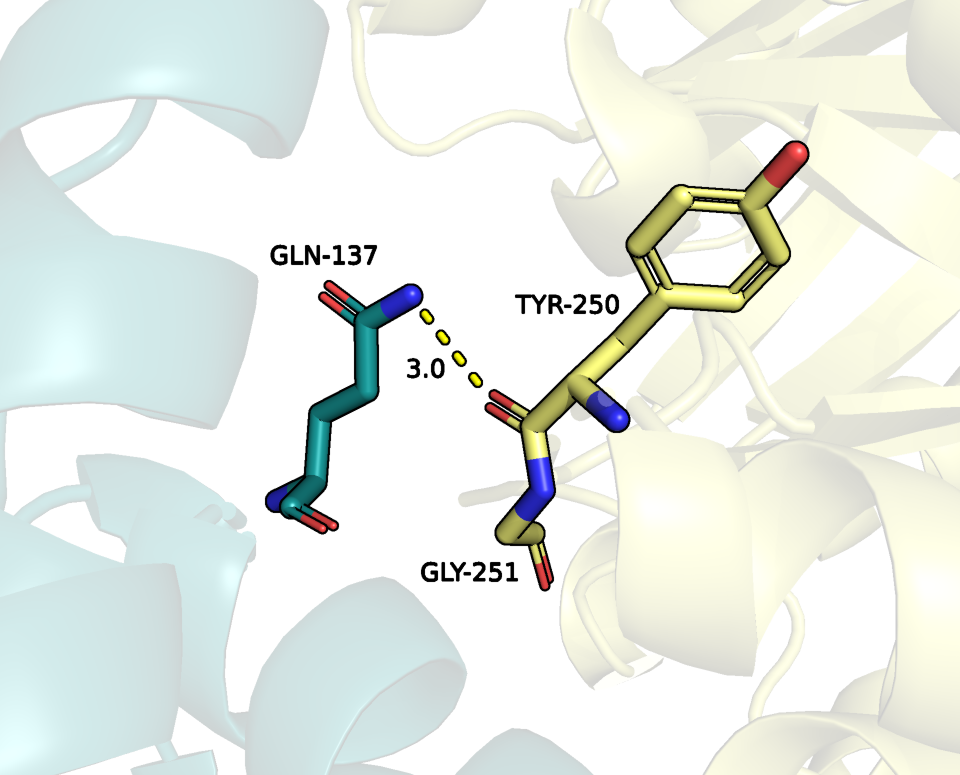
Со вторым (синим) соседом наш белок взаимодействует за счет водородных связей:
между GLN-137 и TYR-250 длиной 3 ангстрема (рисунок 12);
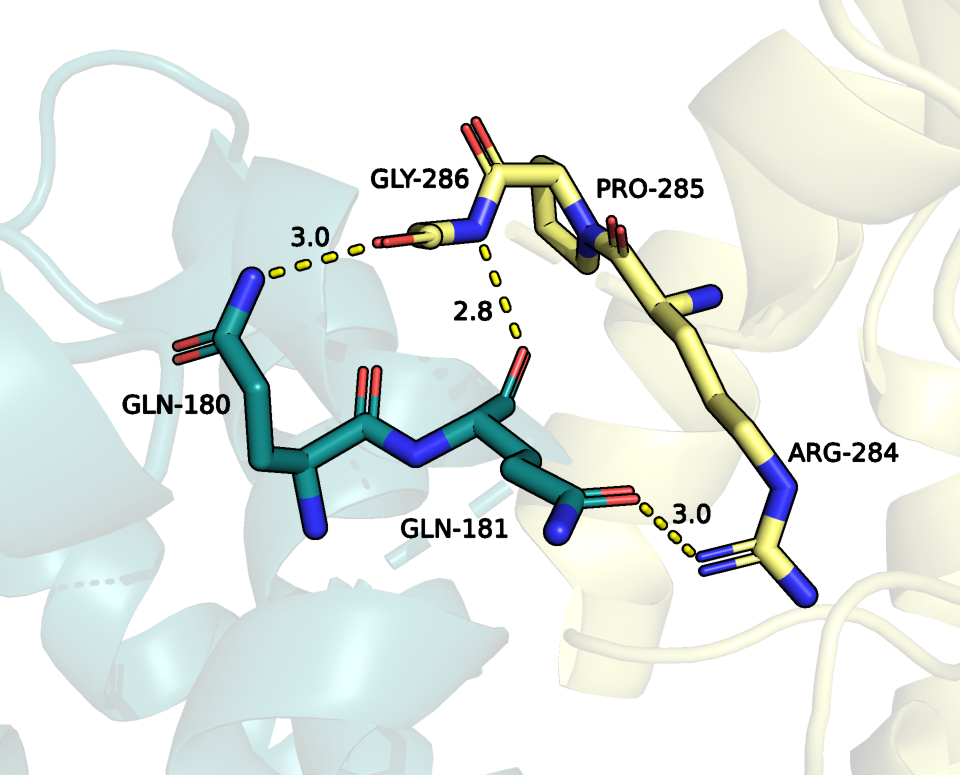
между GLN-180 и GLY-286 длиной 3 ангстрема (рисунок 13);
между GLN-181 и GLY-286 длиной 2.8 ангстрем (рисунок 13);
между GLN-181 и ARG-284 длиной 3 ангстрема (рисунок 13);
|
|
С третьим же (красным) соседом образуется больше всего взаимодействий:
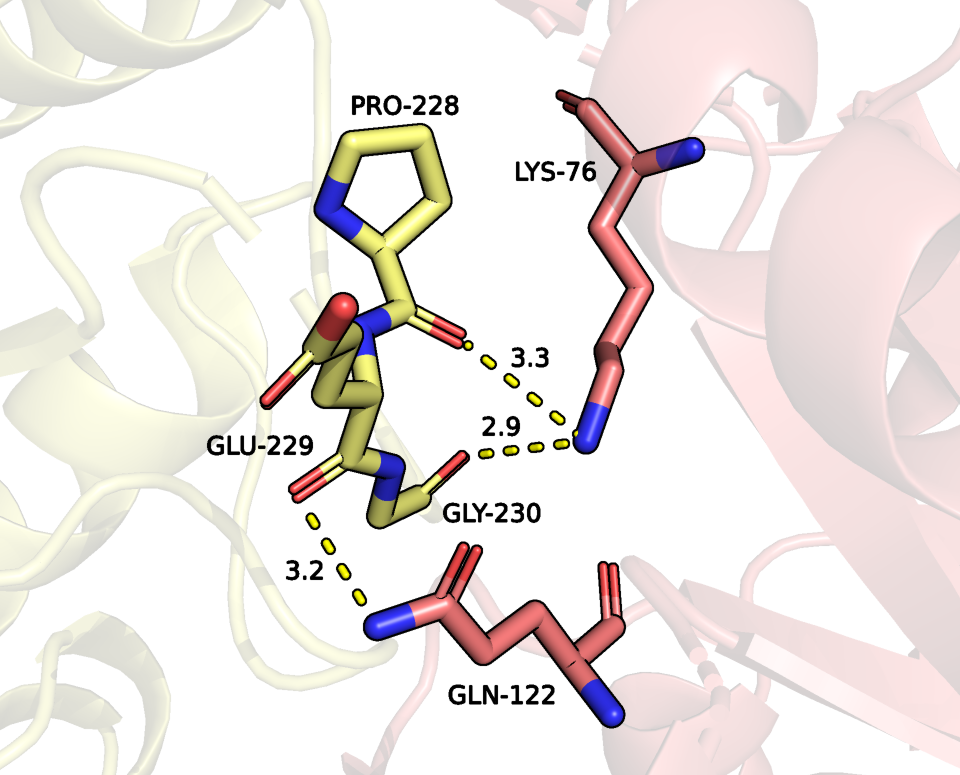
между PRO-228 и LYS-76 длиной 3.3 ангстрема (рисунок 14);
между GLY-230 и LYS-76 длиной 2.9 ангстрем (рисунок 14);
между GLU-229 и GLN-122 длиной 3.2 ангстрема (рисунок 14);
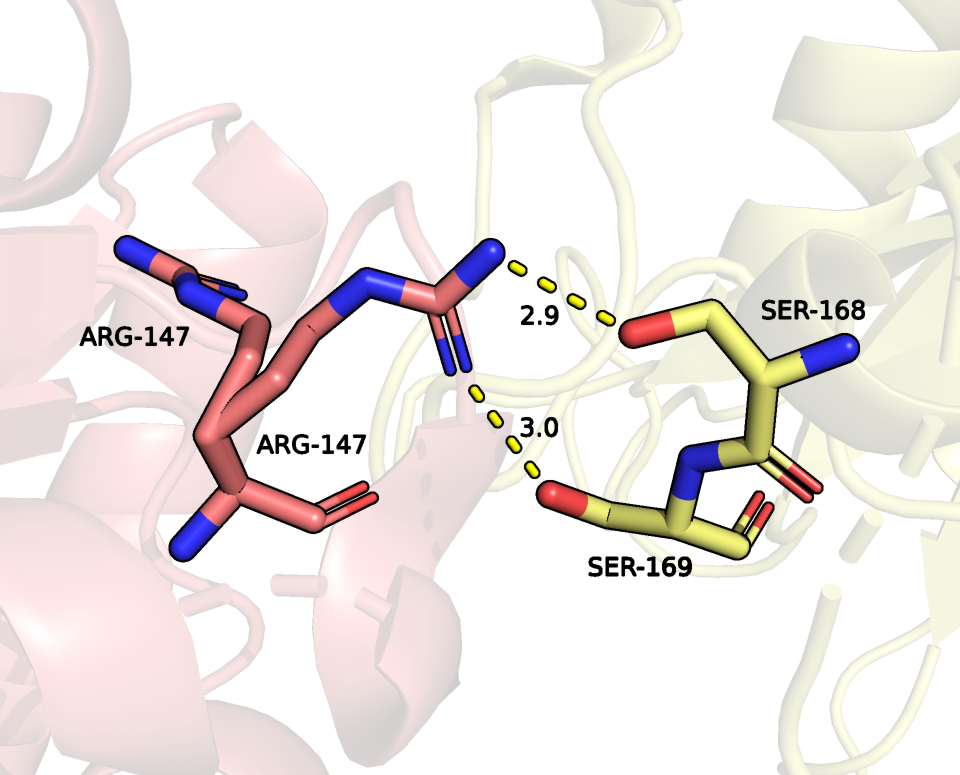
между альтлоком B ARG-147 (из 1 задания) и SER-168 длиной 2.9 ангстрем (рисунок 15);
между альтлоком B ARG-147 (из 1 задания) и SER-169 длиной 3 ангстрема (рисунок 15);
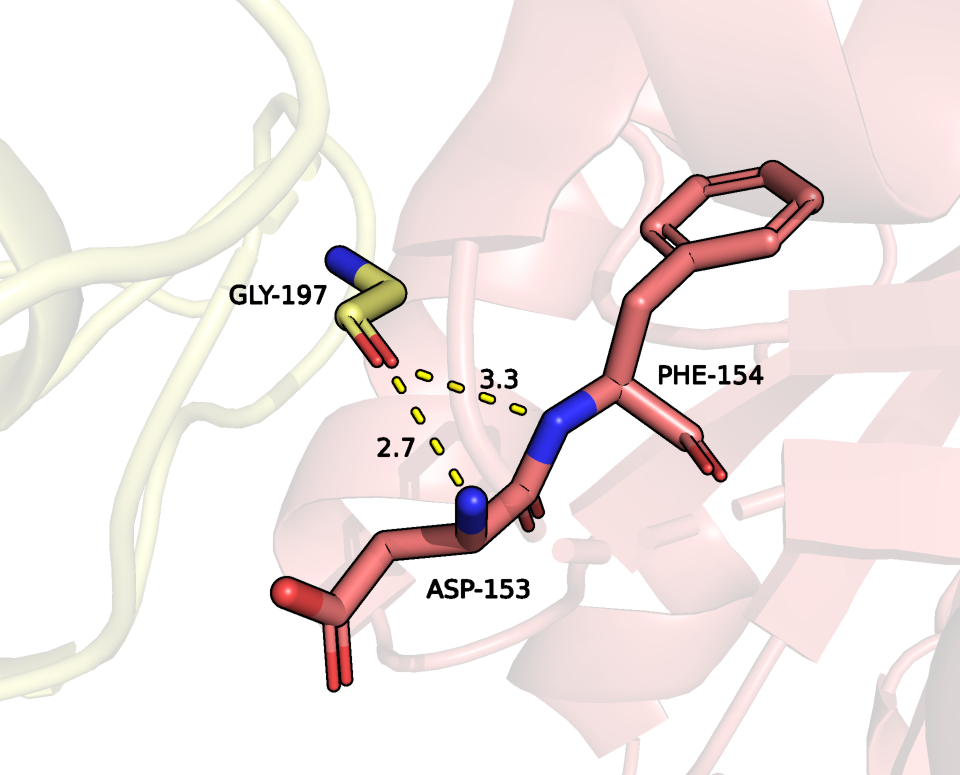
между GLY-197 и PHE-154 длиной 3.3 ангстрема (рисунок 16);
между GLY-197 и ASP-153 длиной 2.7 ангстрем (рисунок 16);
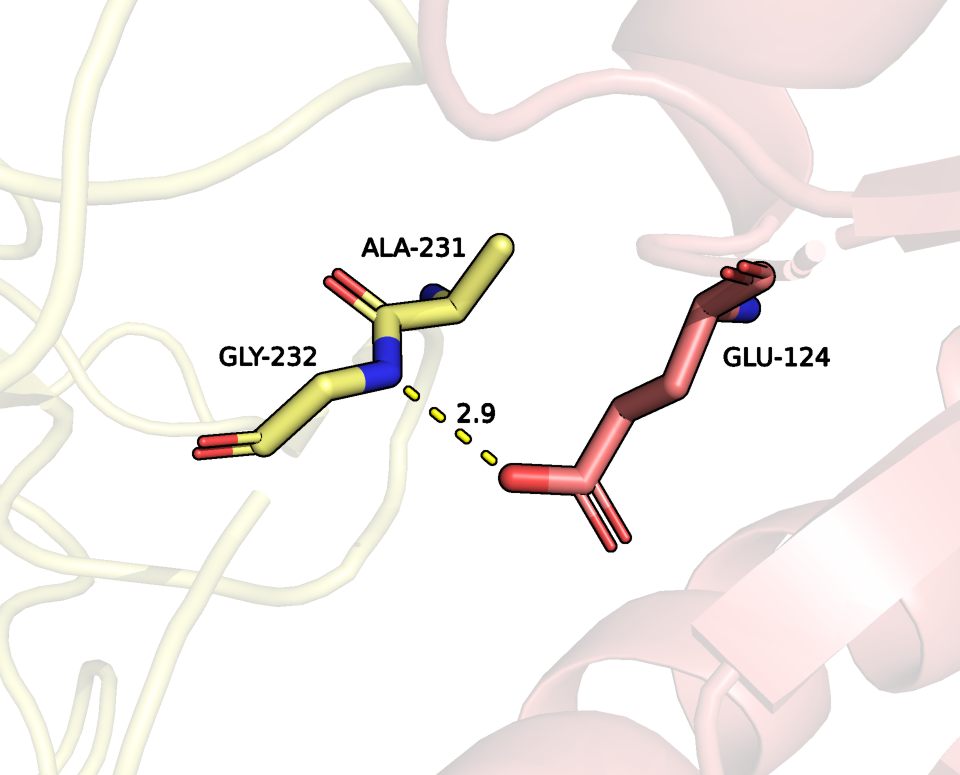
между GLY-232 и GLU-124 длиной 2.9 ангстрем (рисунок 17);
|
|
|
|
И, поводя итоги, я думаю, что данные контакты не отражают реальные природные взаимодействия, так как
условия существования в клетке отличаются от кристаллических условий (различные буферы и др.).
© Наумова Юлия, 2020