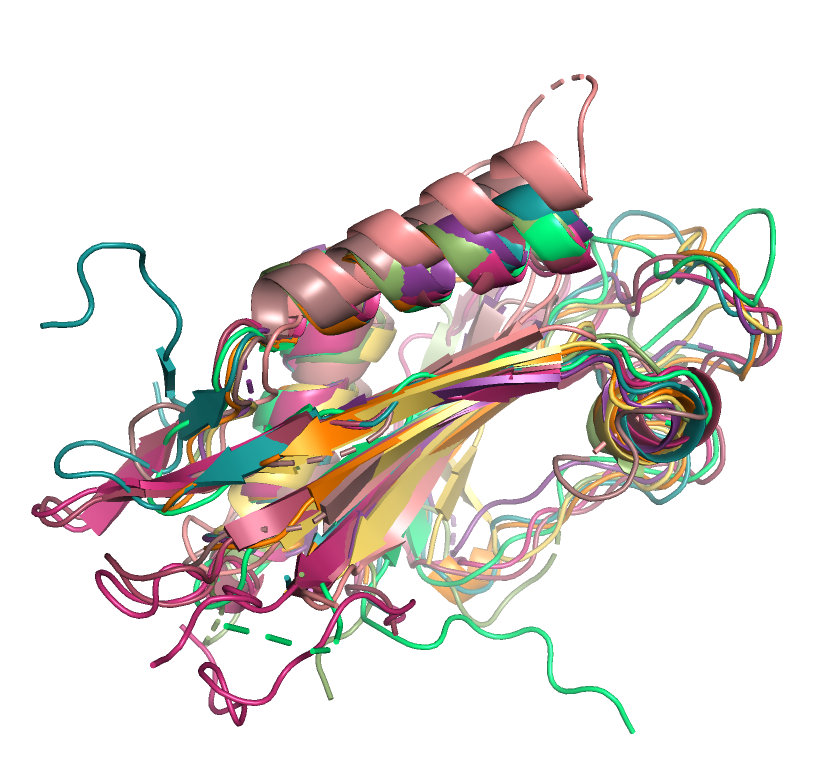
В этом задании для работы нам были даны 10 записей PDB, которые демонстровали
не более 40% попарного сходства. Данные записи были выровнены по 1a3gA01 (рисунок 1).

В целом, структуры накладываются довольно хорошо. Кардинальных отличий я не заметила.
Однако при совмещении альфа спирали структур 3cebA01 и 3qqmA01 немного смещены относительно
других (рисунок 2). Также нужно заметить, что в некоторых местах (например рисунок 3) у нескольких
структур показаны бета-тяжи, тогда как у остальных структур их нет.
Еще можно отметить, что у у всех структур петли в основном расположены по-разному.
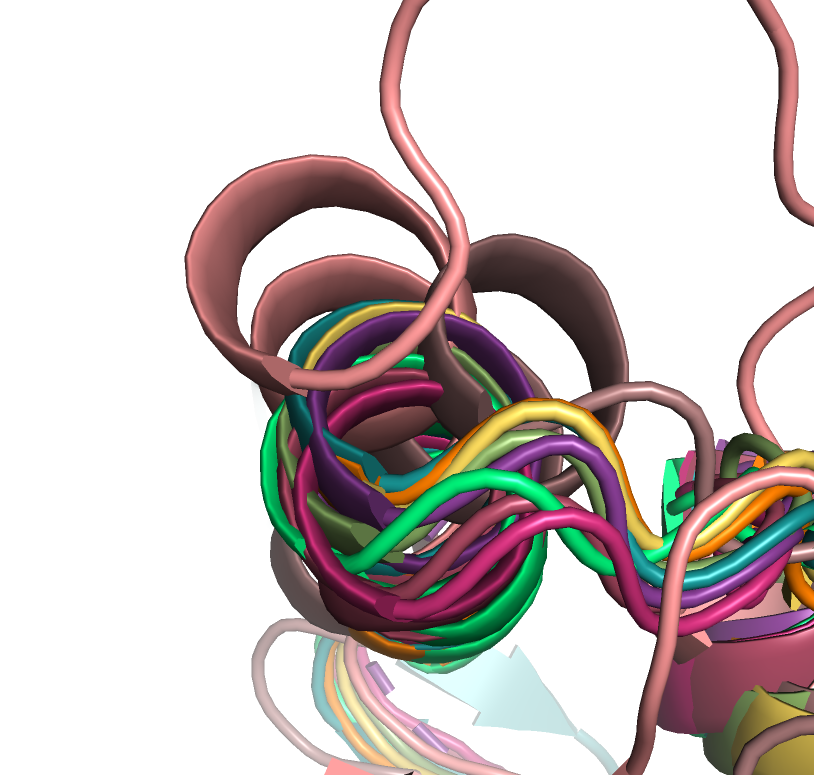
salmon) и 3qqmA01 (окраска darksalmon). |

raspberry), 4dqnA01 (окраска warmpink) и отличающихся бета-тяжей у структуры 1a3gA01 (окраска deepteal). |
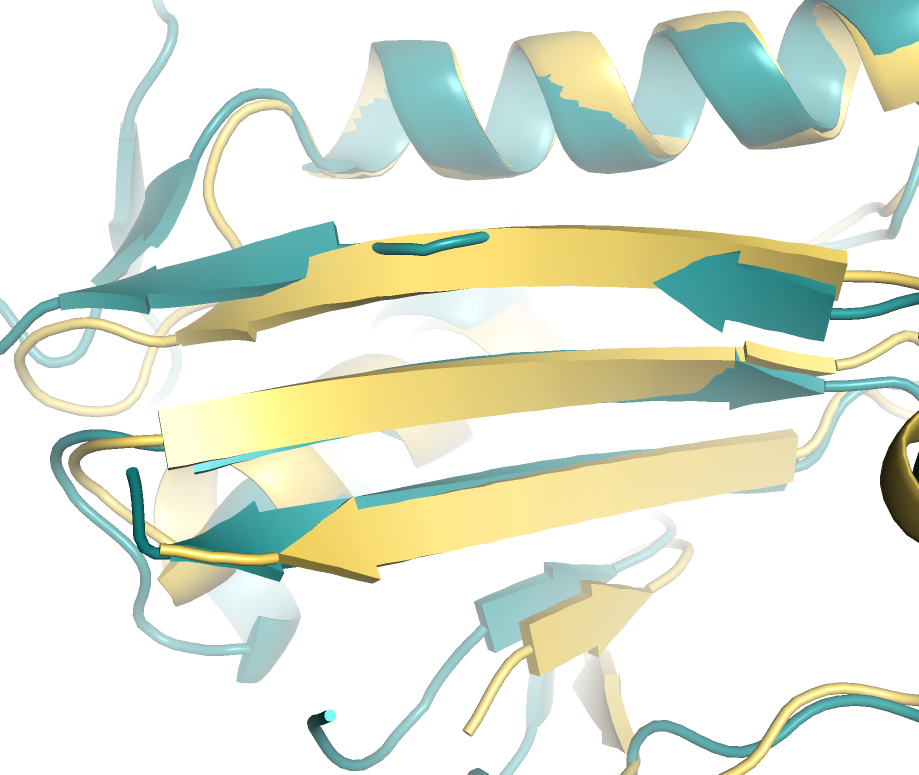
В данном задании мы сравнивали участок структуры двух белков.
Для сравнения были выбраны участки с бета-тяжами структур 1a3gA01, 1i2kA01 (рисунок 4).
В целом данные участки довольно схожи, однако в структуре 1a3gA01 у части верхнего
тяжа не приписана определенная вторичная структура.
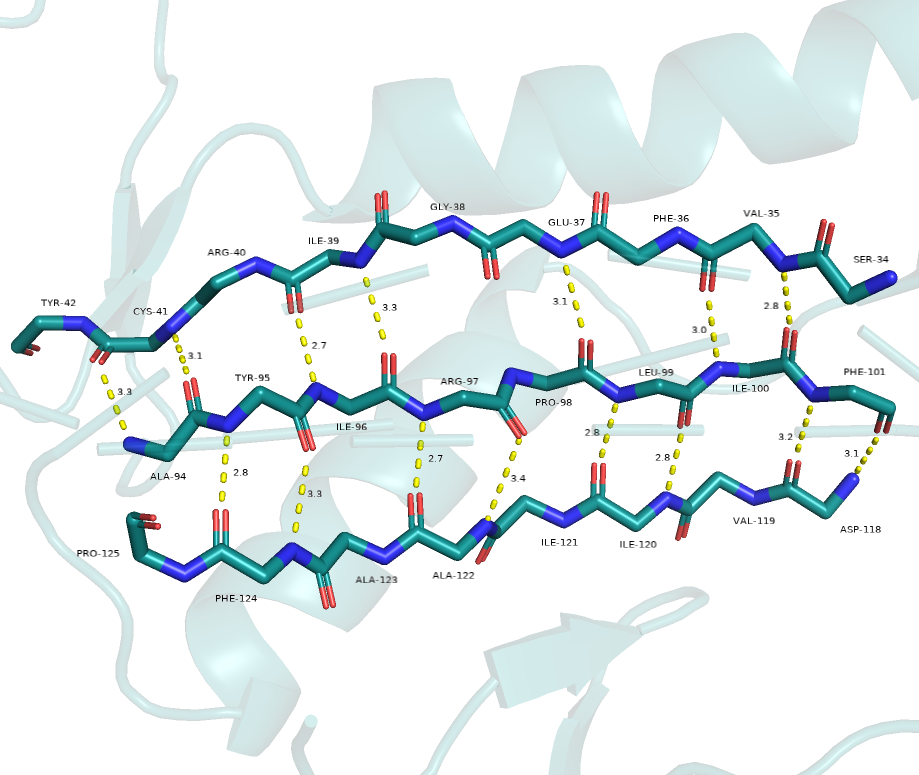
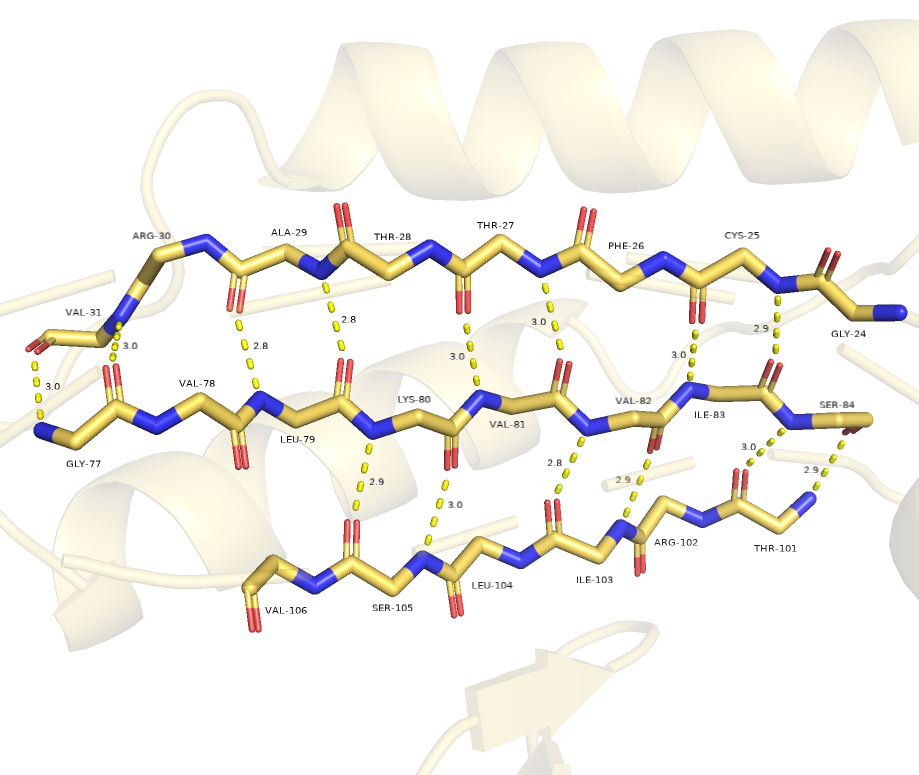
Рассмотрим вторичную структуру (рисунки 5, 6).
|
|
В целом, на мой взгляд у обеих структур разметка вплоне реалистичная.
Однако у структуры 1a3gA01 явно не хватает связи между кислородом GLY-38 и азотом ARG-97
(из-за углов и большого расстояния).
И это происходит как раз на участке без определенной вторичной структуры.
Также можно заметить, что у структуры 1i2kA01 (окраска paleyellow) нижний бета-тяж короче, чем у структуры
1a3gA01 (окраска deepteal).
Подводя итог могу сказать, что PyMOL справился со своей задачей и сделал верную разметку.
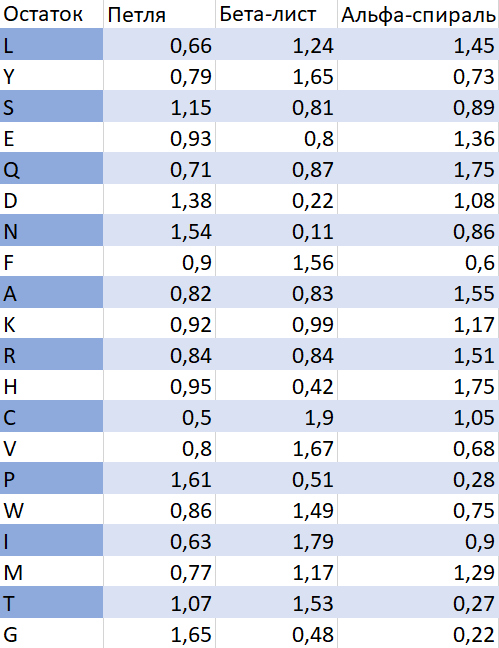
Здесь нам нужно было расчитать склонности каждого типа аминокислоты образовывать тот или
иной тип вторичной структуры (amino acid secondary structure propensity).
Для всех десяти последовательностей с помощью dssp была сгенерирована разметка вторичной структуры.
После обработки данных по формуле P_ik = (n_ik/n_i) / (N_k/N) были расчитаны склонности и записаны в таблицу:
иной тип вторичной структуры.
По нашим данным можно сказать, что:
Заметно чаще образует альфа-спирали глутамин и гистидин.
Заметно чаще образует бета-листы цистеин и изолейцин.
Заметно чаще образует петли глицин и пролин.
© Наумова Юлия, 2020