В данном задании нам был дан PDB файл с приблизительными координатами какого-то белка.
- Что это за белок? Как его уместнее всего назвать?
Судя по выдаче PDBeFold данная структура является моноклиническим свиным пепсином
(PDBe 4PEP),
он же пепсин А из класса гидролаз, семейство аспарагиновых пептидаз
(Brenda 3.4.23.1).

Далее рассматривалась наиболее подходящая под исходный белок структура 4pep.
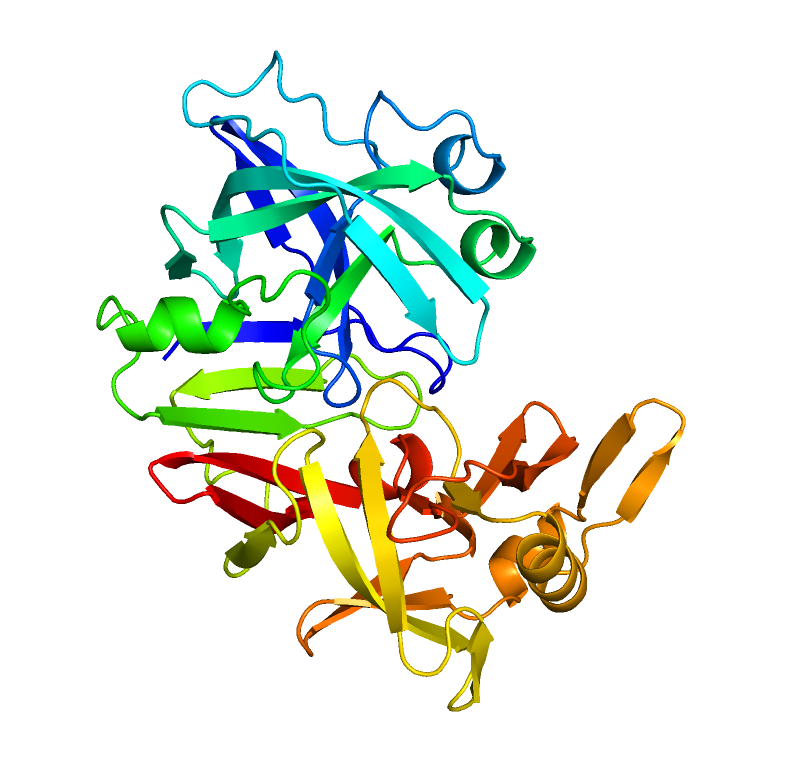
- Какую функцию он скорее всего выполняет?
Пепсин расщепляет белки на более мелкие пептиды и, соответственно, играет важную роль в процессе пищеварения.
Для определения вероятности расщепления наиболее важны остатки в положениях P1 и P1'.
Конкретно пепсин А расщепляет связи в B-цепи инсулина (1-Phe- | -Val-2, 4-Gln- | -His-5, 13-Glu- | -Ala-14,
14-Ala- | -Leu-15, 15-Leu- | -Tyr-16, 16-Tyr- | -Leu-17, 23-Gl90-y- | -Phe-24, 24-Phe- | -Phe-25 и 25-Phe- | -Tyr-26).
- Какие кофакторы (если есть) необходимы этому белку для функционирования?
- В каких местах они должны связываться?
В литературе данных про кофакторы найдено не было.
Однако, при рассмотрении структуры можно предположить, что белок может
с чем-либо связываться с помощью "кармана" (рисунок 3).
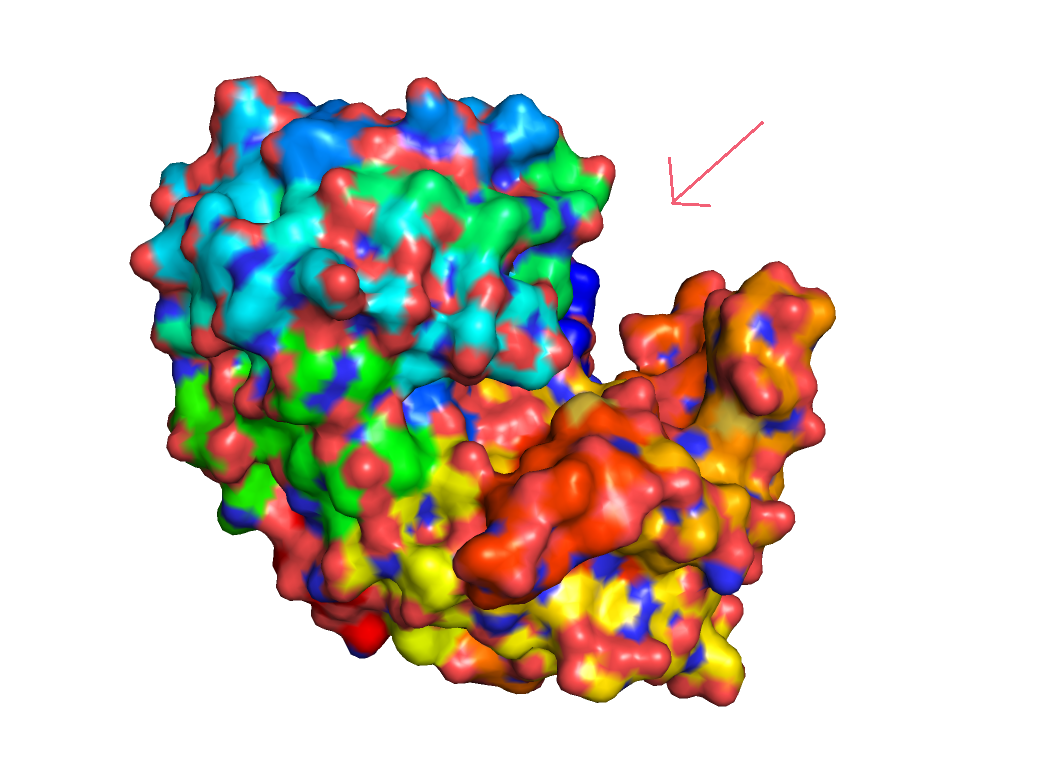
- Какой регион белка ответственен за предполагаемую функцию?
- Выделяются ли визуально в составе структуры отдельные домены? Можно ли сказать, что за
функцию отвечает только один из них, или что функциональный сайт расположен между доменами?
В целом, визуально домены выделить сложно, однако они есть.
С помощью CATH было выделено два домена
(4pepA01,
4pepA02),
которые представлены на рисунке 4.
Место этих доменов в иерархии CATH одинаковое и показано ниже.
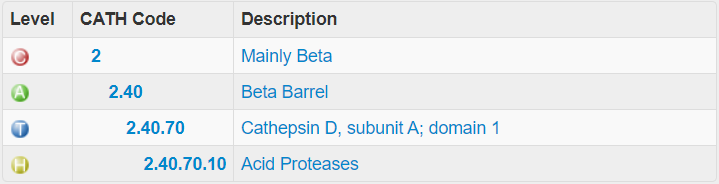
A - архитектура, T - топология, а H - гомологичное суперсемейство).
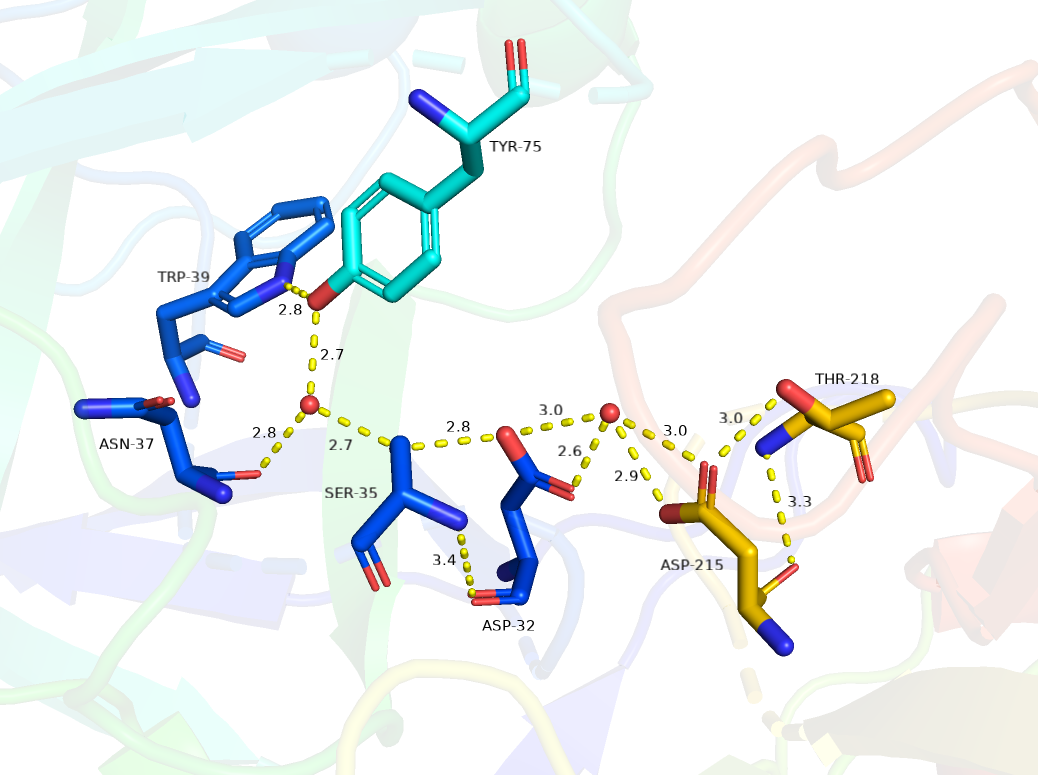
На стыке доменов формируется каталитический сайт пепсиноподобных ферментов
и содержит два остатка аспарагиновой кислоты, Asp32 и Asp215, по одному в каждом домене.
Важной частью активного центра является молекула воды, связанная между активными карбоксилами,
которая становится депротонированной при связывании субстрата, чтобы инициировать общий основной катализ.
Интересным и довольно полезным свойством каталитического центра является адаптация
к действию в диапазоне от pH 1,0 до pH 7,0.
Гидроксильные группы Ser35 и Thr218 находятся рядом с активными карбоксилами Asp32 и Asp215 соответственно.
В отличие от Thr218, гидроксил которого может образовывать только одну водородную связь с внешним
кислородом карбоксила Asp215, гидроксил Ser35 находится на расстоянии водородных связей
от внешнего кислорода карбоксила Asp32 и еще одной молекулу воды.
Вторая молекула воды сама связана водородной связью с карбонильным кислородом Asn37
и гидроксилом остатка Tyr75 закрывающегося активного центра, в то время как
гидроксил Tyr75 закреплен водородной связью с атомом Trp39.
Активные карбоксилы имеют дополнительные водородные связи, которые соединяют свои внутренние атомы кислорода
с группами NH остатков глицина, расположенными в сегментах Asp-Thr-Gly обеих активных петель.
В этом задании нам было нужно найти и выбрать белки, разделяющие с Query не более 35% идентичности
по последовательности. При выборе белков Lowest acceptable match (%) выставлялся на 40%.
Выбранные структуры:
- Бета-секретаза 1 / мемапсин 2 (PDB ID 5qd0).
С исходным белком было 26% идентичности по последовательности.
Как и пепсин А, бета-секретаза принадлежит к классу гидролаз и семейству аспарагиновых пептидаз.
Предполагается, что это основная «бета-секретаза», ответственная за расщепление
Glu-Val-Asn-Leu- | -Asp-Ala-Glu-Phe в варианте белка-предшественника бета-амилоида
с образованием амилоидогенного бета-пептида, который вовлечен в патологию болезни Альцгеймера.
Обладает широкой эндопептидазная специфичность.
Белок является гомодимером и иерархия CATH для доменов идентична иерархии для пепсина А.
- Ретропепсин ВИЧ-1 / протеаза ВИЧ-1 (PDB ID 3dox).
С исходным белком было 17% идентичности по последовательности.
И также как предыдущие белки принадлежит к принадлежит к классу гидролаз и семейству аспарагиновых пептидаз.
Присутствует в вирусе иммунодефицита человека 1 типа.
Способствует созреванию вирусной частицы и является мишенью противовирусных препаратов,
участвует в гидролизе пептидных связей.
Активный фермент представляет собой димер идентичных субъединиц массой 11 кДа.
Белок является гомодимером и иерархия CATH для доменов идентична иерархии для пепсина А.
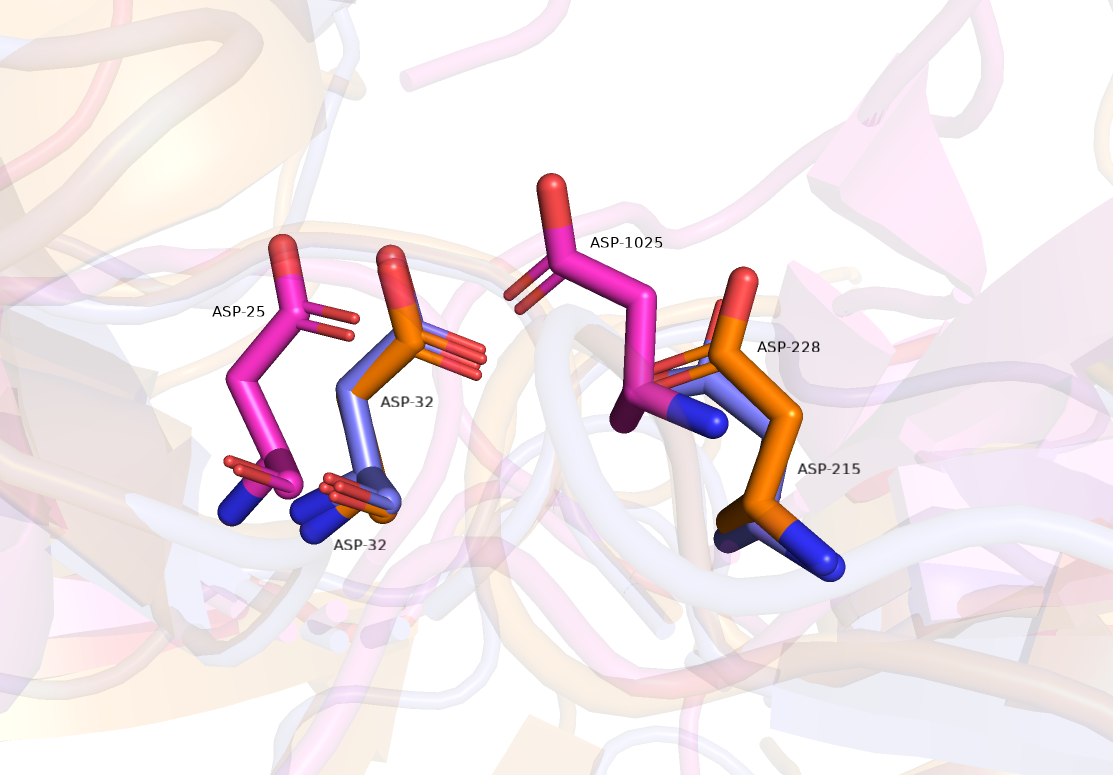
При сравнении выбранных нами белков был выделен мотив, присутствующий во всех структурах.
Этим мотивом являются два аспарагина, которые составляют основу каталитического центра всех аспарагиновых пептидаз.
И логично, что эти два остатка почти идеально совпали у всех рассматриваемых нами структур (рисунок 8).
Однако есть и различия в активных центрах наших структур.
Активный центр гомодимерной протеазы ВИЧ-1 включает шесть аминокислот
(триады AspThrGly в каждом мономере) в положениях АК от 25 до 27 и от 25' до 27'.
Роль Thr26, Thr26', Gly27 и Gly27' на данный момент не ясна. Предполагается,
что сильные силы водородной связи между остатками Thr26 и Thr26' стабилизируют конформационное
состояние активного центра, и что функция Gly27 и Gly27' заключается в размещении и связывании субстрата в положении,
в котором каталитические Asp25 и карбоксилатные группы Asp25' могут атаковать амидный фрагмент субстрата.
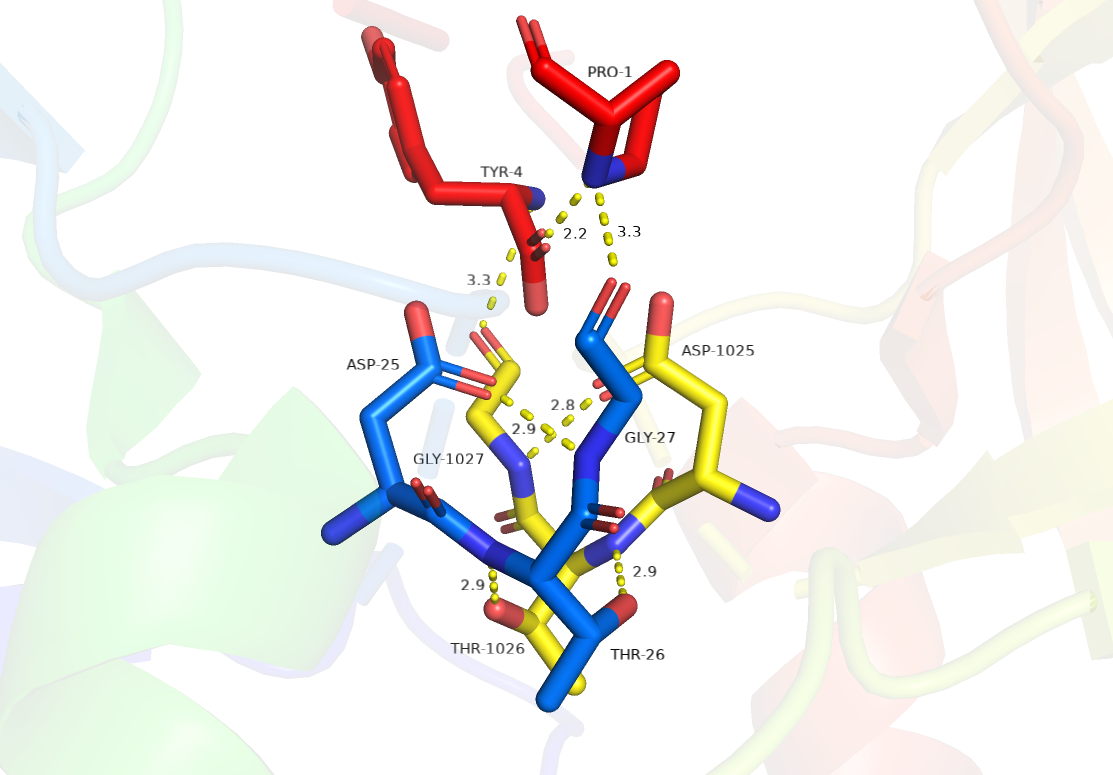
Красным обозначена часть субстрата структуры 3dox.
У бета-секретазы активный сайт также состоит из двух остатков аспартата: Asp32 и Asp228.
Группы R обоих остатков координируют одну молекулу воды между двумя из них,
что позволяет нуклеофильной атаке происходить на карбонилы.
Однако есть две другие важные особенности: петля бета-шпильки и петля 10s.
Петля бета-шпильки («flap») находится над активным участком и состоит из остатков с 67 по 77.
Пока активный сайт остается неактивным, flap остается в своей открытой конформации.
Однако створка стабилизируется, когда она закрыта субстратом или каким-либо другим ингибитором.
Петля 10s состоит из остатков с 9 по 14 и расположена в кармане S3 бета-секретазы, прямо между двумя бета-нитями.
Когда петля 10s принимает открытую конформацию, она обеспечивает большее связывание между субстратом и карманом S3.
Петля 10s также содержит внутри себя Gly-11, с которым субстрат может образовывать водородную связь,
что обеспечивает дополнительную стабилизацию петли 10s, а также общее взаимодействие бета-секретаза - субстрат.
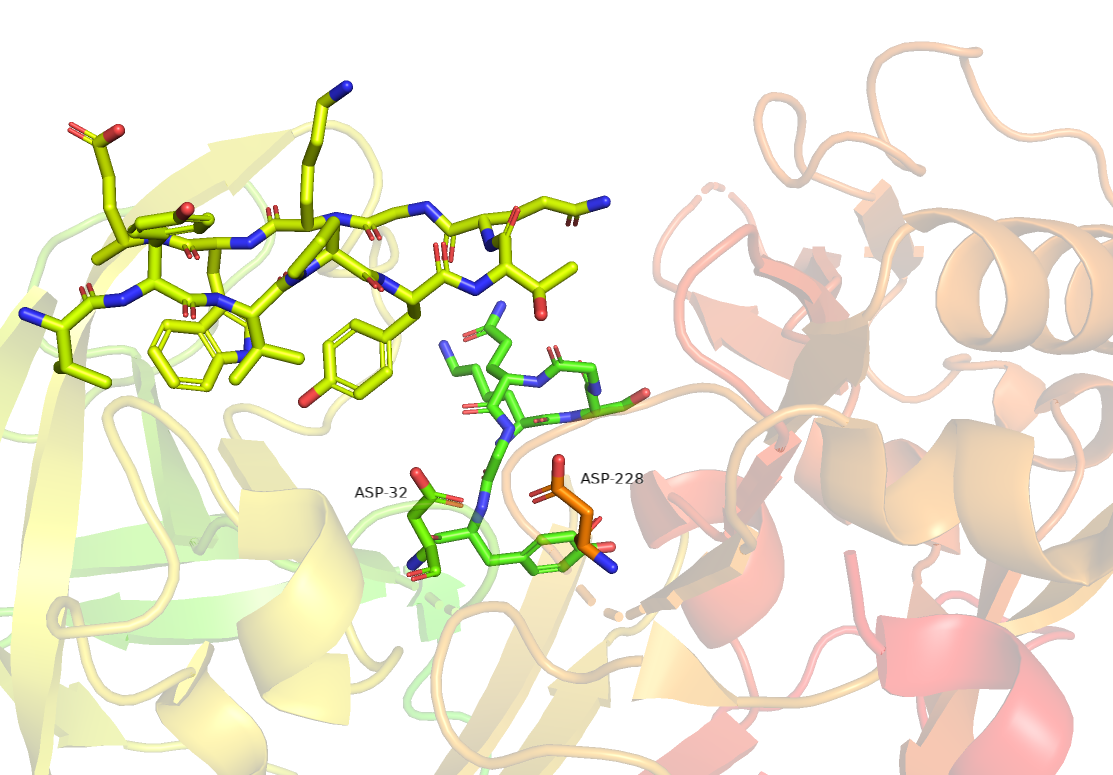
Желтым цветом показана петля бета-шпильки, зеленым - петля 10s.
© Наумова Юлия, 2020