|
|
|
|
|
|
|
|
|
|
|
 |
|
||||||||
|
|
|
|
|
|
|
|
|
||
Докинг низкомолекулярных лигандов в структуру белка Работа проходит с белком лизоцимом
из организма курицы LYSC_CHICK, структура (seq.B99990001.pdb) была построена на основе гомологичного моделирования (предыдущее задание). Затем с помощью obgen построим 3D-структуру этого сахара в pdb-формате: С помощью скрипта prepare_ligand4.py из пакета Autodock tools был создан pdbqt-файл лиганда NAG nag.pdbqt:
Проведем первый докинг: Просмотрим файл nag_prot.log. Энергии трех лучших расположений и геометрическая разница между ними представлена в таблице:
mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b.
-----+------------+----------+----------
1 -5.5 0.000 0.000
2 -5.5 1.990 4.897
3 -5.4 2.909 4.487
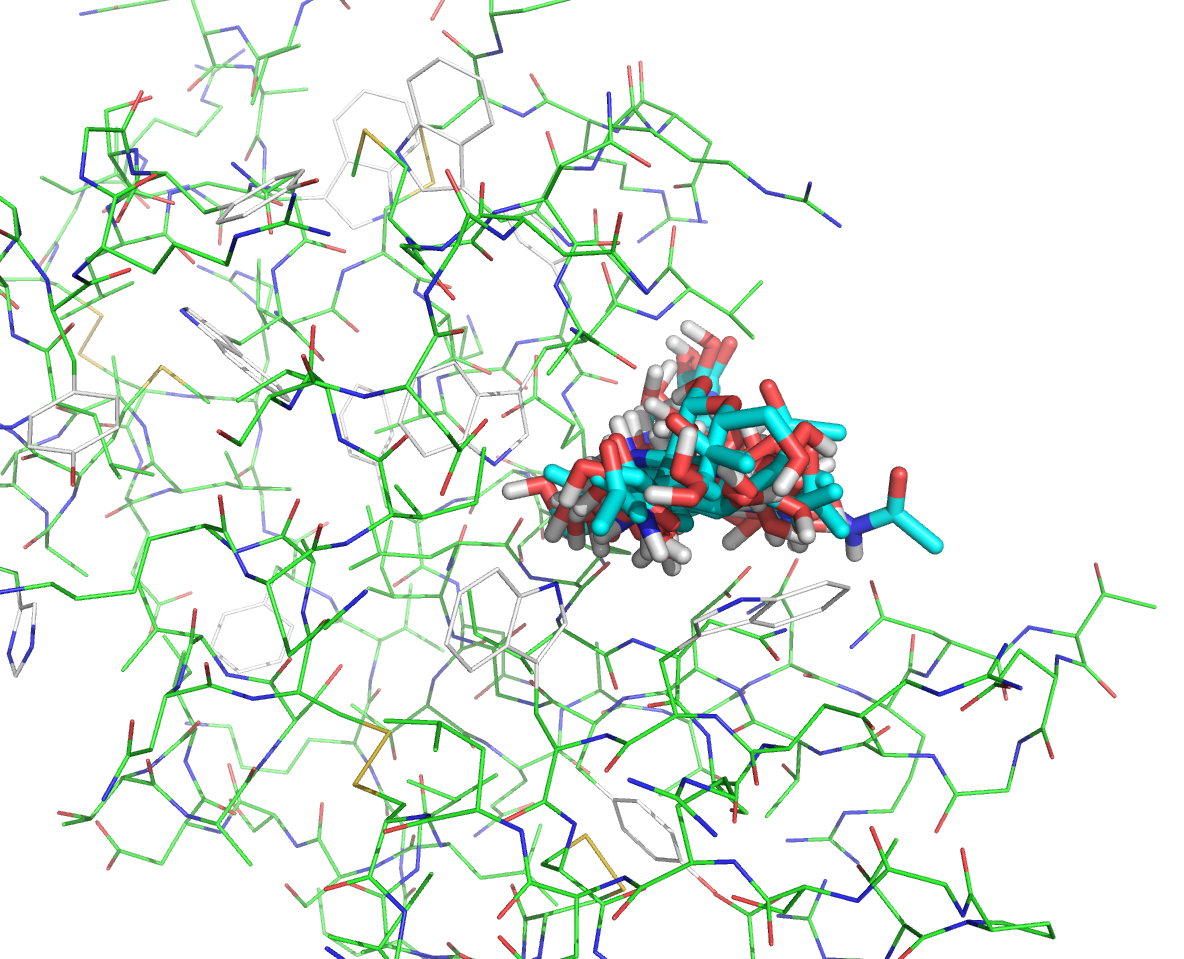
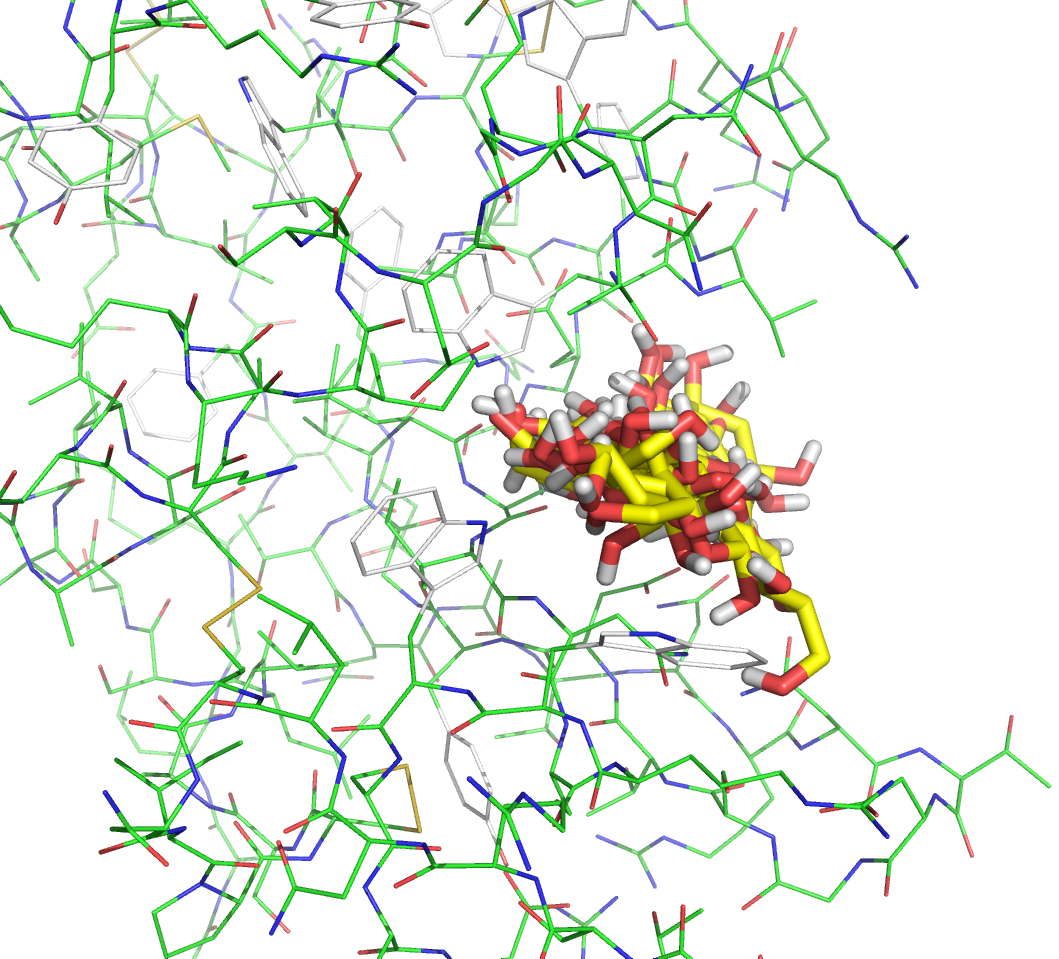
Файлы nag_prot.pdbqt и seq.B99990001.pdbqt были загружены в PyMOL. Все состояния на одной картинке изображены ниже:
Как видно на картинке выше, положение лиганда внутри центра связывания достаточно свободно. Теперь проведем докинг, рассматривая подвижность некоторых боковых радикалов белка. В результате докинга были получены файлы vina_prot_flex.pdbqt и vina_prot_flex.log. Просмотрим файл vina_prot_flex.log. Энергии трех лучших расположений и геометрическая разница между ними представлена в таблице: mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b.
-----+------------+----------+----------
1 -5.2 0.000 0.000
2 -5.2 1.678 4.172
3 -5.1 2.495 3.839
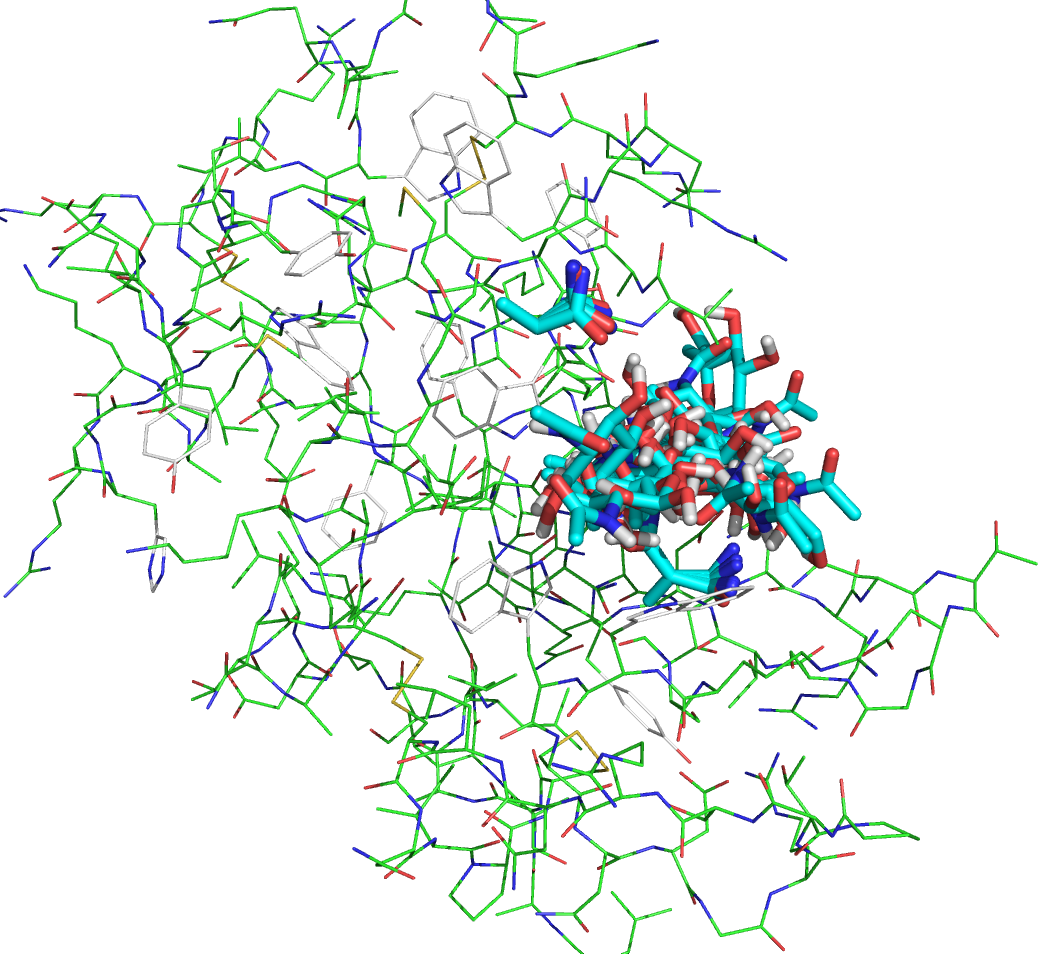
Файлы seq.B99990001_rigid.pdbqt и vina_prot_flex.pdbqt были загружены в PyMOL. Все состояния на одной картинке изображены ниже:
Создадим три лиганда, где метильный радикал СH3C(=O)NH группы NAG заменен на OH, NH2 и H.
Таблица трех лучших расположений для первого лиганда: mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b.
-----+------------+----------+----------
1 -4.9 0.000 0.000
2 -4.8 1.259 3.619
3 -4.6 1.472 1.843
Для второго лиганда:
mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b.
-----+------------+----------+----------
1 -4.8 0.000 0.000
2 -4.7 2.295 3.777
3 -4.6 1.714 3.160
Для третьего лиганда:
mode | affinity | dist from best mode
| (kcal/mol) | rmsd l.b.| rmsd u.b.
-----+------------+----------+----------
1 -4.8 0.000 0.000
2 -4.7 3.003 4.989
3 -4.7 1.553 3.440
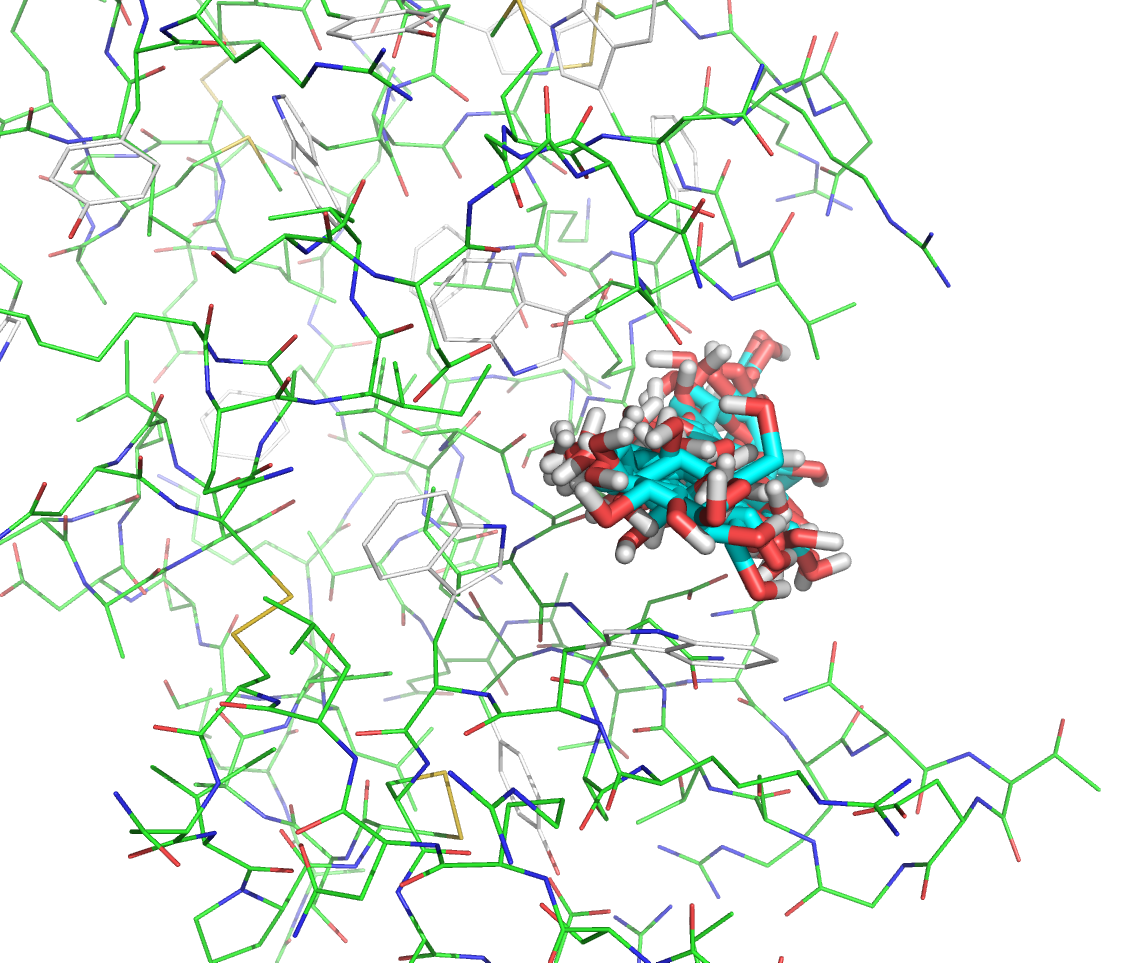
Изображение результата докинга для первого лиганда представлено ниже:
Изображение результата докинга для второго лиганда представлено ниже:
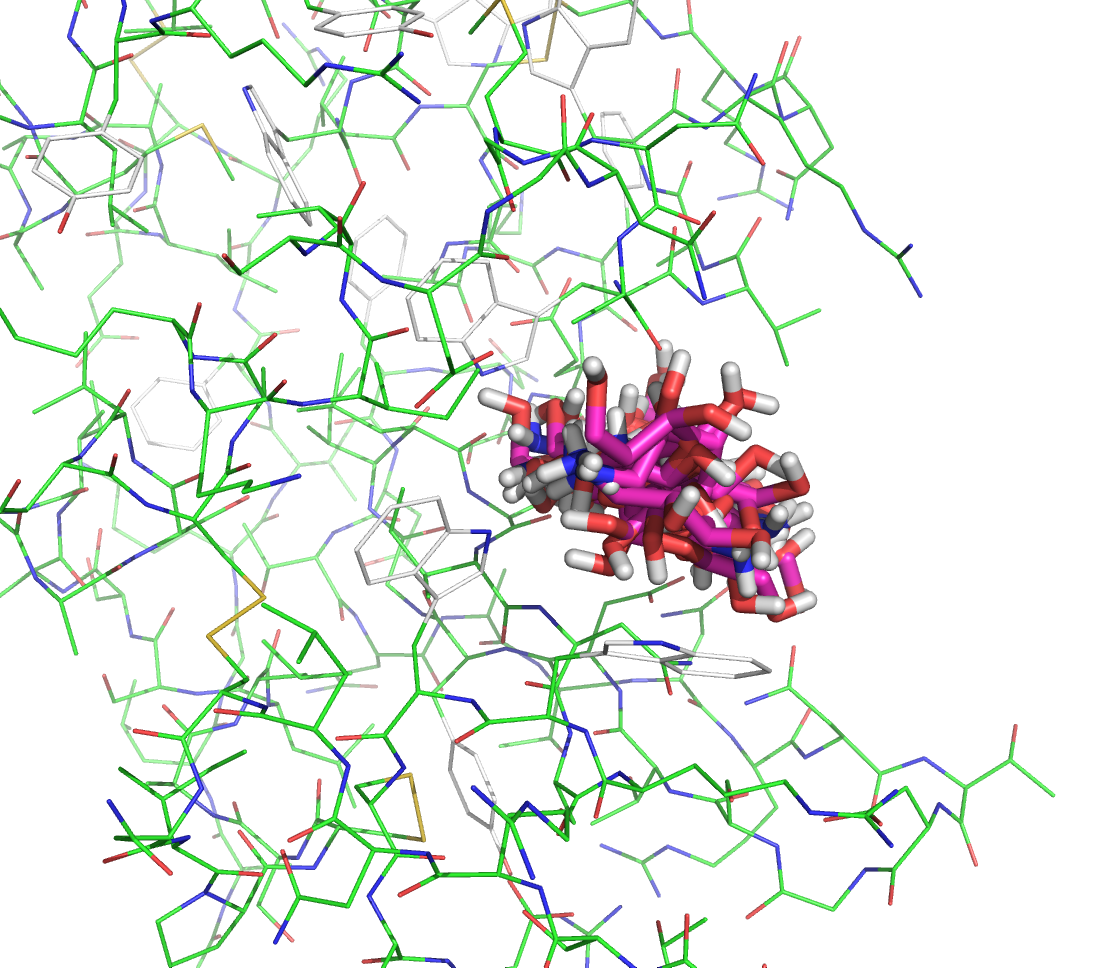
Изображение результата докинга для третьего лиганда представлено ниже:
|
|
||||||||
|
|
|||||||||
|
© Замараев Алексей |
|
||||||||