|
|
|
|
|
|
|
|
|
|
|
 |
|
||||||||
|
|
|
|
|
|
|
|
|
||
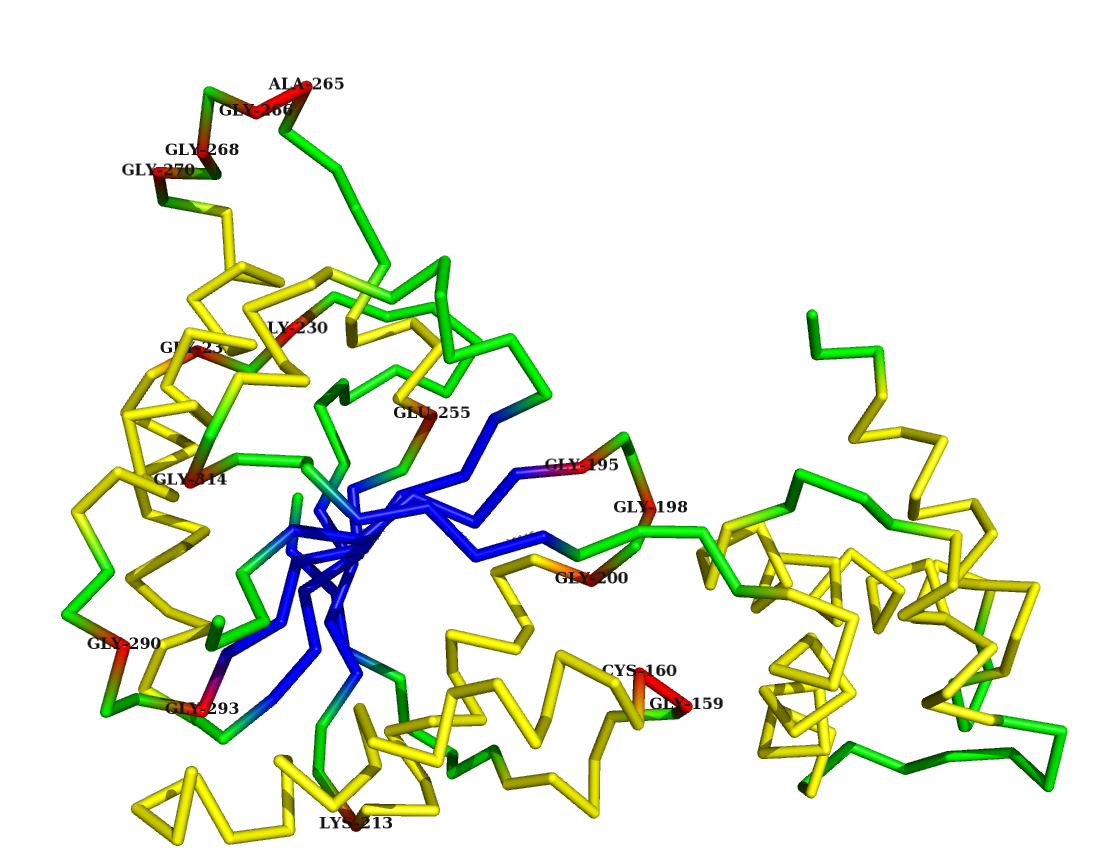
Програмы Dssp и HBplus Сведения о структуре, лигандах, и геометрии белка 1lv7 Сравнение вторичной структуры белка 1lv7, полученной программой Dssp и из записи pdb Сведения о вторичной структуре белка из записи pdb: просмотр В записи pdb 13 альфа-спиралей и 6 бета-тяжей Результат предсказания вторичной структуры белка программой Dssp: просмотр В предсказании программы dssp 11 альфа-спиралей и 6 бета-тяжей Сравнение было произведено посредством Excel: просмотр таблицы Как видно из таблицы: почти все элементы вторичной структуры из записи pdb верно предсказаны программой dssp, за исключением двух небольших альфа-спиралей(153-157, 307-312) и одного небольшого участка альфа спирали(176-180), итого правильно предсказано 14 элементов из 17, т е 82%, что говорит о хорошей предсказательной функции данной программы. Вторичная структура белка 1lv7 и phi угол Данные полученные программой Dssp (просмотр) были использованы для анализа угла phi Из 252 а.о. остатков с положительным значением phi всего 16, из них 12 это глицин. С помощью Pymol визуализировал структуру белка 1lv7 (Желтым отмечены альфа-спирали, синим - бета-тяжи, красным а.о. с положительным значением phi, зеленым - остов структуры)
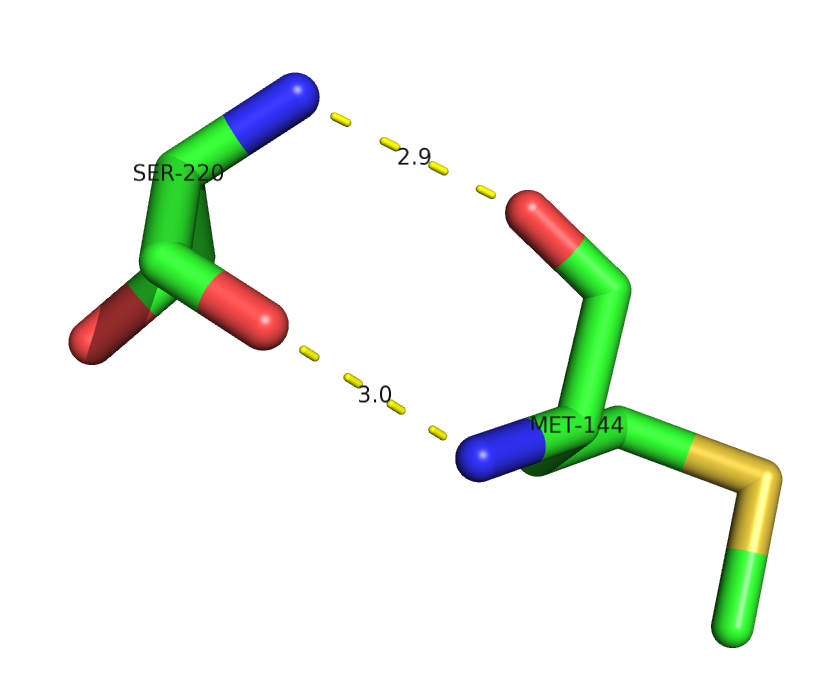
Водородные связи в молекуле 1lv7 (красным обозначены атомы кислорода, синим - атомы азота, желтым - атомы серы) 1) Водородные связи, участвующие в стабилизации вторичной структуры (между остовными атомами кислорода и азота)
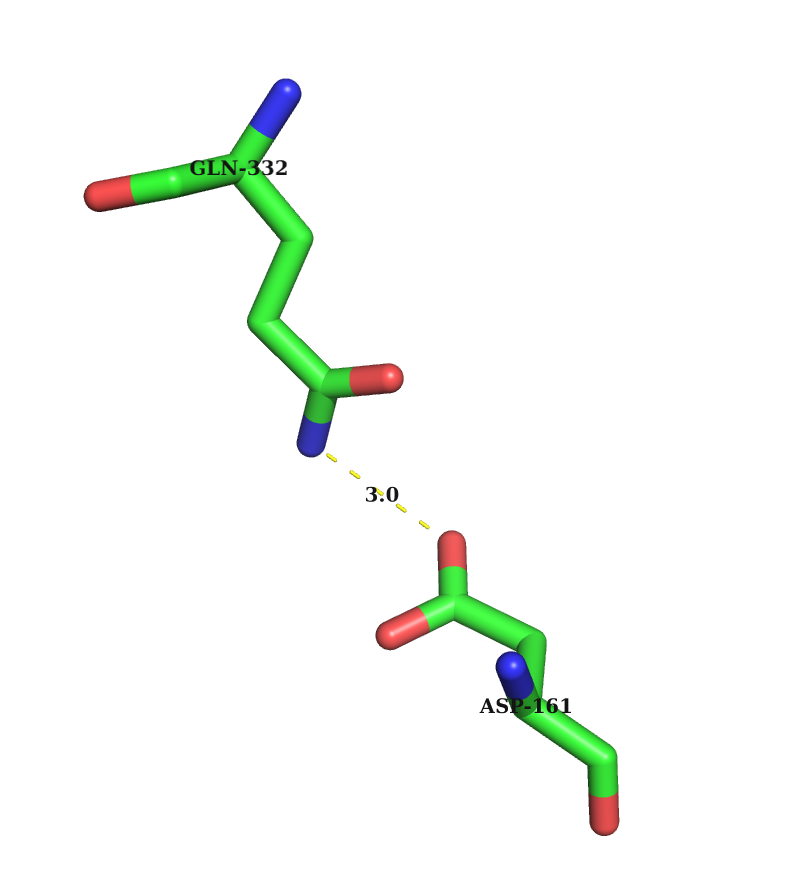
2) Водородные связи между боковыми цепями аминокислотных остатков (A0332-GLN NE2 A0161-ASP OD2)
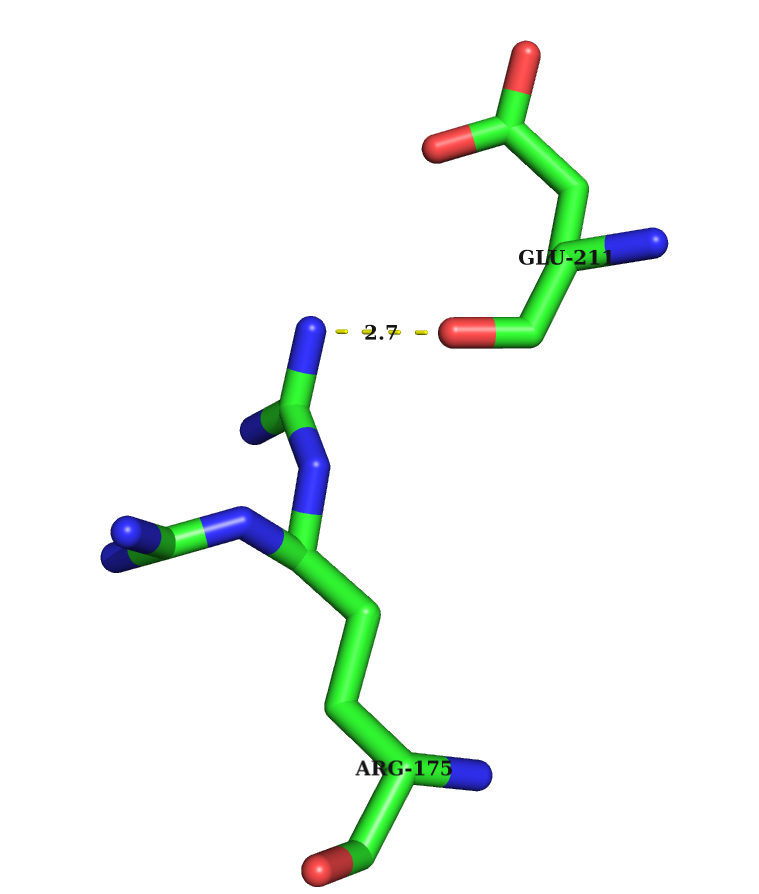
3) Водородные связи между боковой цепью одного остатка и остовным атомом другого (A0175-ARG NH2 A0211-GLU O)
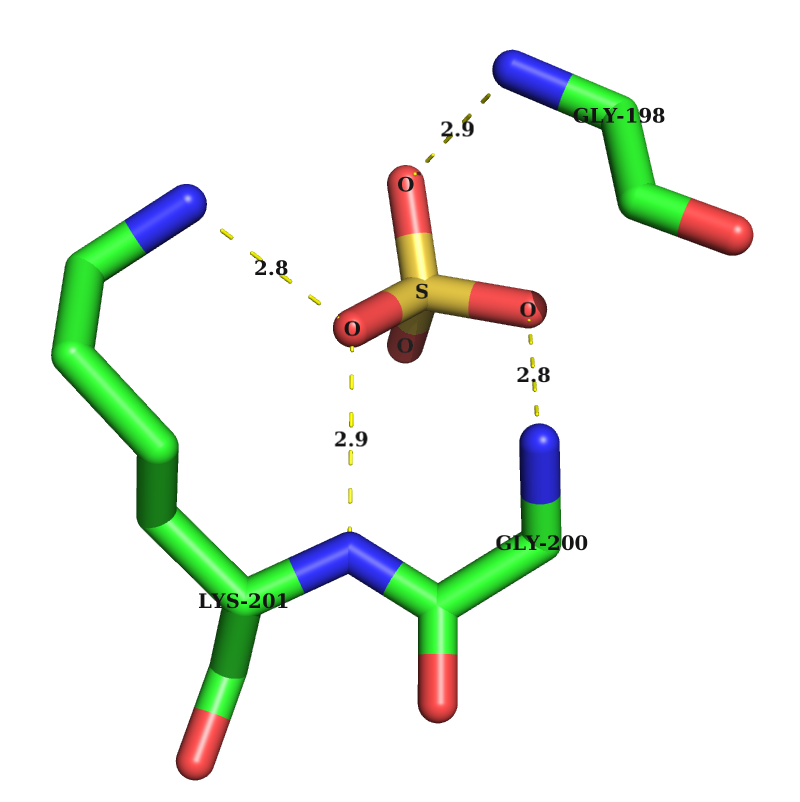
4) Водородные связи между между белком и лигандом, в данном случае в качестве лиганда выступает атом серы A0198-GLY N -1001-SO4 O2
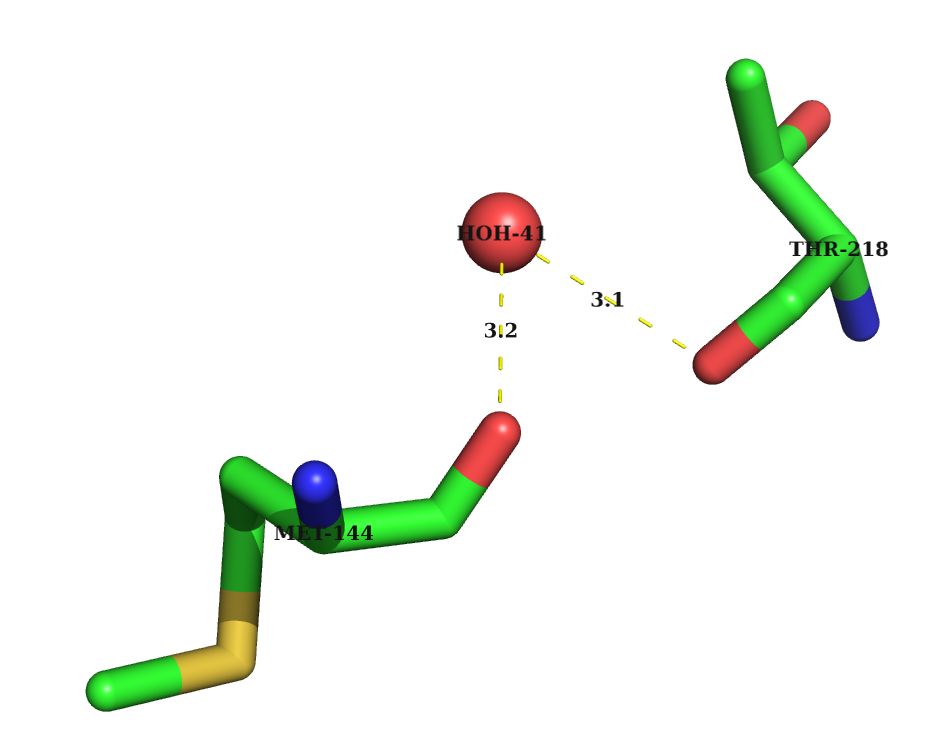
4) Водяные мостики между различными остатками -0041-HOH O A0218-THR O
|
|
||||||||
|
|
|||||||||
|
© Замараев Алексей |
|
||||||||