Задание 1. Вводное.
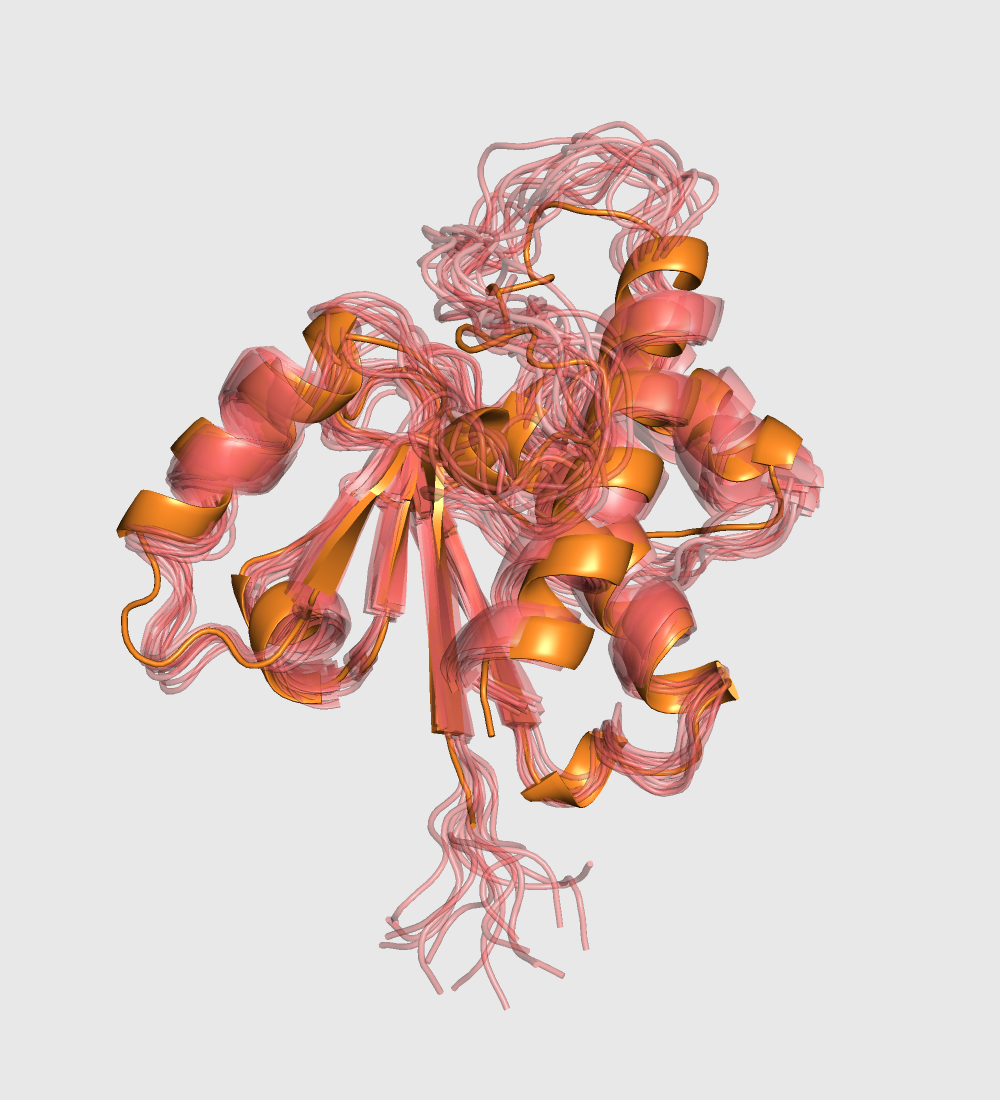
На левом рисунке ниже показаны модели двух структур: 1BVH (полученная ЯМР, розовая) и 1PHR (полученная РСА, оранжевая). Видно, что все альфа-спирали и бета-слои накладываются друг на друга неплохо, но макро-различия между структурами все равно вполне заметные: альфа-спирали находятся немного под разными углами, при этом есть маленький участок справа внизу, который в 1PHR трактуется как спираль, а в 1BVH - просто как участок линкера. И бета-слои, и альфа-спирали в 1PHR в среднем чуть-чуть длинее, чем в 1BVH. Вероятно, это обусловлено тем, что ближе к концам этих упорядоченных структур подструктуры 1BVH сходятся хуже, чем в середине. Положения длинных линкеров в структурах различаются довольно сильно: линкеры в 1PHR далеки не просто от усредненной структуры 1BVH, но и даже от крайних ее подструктур. Сильно различаются положения концов белковой цепи, особенно того, который представляет из себя более длинный линкер (это N-конец). Этот конец не полностью присутствует в 1PHR, а в подструктурах 1BVH его положение сильно различается, наверное, потому что он более подвижный.
 |
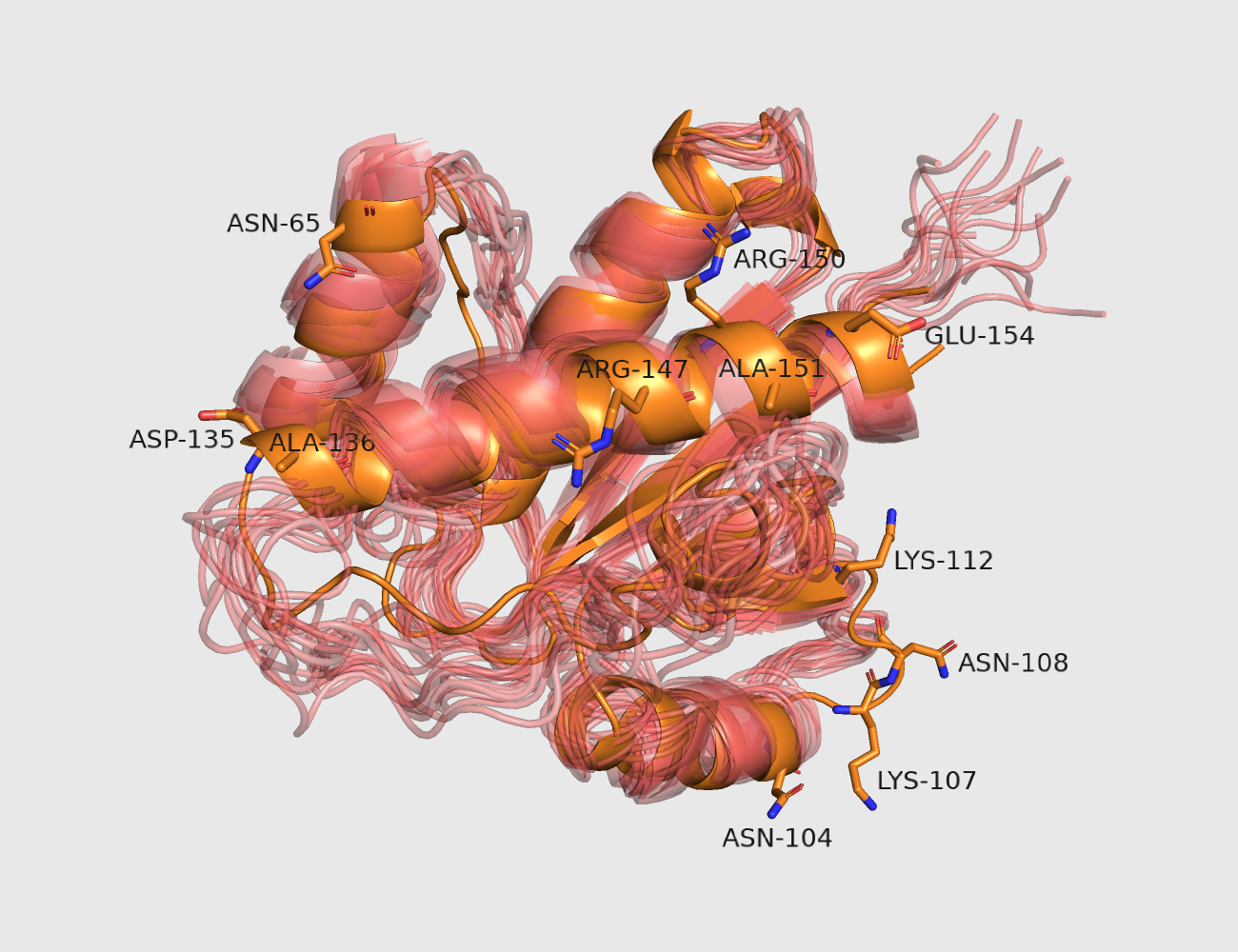 |
Микро-различия этих двух структур определить сложнее. Тем не менее я попыталась, и мне кажется, что структуры склонны не совпадать больше в местах, где есть аминокислоты с полярными или заряженными боковыми цепями (хотя это не всегда так) (правый рисунок). Если это действительно так, то сказать, почему это так, опять же, трудно. Возможно, дело даже в том, что полярные и заряженные аминокислоты в среднем имеют бОльшие боковые цепи, и для совпадения структур критичен этот фактор.
Задание 2. RMSF.
Вот scatter plot, который у меня получился:
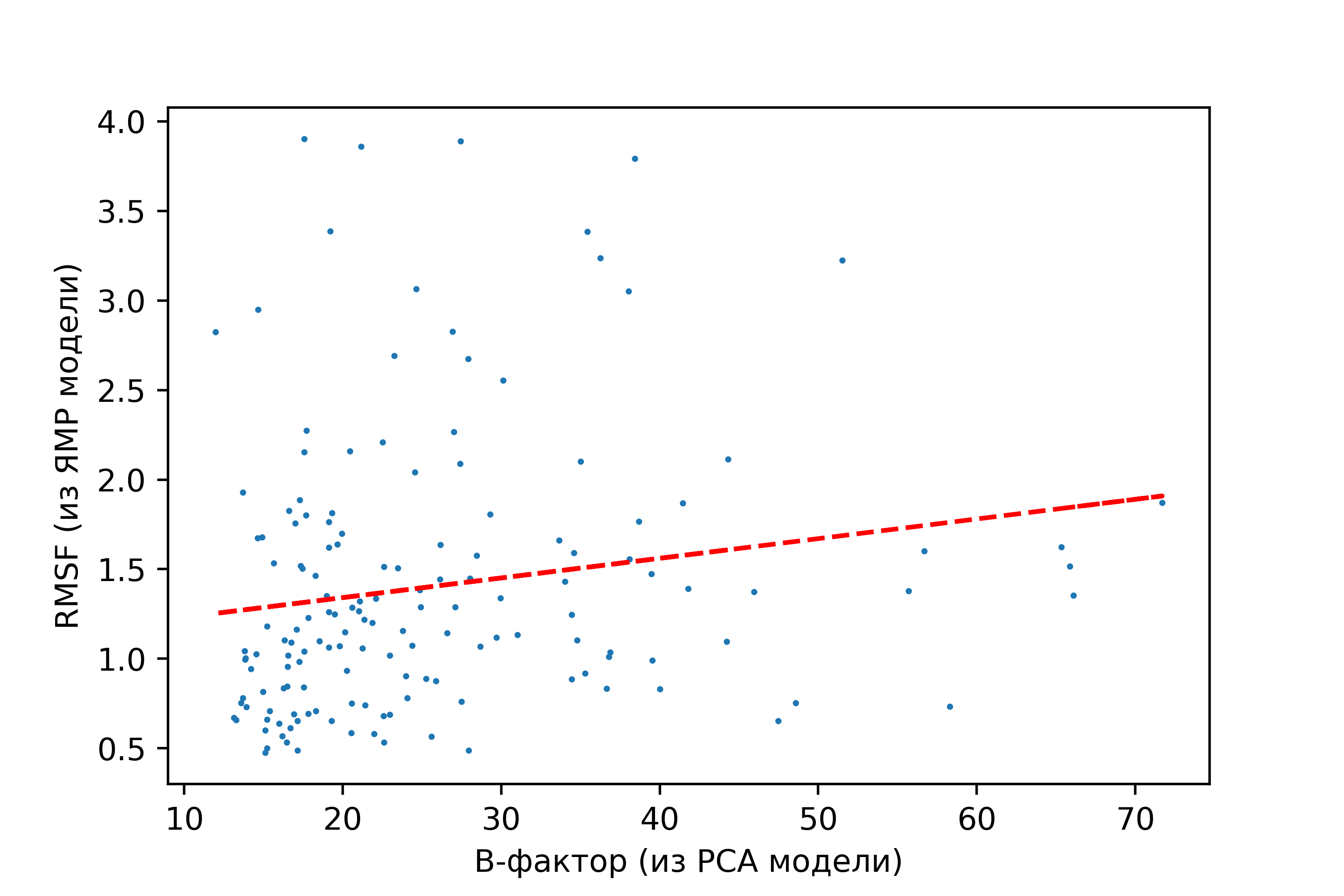
На глаз кажется, что зависимости нет, а линия тренда показывает небольшую положительную корреляцию между подвижностью молекулы, о которой мы судим по В-фактору РСА модели, и "несходимостью" моделей, полученных ЯМР, о которой мы судим по RMSF. Но этой линии тренда едва ли можно верить, так как видно, что для больших значений В-фактора данных очень мало.
Задание 3.
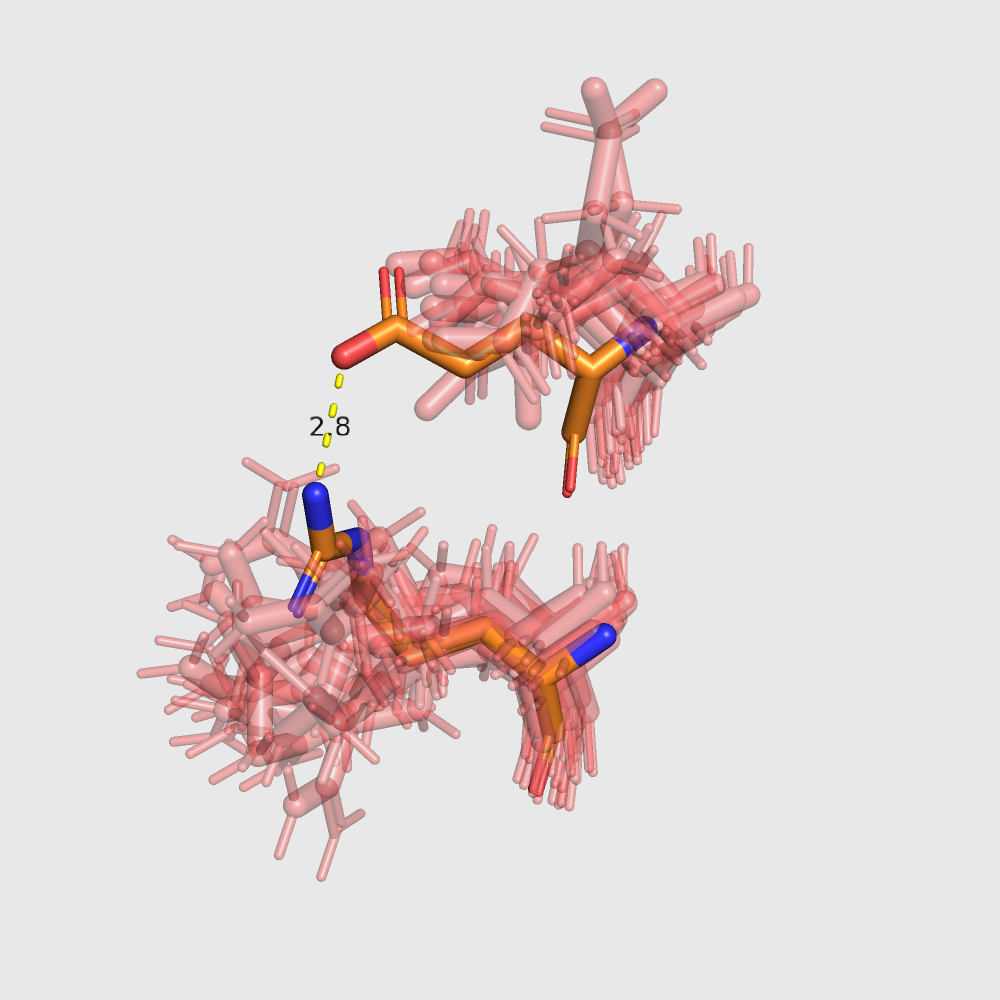
В таблице ниже представлена вся информация о выбранных мной трех водородных связях.
| II структура и положение в глобуле | Между атомами остова альфа-спирали, в глобуле | Между атомами боковых радикалов в альфа-спирали, в глобуле | Между боковым радикалом и остовом остатков петли, на поверхности глобулы |
| Между какими остатками | ASN`95 и LEU`99 | ARG`27 и GLU`23 | LYS`123 и PRO`121 |
| Между какими группами | =О и -NH | -NH2 и -OH | -NH2 и =О |
| Расстояние в РСА модели | 3 Å | 2.8 Å | 3 Å |
| В каком числе (и %) моделей ЯМР есть связь | 1 (6.7%) | 0 | 0 |
| Минимальное значение расстояния среди моделей ЯМР | 3.5 Å | 5.5 Å | 5.0 Å |
| Максимальное | 7.3 Å | 13.0 Å | 10.8 Å |
| Медианное | 4.2 Å | 8.4 Å | 9.3 Å |
| Изображение | 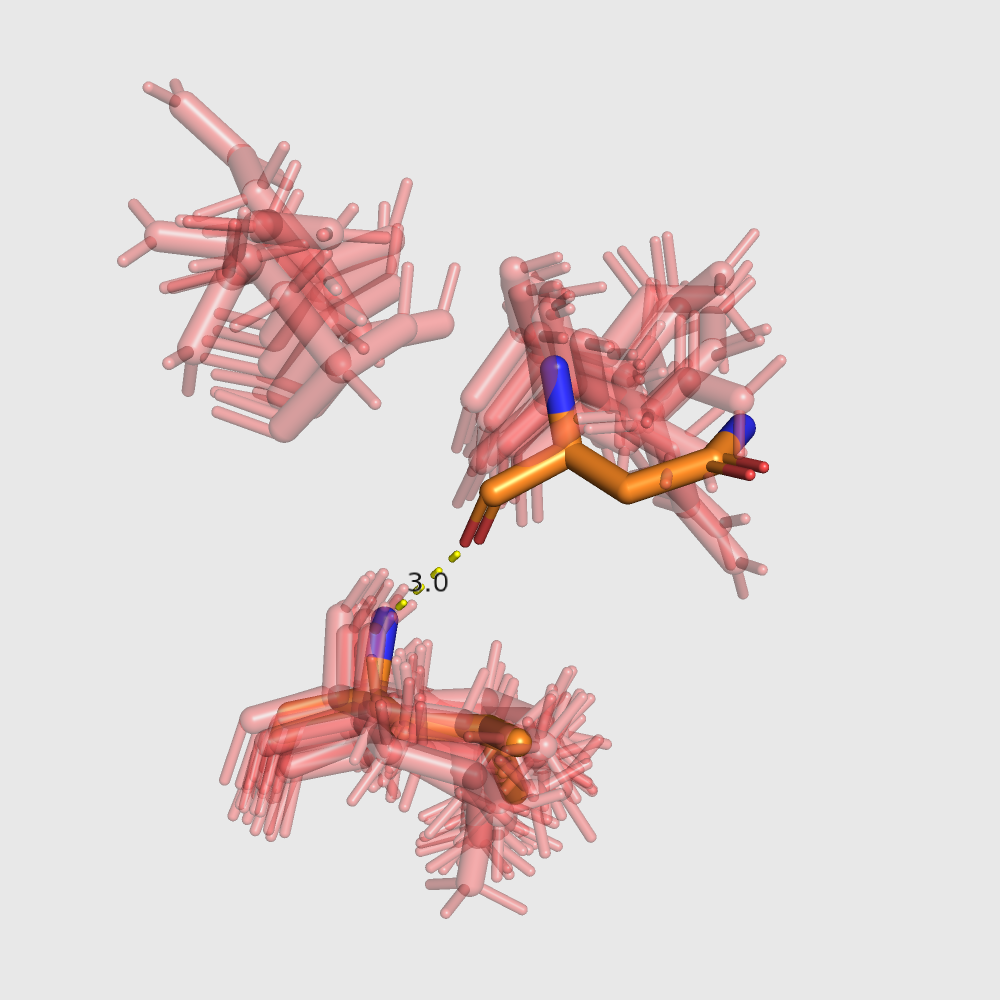 |
 |
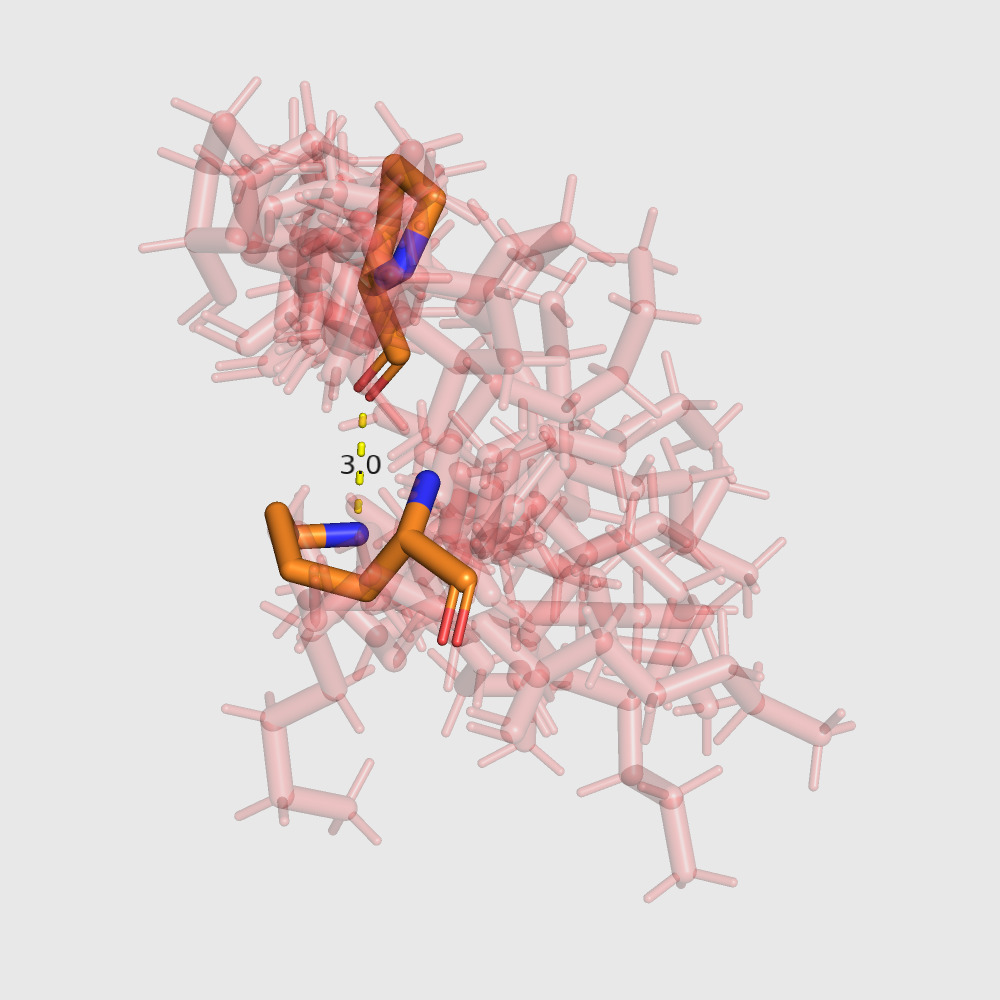 |
| Комментарии | Видно, что часть структур ЯМР имеют совсем другую конформацию и никак не могут образовать связь. Только одна модель ЯМР, похоже, образует слабую водородную связь между этими атомами. Поэтому неудивительно, что этот участок цепи в ЯМР модели даже не трактуется, как альфа-спираль. | Здесь модели ЯМР больше похожи друг на друга, но все равно во всех них остатки находятся далековато для образования водородной связи. | На поверхности глобулы (в петлях) модели ЯМР и РСА меньше всего совпадают, возможно, в том числе из-за большей подвижности петель. Между этими остатками также ни одна модель ЯМР не образует связь. |