Задание 1. SASA, MSA.
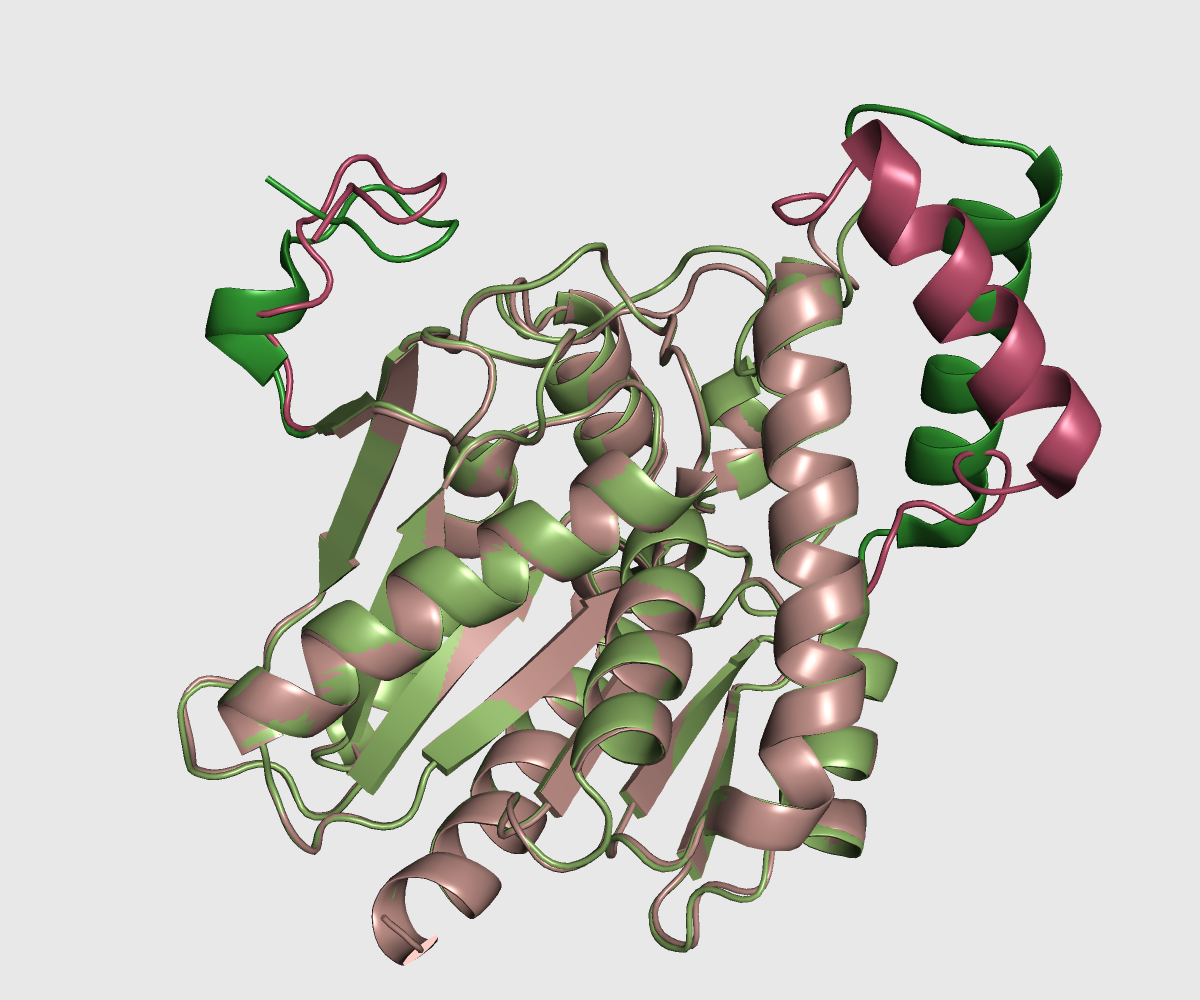
На рисунке ниже показаны структуры 3pe6 (зеленая) - открытая форма белка и 3hju - закрытая форма. Различающиеся участки покрашены в более темный цвет, они заметны на конце молекулы (остатки с 7го по 20ый) и на участке справа, где по-разному расположены альфа-спирали (остатки со 150 по 174), вероятно, именно там расположен основной связывающий карман.
Я вычислила для обеих форм площадь молекулярной поверхности и площадь поверхности, доступной растворителю:
| Структура | SAS (Å2) | MS (Å2) |
| 3pe6 (открытая) | 12441.134 | 32269.984 |
| 3hju (закрытая) | 13038.232 | 29062.277 |
Вопреки моим ожиданиям площадь поверхности, доступная растворителю оказалась в 2,5-3 раза меньше, чем молекулярная поверхность. То есть получается, что при переходе от SASA к MSA мы начинаем учитывать все карманы, в которые не проникает вода, и этот фактор гораздо сильнее влияет на площадь, чем простое увеличение объема, ограничиваемого площадью, пропорционально радиусу растворителя в кубе.
Задание 2. Карманы, объем.
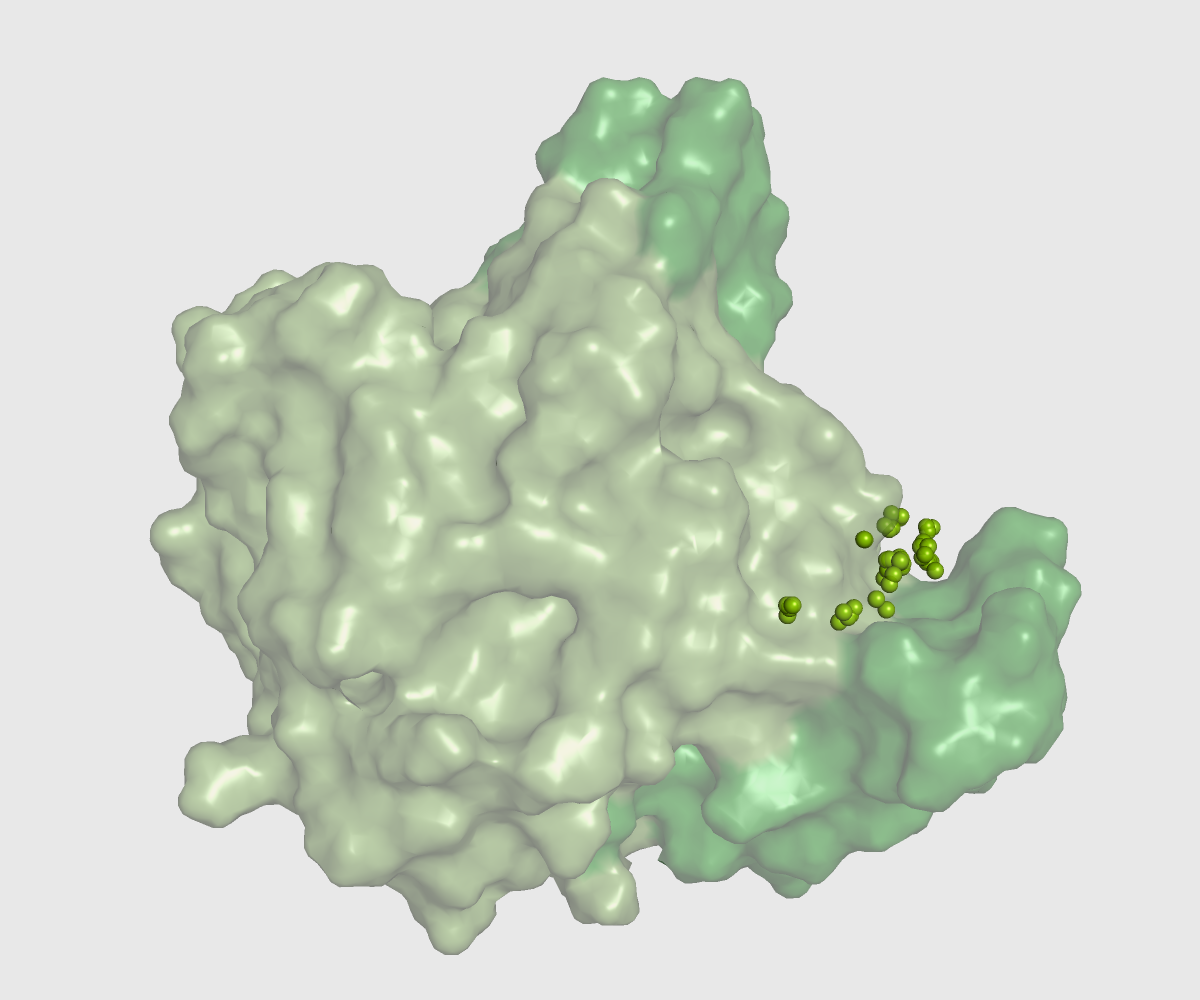
Ниже показан интересующий нас карман в открытой и закрытой формах.
| Открытая форма, 3pe6 | Закрытая форма, 3hju |
| Площадь кармана = 2144.1306 | Площадь кармана = 1546.8550 |
 |
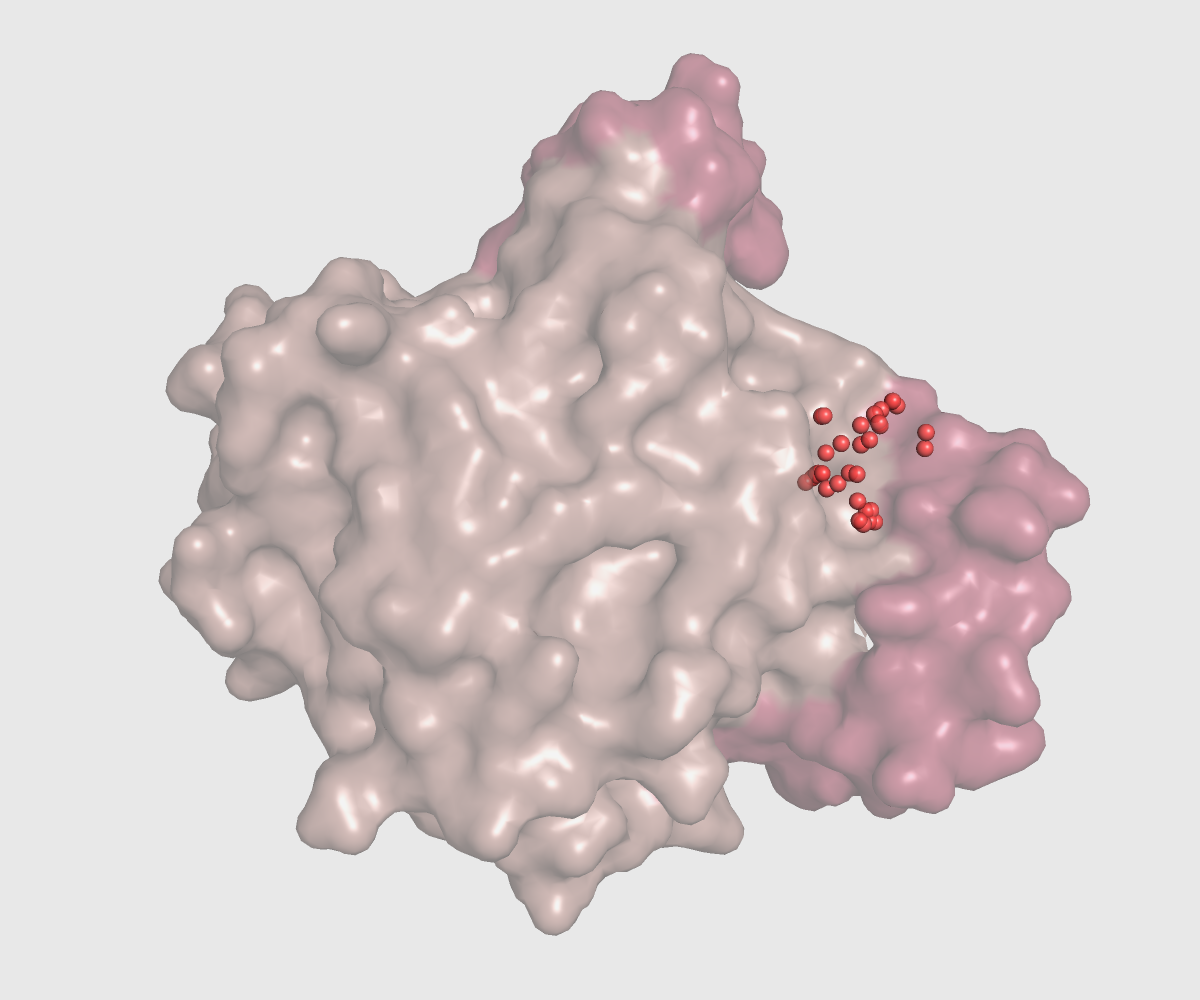 |
Мы видим, что форма и объем (и площадь) кармана сильно меняются при смене конфрмации, причем с ни с каким другим карманом таких больших изменений не происходит. Поскольку в закрытой форме площадь кармана меньше, я предполагаю, что лиганд/субстрат, который связывается с белком в открытой форме в закрытой связаться уже не может.
Задание 3. Экспонированность.
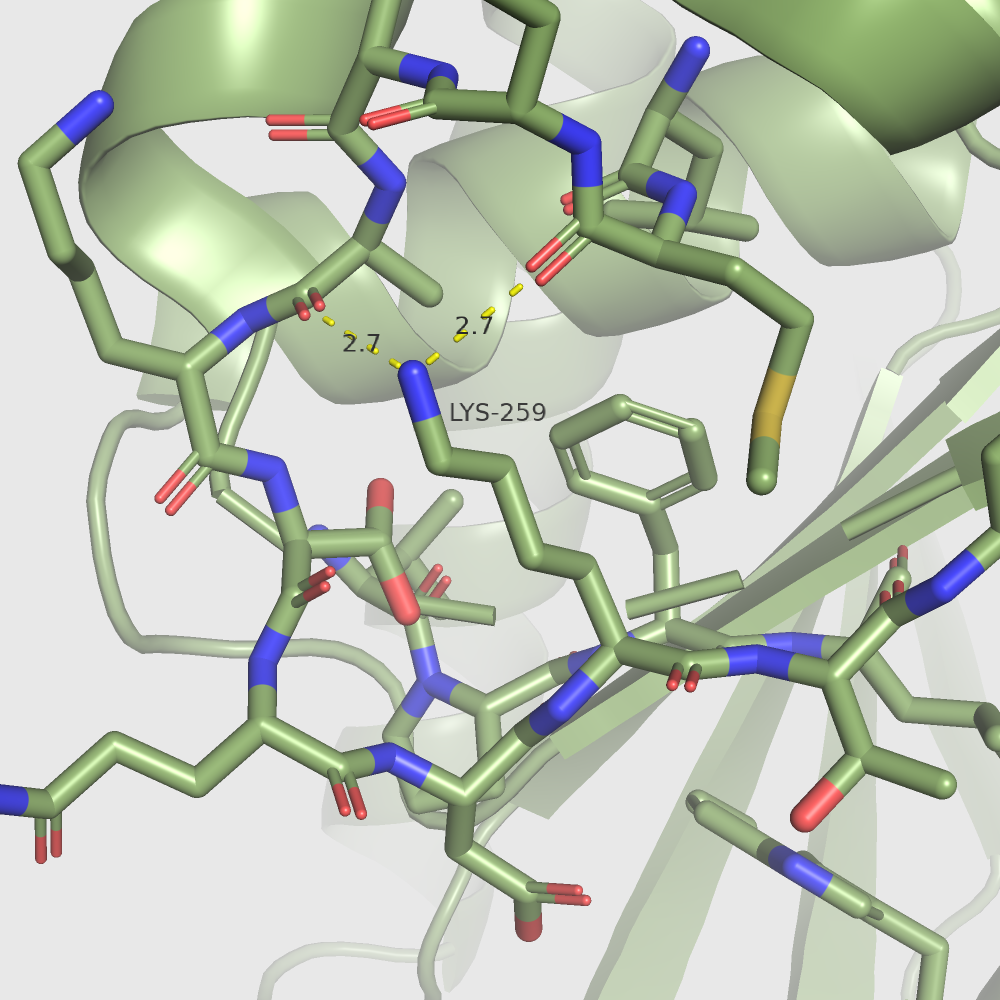
Я решила, что можно использовать абсолютную экспонированность остатка, которую выдает dssp, то есть SASA, если я буду рассматривать не разность экспонированностей остатка в разных формах, а их отношение, потому что в случае отношения SASA остатка в Gly-X-Gly сокращается. Я использовала псевдокаунты. Таким образом лидером стал лизин 259.
| В открытой форме: | В закрытой форме: |
 |
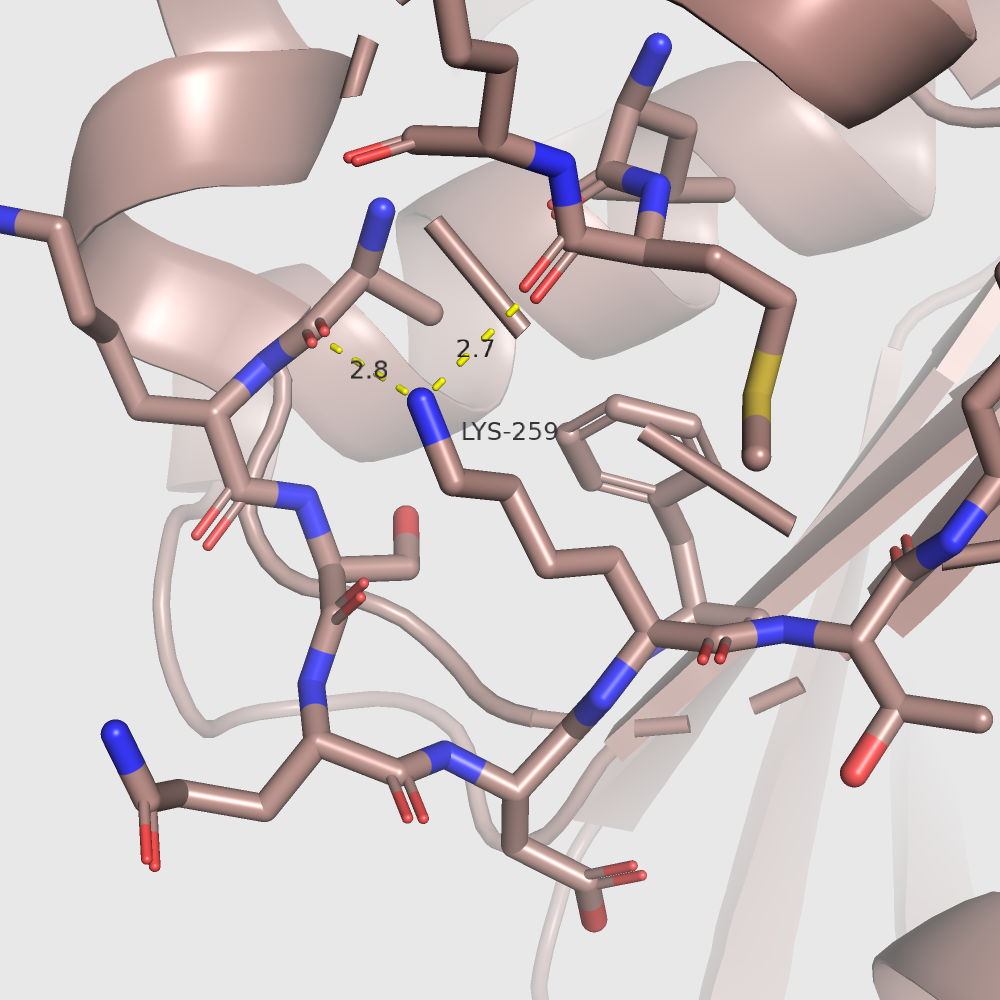 |
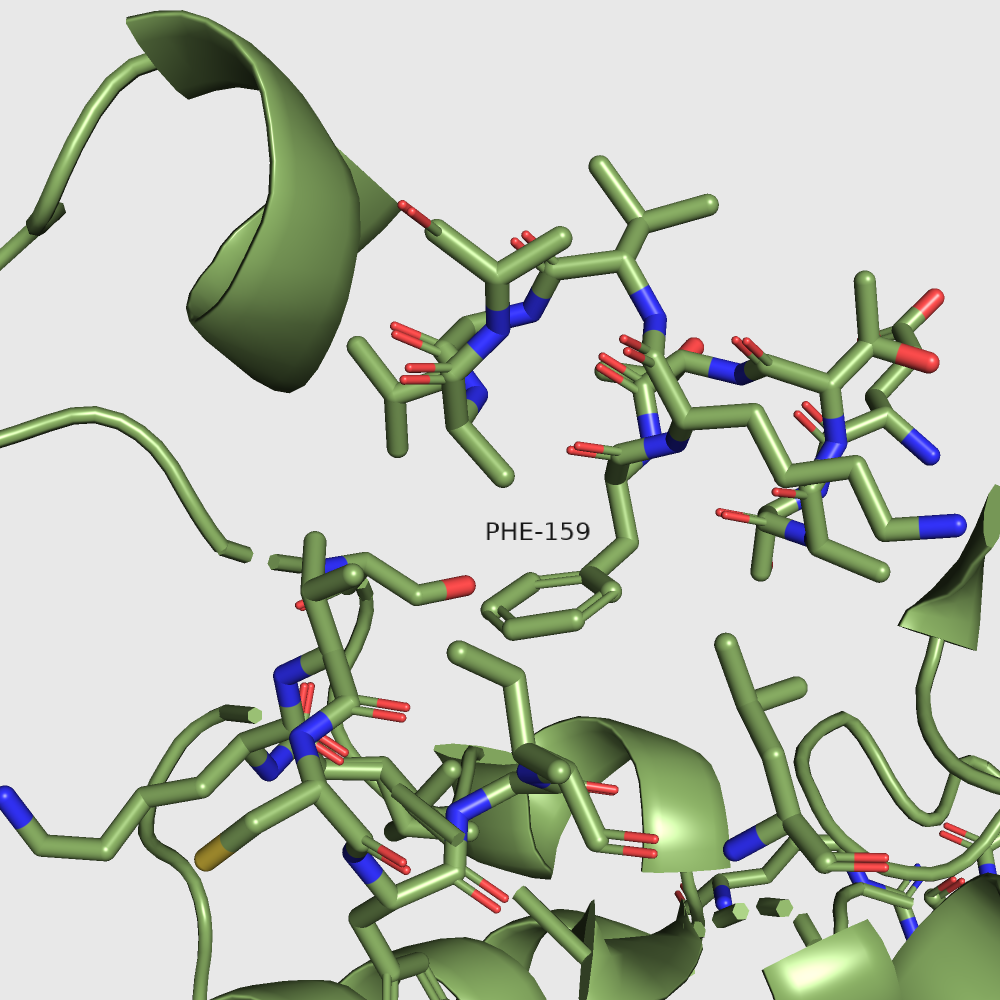
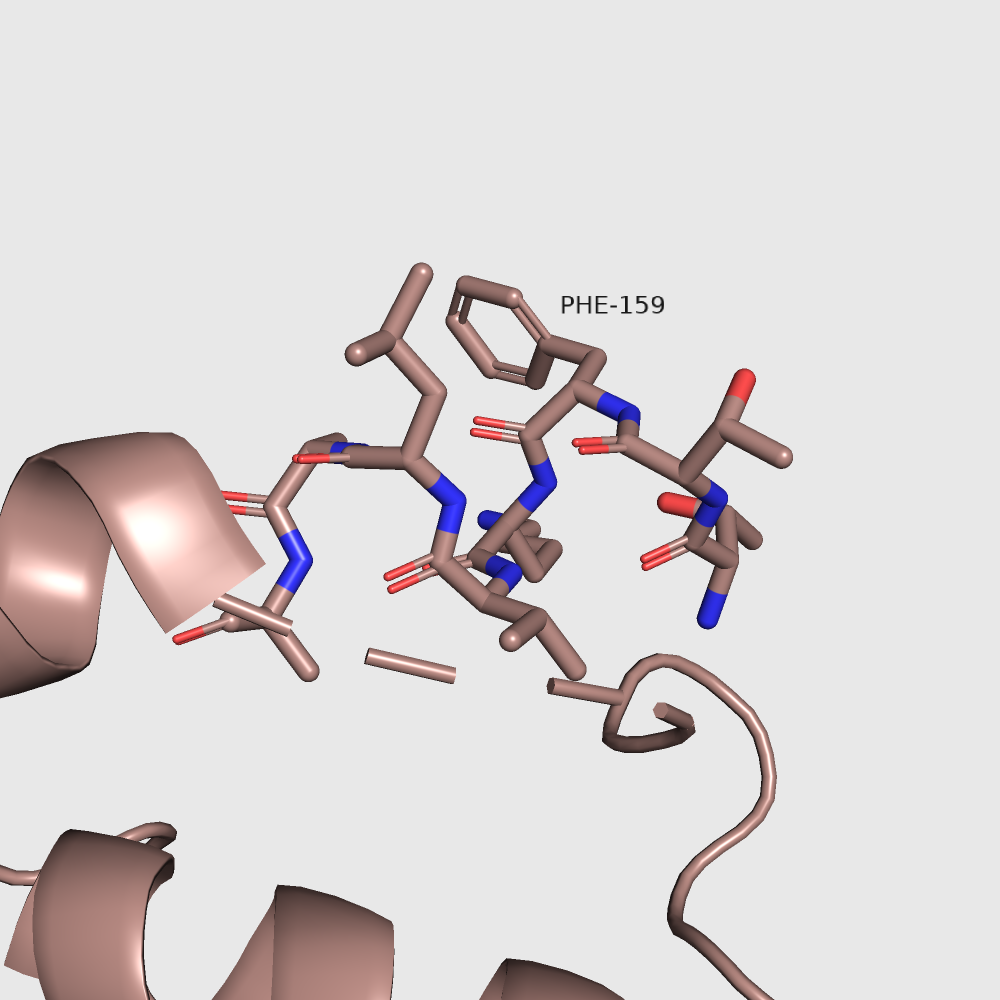
Почему-то визуально никаких различий между формами не наблюдается. Также похожи и водородные связи этого лизина в двух формах. Кстати, лизин 259 даже не находится в участках, сильно меняющихся при "закрытии" белка. Так что мне трудно предположить, на что влияет изменение его экспонированности. Я на всякий случай рассмотрела еще один остаток, экспонированность которого меняется не так сильно: фенилаланин 159. Вот для него экспонированность меняется очень наглядно, и он как раз находится в меняющемся участке.
| В открытой форме: | В закрытой форме: |
 |
 |