Практикум 10. Сравнение структуры белка, расшифрованной с помощью ЯМР и РСА
Для выполнения данного задания была выбрана структура белка - Тирозин фосфатазы Bos taurus.
Двумя методами была получена структура данного белка: ЯМР - PDB ID:1BVH (15 моделей); РСА - PDB ID:1DG9.
Для начала данные структуры, с помощью выравнивания cealign в Pymol, были проанализированы на схожесть укладок. На рисунке 1
представлено данное выравнивание (желтым - PDB ID:1DG9, серым - PDB ID:1BVH). В целом укладки сходны.
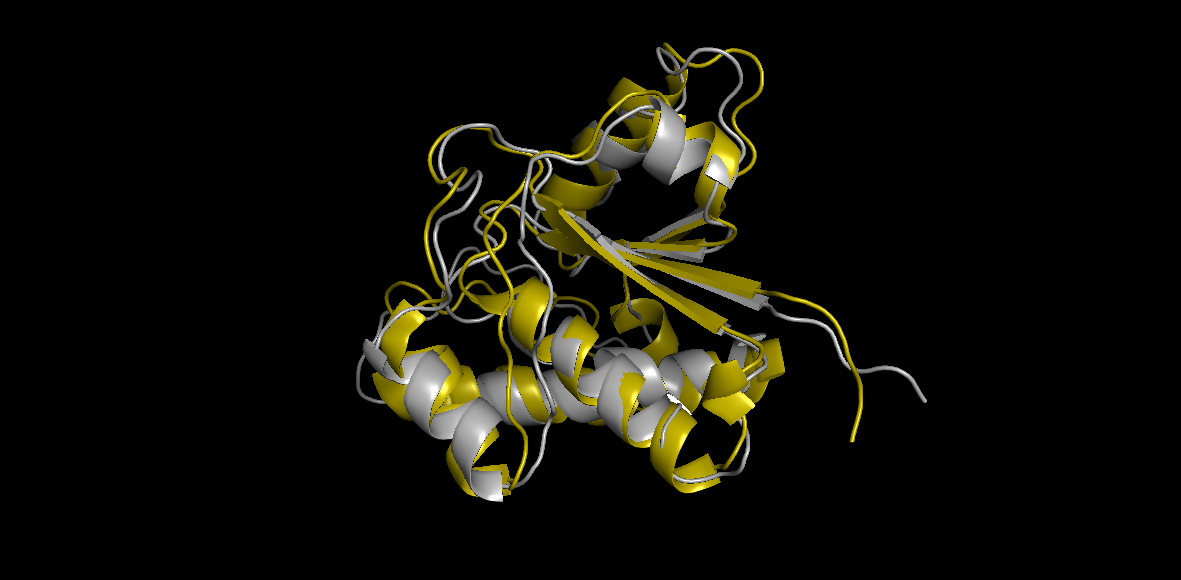
Рис. 1 Выравнивание двух структур тирозин фосфатазы, полученных ЯМР и РСА методами.
Далее были выбраны 3 водородные связи
1.Остовная в альфа-спирали: Cys 62 (атом кислорода остова)- His 66 (атом азота остова)
2.Водородная связь боковых цепей в ядре белка: Arg 75 (атом NE боковой цепи) - Asp 42 (атом OD2 боковой цепи)
3.Водородная связь в петлях, выходящих на поверхность глобулы: Val 106 (атом азота остова) - Ser 103 (атом кислорода остова).
Данные связи изображены на рисунках 2-4. На рисунках а -1DG9 и б - 1BVH (1 модель).
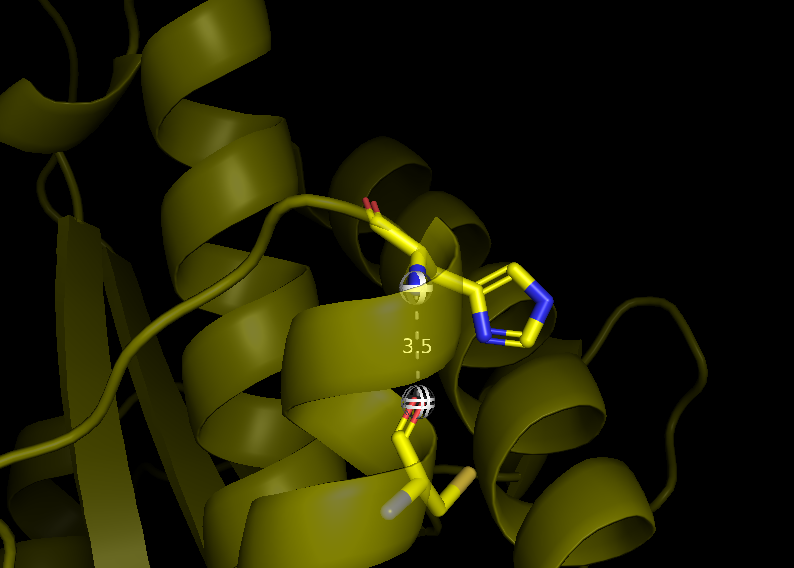
Рис. 2(а) Водородная связь Cys 62 (атом кислорода остова)- His 66 (атом азота остова) в 1DG9.
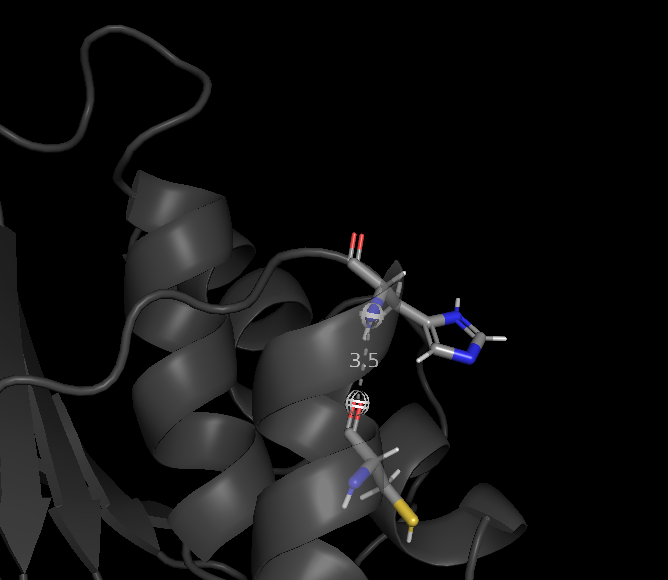
Рис. 2(б) Водородная связь Cys 62 (атом кислорода остова)- His 66 (атом азота остова) в 1BVH (1 модель).
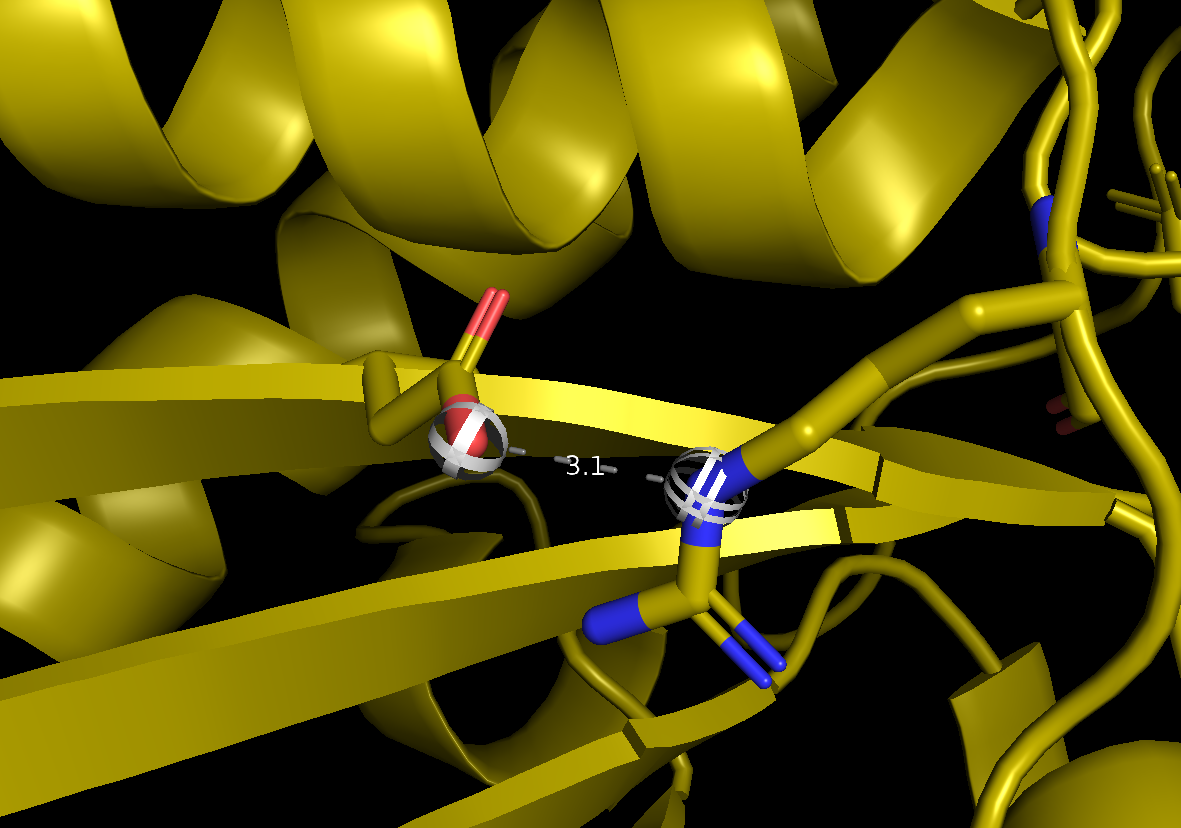
Рис. 3(а) Водородная связь Arg 75 (атом NE боковой цепи) - Asp 42 (атом OD2 боковой цепи) в 1DG9.

Рис. 3(б) Водородная связь Arg 75 (атом NE боковой цепи) - Asp 42 (атом OD2 боковой цепи) в 1BVH (1модель).
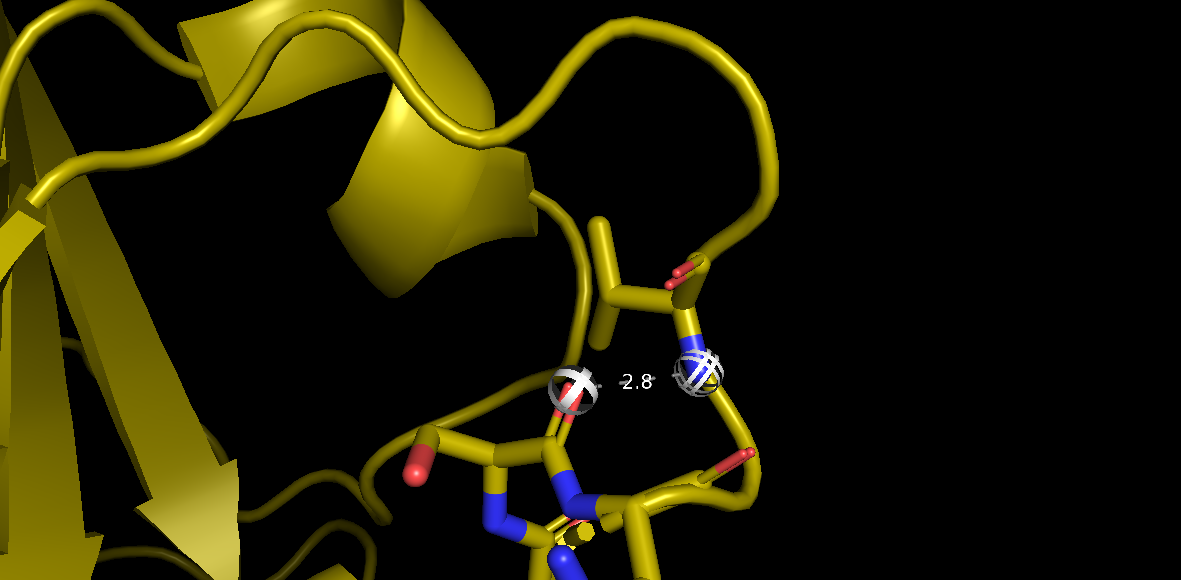
Рис. 4(а) Водородная связь Val 106 (атом азота остова) - Ser 103 (атом кислорода остова) в 1DG9.
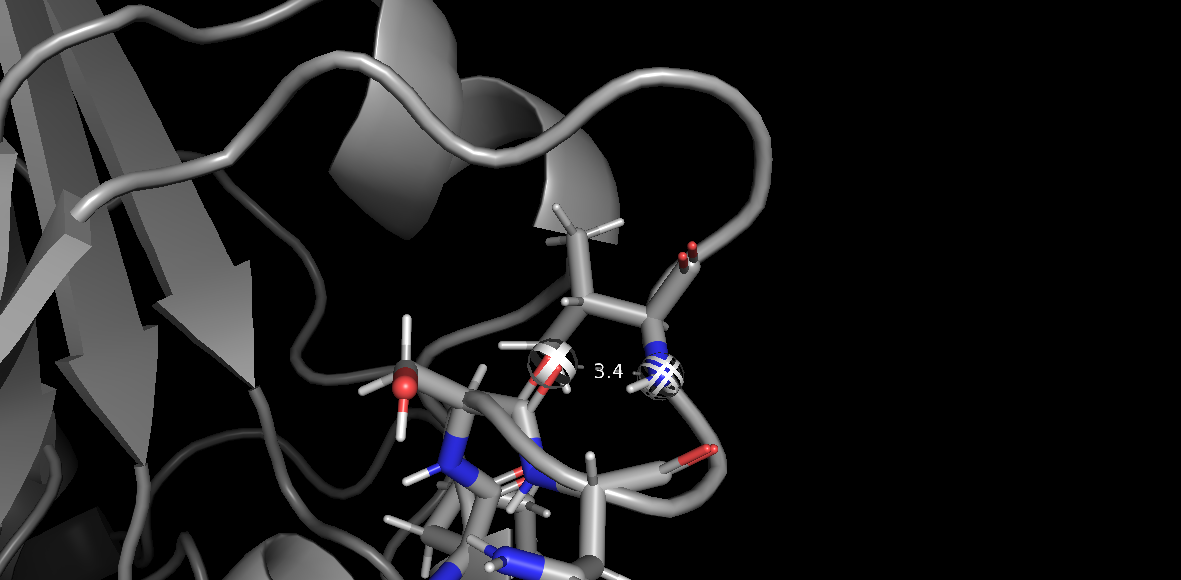
Рис. 4(б) Водородная связь Val 106 (атом азота остова) - Ser 103 (атом кислорода остова) в 1BVH (1 модель).
В Таблицу 1 сведены данные по расстоянию между донорами и акцепторами.
Таблица 1. Сравнение ЯМР и РСА структур
| Тип связи |
Расстояние РСА |
Число моделей ЯМР, имеющих данную водородную связь (из 15) |
Минимальное, максимальное и медианное значение расстояния в ЯМР |
| Ser 103-Val 106 (петля на поверхности) |
2.8 |
11 |
2.9, 3.9, 3.3 |
| Asp 42 - Arg 75 (боковые цепи) |
3.1 |
0 |
5.4, 11.5, 8.7
|
| Cys 62 - His 66 (альфа-спираль) |
3.5 |
2 |
3.5, 5.8, 4.3
|
Выводы
Из данных приведенных в таблице 1 можно заметить, что , как ни странно, лучше всего воспроизводится водородная связь
в петле экспонированной наружу. Водородная связь между боковыми цепями остатков вообще отсутвует в структуре, полученной ЯМР.
Третья водородная связь (в альфа-спирали) присутсвует только в 2 моделях.
Особенно удивил результат в первом случае: связь в экспонированной петле лучше всего воспроизводится.
Согласно данным предствленым в
литературе ,
петли длинной 4 аминокислотных остатка очень сходны в структурах, полученных двумя методами, если они экспонированы в раствор.
Выбранная петля как раз состоит из 4 аминокислот,и соответственно водородная связь в ней хорошо вопроизводится в моделях ЯМР структуры.
Касательно второго случая (связь между боковыми группам), данные остатки имеют довольно длинные боковые цепи, и в связи с небольшим размером белка,
вокруг них нет очень плотного окружения, которое строго определяло бы их положение. Таким образом, их подвижность вполне обоснована.
И наконец связь в альфа-спирали данная водородная связь.Она не очень хорошо воспроизводится и встречается лишь в 2 из 15 моделей
. Данная связь расположена
на самом краю альфа-спирали. Также, данная альфа-спираль в изучаемом белке
является довольно подвижным элементом вторичной структуры,особенно учитывая ее положение на окраине самого белка.
Более того, при рассмотрени
моделей структуры, было видно, что данный участок искривляется. (Рис.5)

Рис. 5 Поворот альфа-спирали в 1BVH (1 модель).







