β-лактамаза класса А из E.Coli BL21
β-лактамазы – ферменты, обеспечивающие бактериям мультирезистентность к β-лактамным антибиотикам. Фермент разрывает четырехчленное кольцо и деактивирует молекулу. β-лактамные антибиотики – антибиотики широкого спектра, которые используются против Грам-отрицательных и Грам-положительных бактерий. Фермент часто вырабатывается у Грам-отрицательных бактерий, особенно если антибиотик присутствует в среде.(4)
Ферментативную активность β-лактамазы можно определить с помощью нитросефина (производное цефалоспорина), который меняет цвет с желтого на красный после гидролиза.(4)
β-лактамазы подразделяются на 4 подкласса: A, B, C, D. Субклассы B1 и B2 теоретически эволюционировали независимо около миллиарда лет, а субкласс В3 начал эволюционировать независимо до разделения Грам-положительных и Грам-отрицательных бактерий, т.е. 2 миллиарда лет назад. Группы A, C и D слабо гомологичны друг другу, хотя A и D признаются сестринскими, а группа С отделилась от них раньше.(4)
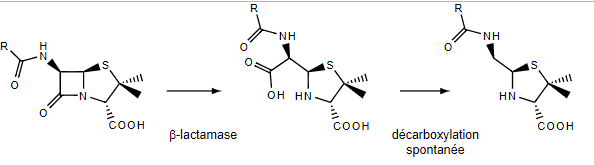
Фермент несет каталитический остаток SER70, который атакует связь в β-лактамном кольце антибиотика и гидролизует ее. Воду для этой реакции активирует и поставляет остаток GLU166.(2)
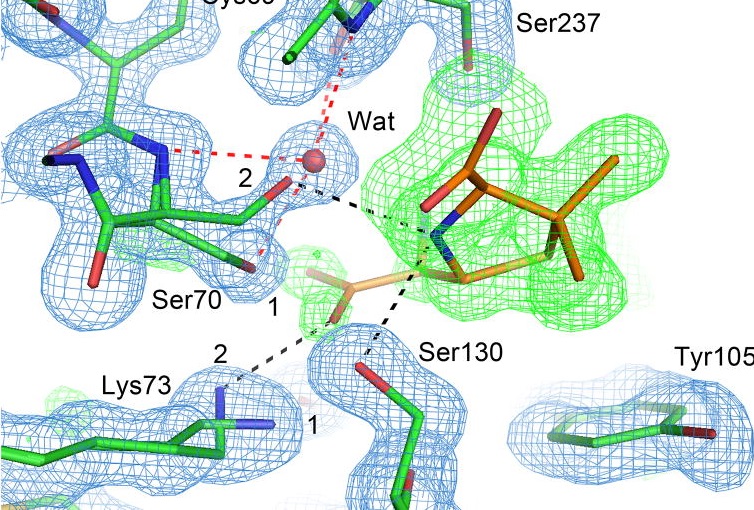
|
Каталитический серин формирует особую водородную связь типа LBHB (связь прочнее обычной водородной) с остатком LYS73. Эта связь имеет длинну 2,53 ангстрема, остаток лизина в ней несет положительный заряд, а серина – отрицательный. Также установлено, что pKa для LYS73 равен ~6, хотя нормальный – 9.(2) |
Лиганд индуцирует транспорт протона от каталитического серина к лизину. В ходе этого процесса и образуется LBHB связь. Связи такого типа также могут потенциально играть специальную структурную роль в белках.(3)
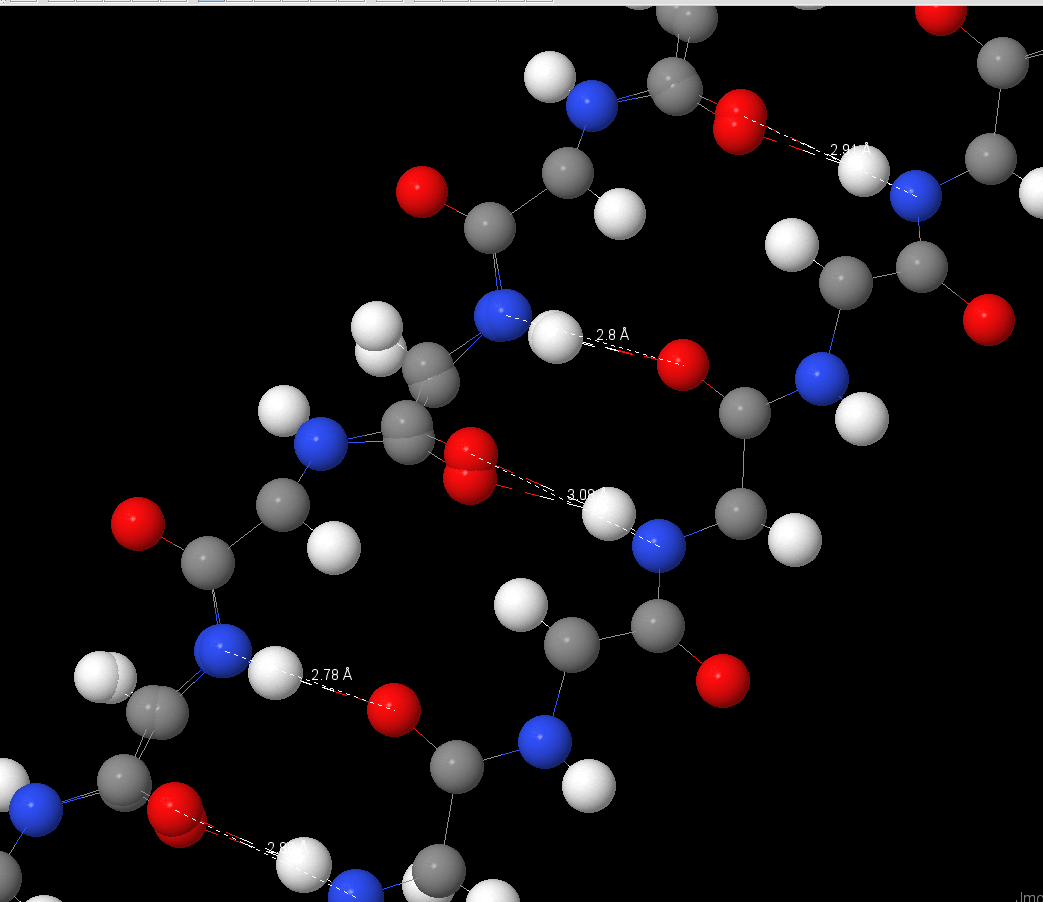
| Параметры водородных связей между остовными атомами во вторичной структуре | |||
| # | Имена атомов | Длина связи ( Å) | Угол N-Н-O(°) |
| Alpha-helix | |||
| 1 | N(32LYS)-O(28ALA) | 2,96 | 157,8 |
| 3 | N(34ALA)-O(30GLN) | 2,92 | 156,9 |
| 4 | N(38LYS)-O(34ALA) | 2,88 | 162,5 |
| 6 | N(40SER)-O(36LEU) | 2,94 | 140,6 |
| Beta-sheet | |||
| 1 | N(264TYR)-O(45GLY) | 2,88 | 164,9 |
| 2 | O(47ALA)-O(262VAL) | 2,96 | 158,3 |
| 3 | N(262VAL)-O(47ALA) | 2,88 | 171,0 |
| 4 | N(49ILE)-O(260VAL) | 2,85 | 164,6 |
| 5 | N(45GLY)-O(264TYR) | 2,78 | 167,1 |
| 6 | N(266THR)-O(43ARG) | 3,01 | 158,8 |
Список литературы:
2. PubMed Article 1, picture 2
4. Wikipedia
6. About hbonds in proteins (NCBI)
P.S. Jmol-апплет периодически неправильно отображает связи (дублирует водородные связи на бета-тяже), но в программе он этого не делает.