Практикум 3
Структура в целом
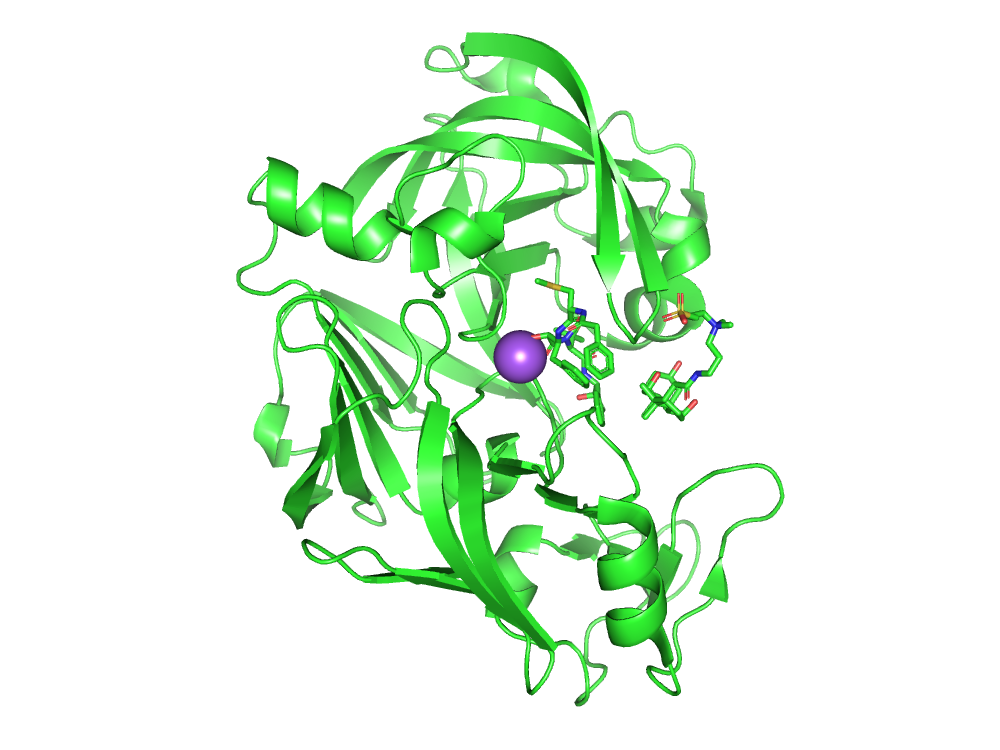
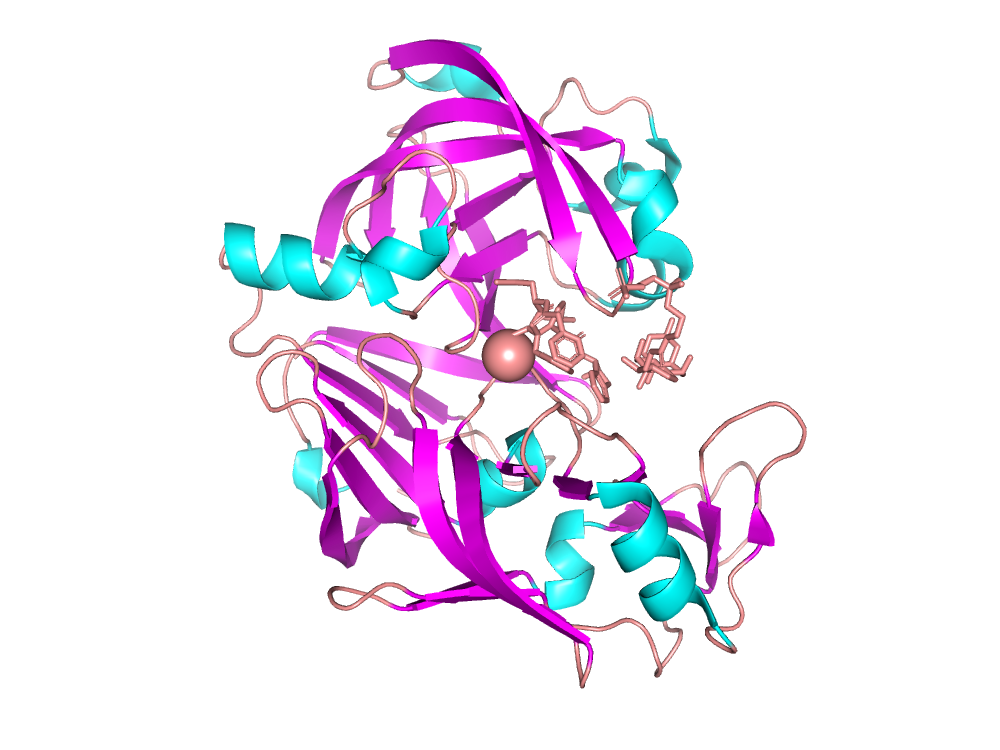
В данном практикуме рассмотрена структура белка 5YID.
В структуре данного белка присутсвует одна полимерная цепь, которая и составялет одну биологическую еденицу.
Данный белок имеет название Плазмепсин II (Plasmepsin II), был выделен из Plasmodium falciparum. Является ферментом, относящимся к классу гидролаз. Белок участвует в первых этапах катаболизма гемоглобина(Hb), что делает этот белок перспективной целью для разработки противомалярийных препаратов.
Uniprot id -Q8I6V3
Относительно референса из Uniprot в последовательности мутаций нет.
В составе цепи есть модифицированные аминокислотные остатки: фосфосерин в позициях 17,19,259 и фосфотреонин в позиции 20.
Малые молекулы
В записи присутствуют следующие малые молекулы:
- NA(ион натрия)PDB
- CPS(3-[(3-CHOLAMIDOPROPYL)DIMETHYLAMMONIO]-1-PROPANESULFONATE) PDB
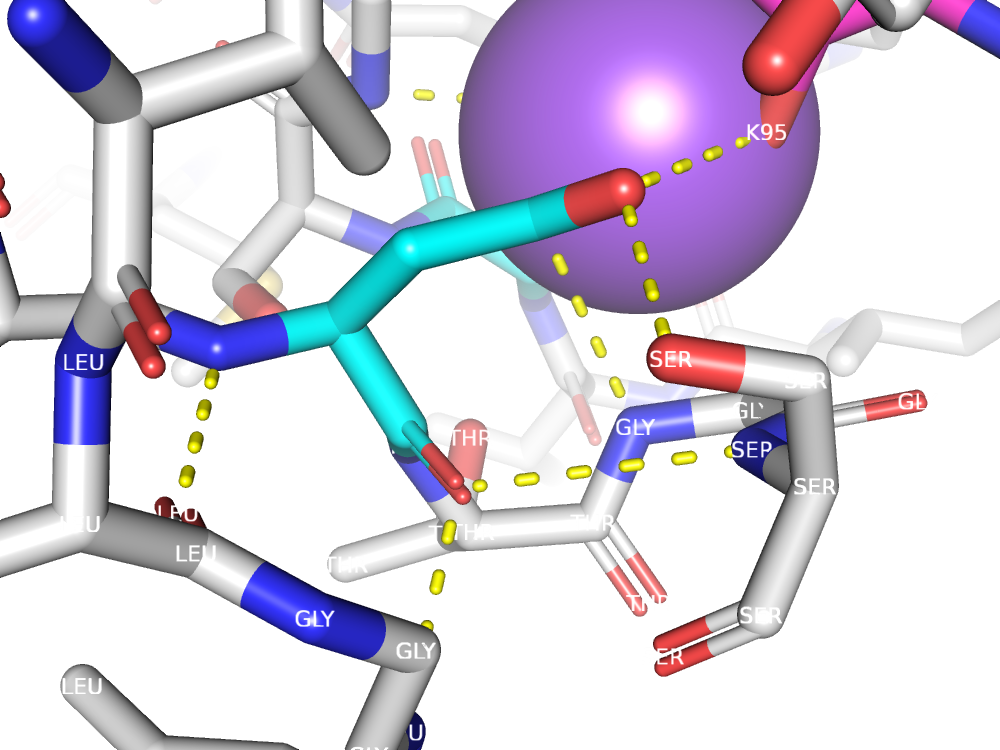
- K95((4R)-N-[(1S,2R)-2-hydroxy-2,3-dihydro-1H-inden-1-yl]-3-[(2S,3S)-2-hydroxy-3-{[S-methyl-N-(phenylacetyl)-L-cysteinyl]ami no}-4-phenylbutanoyl]-5,5-dimethyl-1,3-thiazolidine-4-carboxamide) PDB
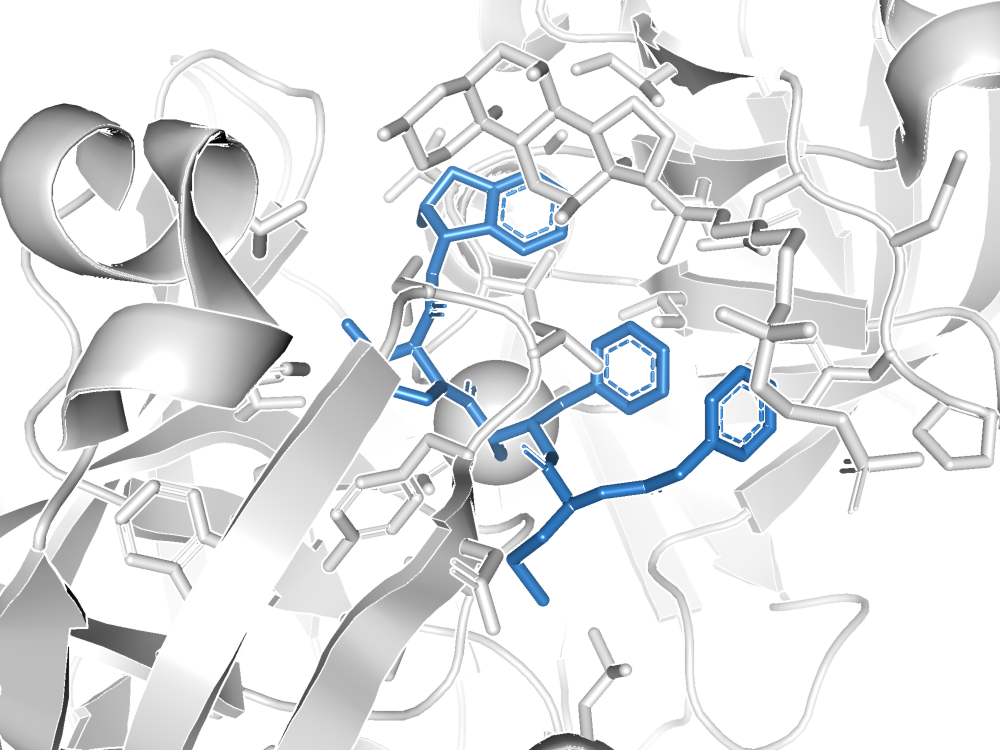
Согласно статье (ссылка) молекула K95,присутствующая в структуре является ингибитором,активность которого и является целью исследования.
Интересно, что наличие иона натрия в структуре вероятнее всего связано с высокой концентрацией ионов натрия в буфере кристаллизации, который содержит 1,4 м цитрата натрия. Однако в комплексах PMII-KNI-1073, PMII-KNI-10333 и PMII-KNI-10343 (структуры, анализируемые в этом же исследовании) не присутствует ион натрия, так как они были кристаллизованы в условиях без натриевой соли.
Практикум 4
pH окружения белка-7.5
Практикум 5
Белок 5YID осуществляет гидролиз связей, связывающих определенные гидрофобные остатки в гемоглобине или глобине. Также расщепляет субстраты малых молекул, такие как Ala-Leu-Glu-Arg-Thr-Phe-|-Phe(NO2)-Ser-Phe-Pro-Thr.
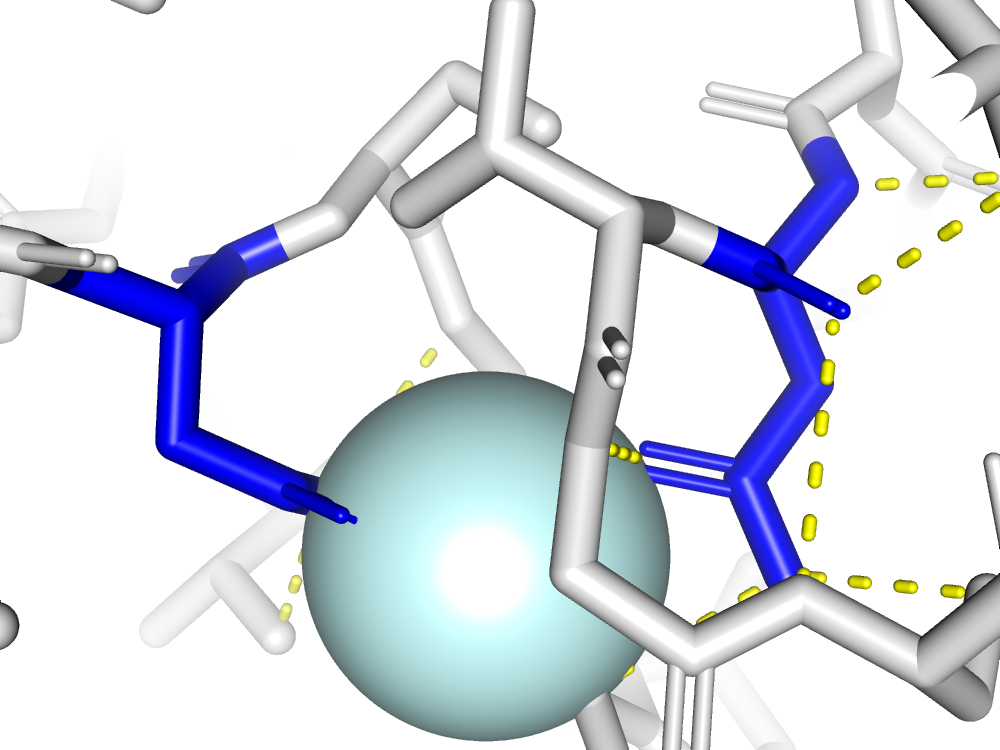
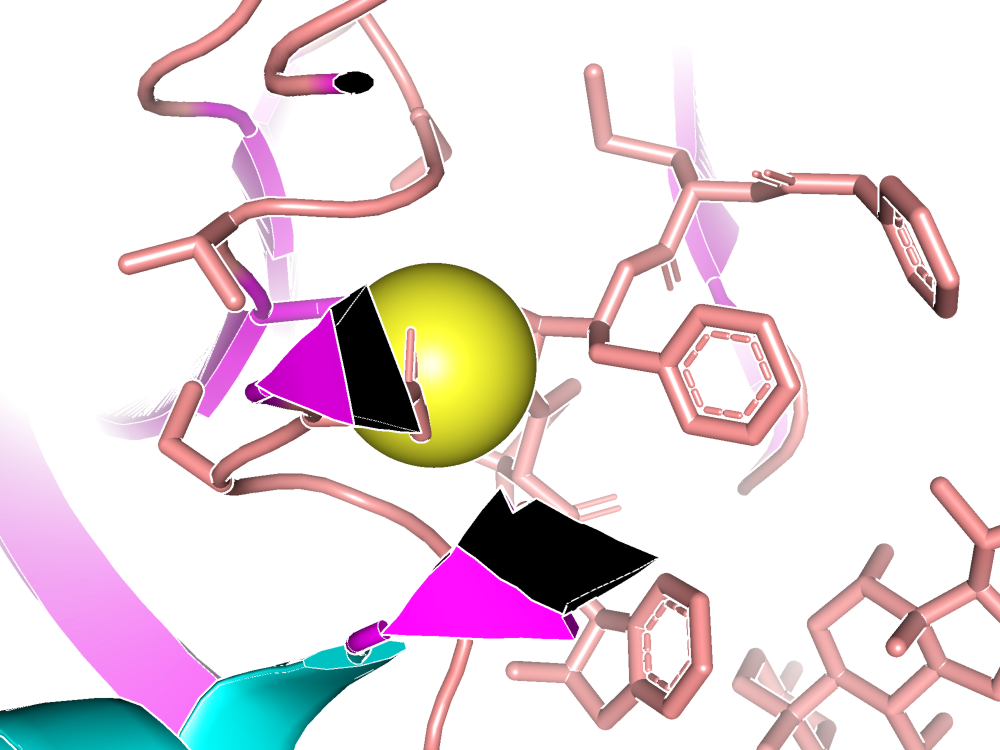
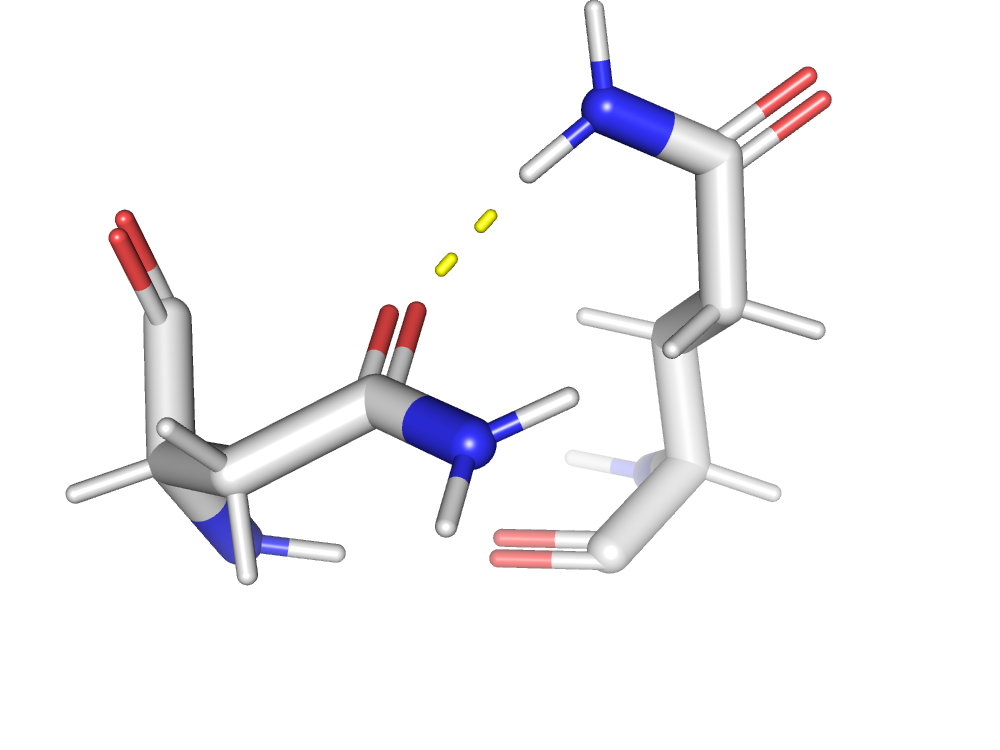
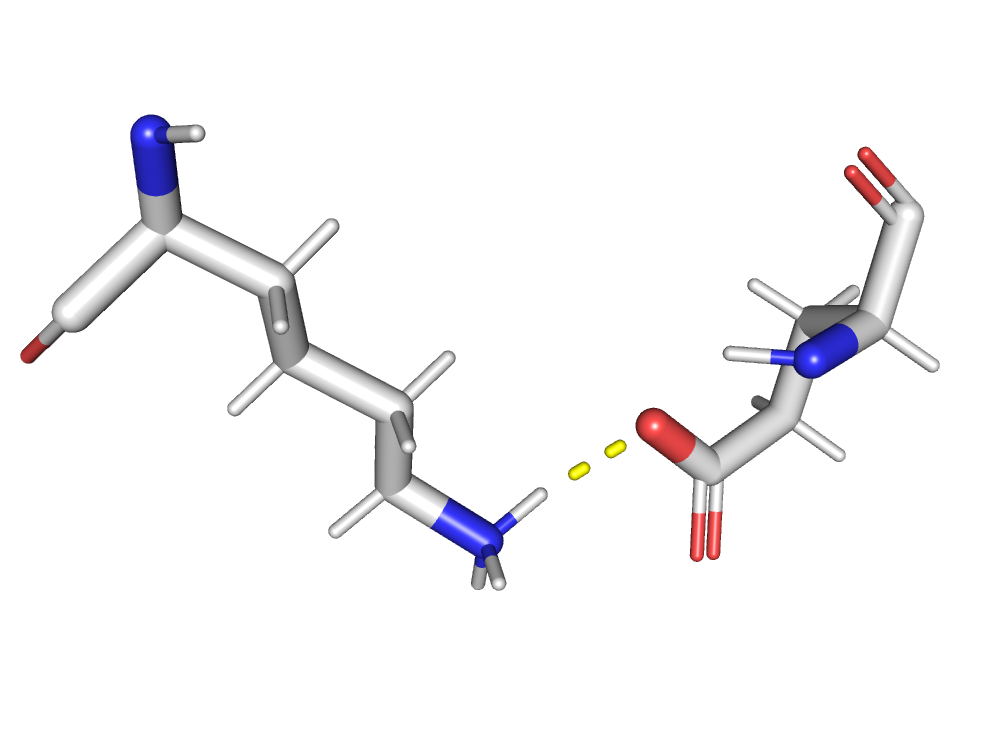
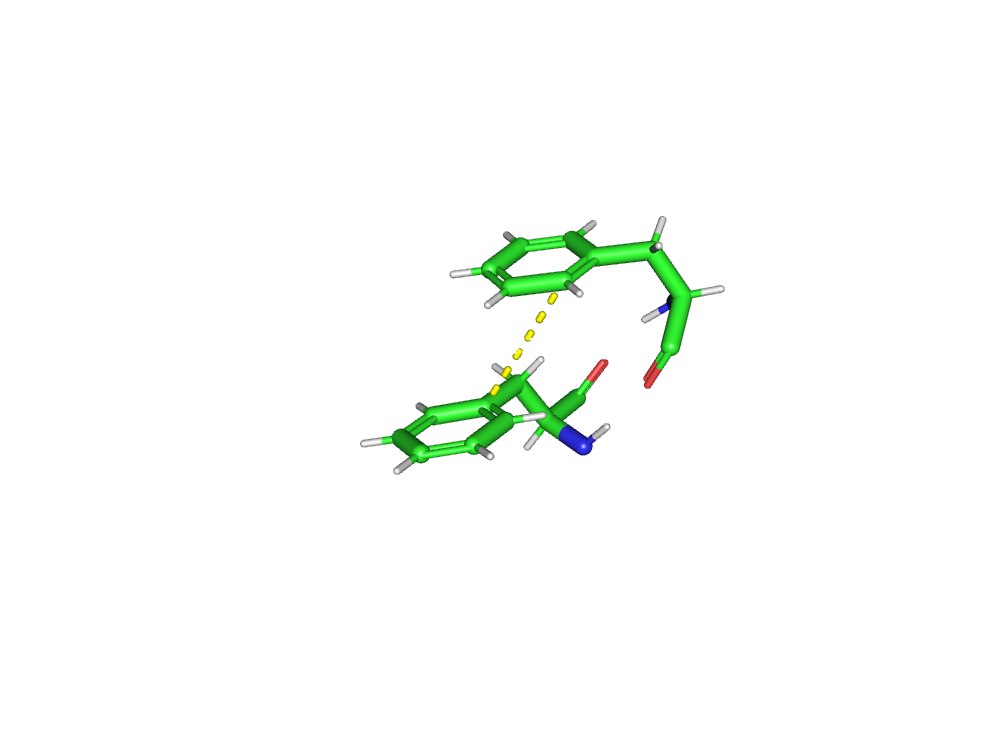
В активном центре фермента находятся 2 аминокислоты: Asp36 и Asp216.
Asp36 связан с гидроксильной группой К95(ингибитор), Ser39, Leu126, Leu128, Gly38.
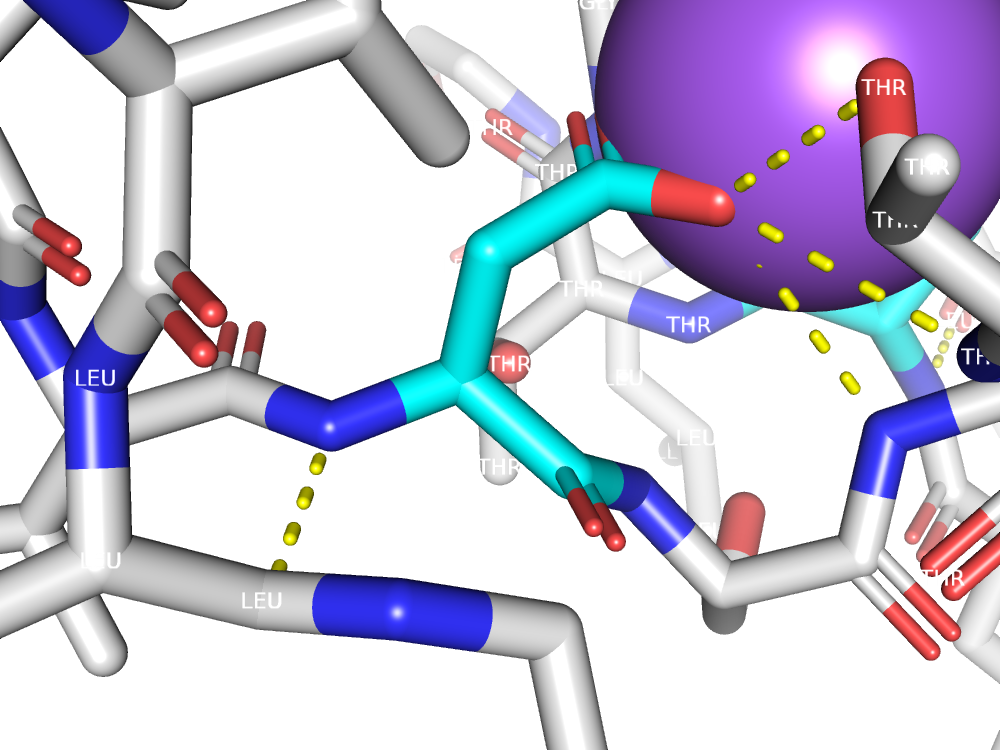
Asp216 связан с Leu303, Thr219.
Ингибитор связывается близко с активным центром.
Центральная гидроксильная группа ингибитора связана с каталитическим аспартатом(Asp36), что возможно и является причиной нарушения каталитической функции фермента.