Краткое описание структуры в файле 1rio.pdb
В файле приведены координаты атомов следующих молекул:
1. Две молекулы ДНК (цепи T, U)
2. Сигма фактор SIGA (цепь Н) (Thermus aquaticus) (UNP: Q9EZJ8_THEAQ)
3. Фрагмент сигма региона 4
4. Репрессор белка СI(цепи А, В) (Bacteriophage lambda) (UNP: RPC1_LAMBD)
5. Фрагмент CI-N-концевого домена
Для исследования были выбраны H-цепь белка и цепи T, U, представляющие ДНК со следующей последовательностью:
В файле pdb представлен сигма фактор Рнк полимеразы - фактор инициирования, способствующий прикреплению (а затем и освобождению)РНК-полимеразы к определенным сайтам.
Торсионные углы ДНК , среднее значение, наиболее отклоняющиеся нуклеотиды выделены цветом.
Это: G7, C28 в цепи U и C7, C18 в цепи T. И вообще, для всех углов характерно достаточно большое отклонение,
поэтому можно предположить, что связь ДНК с белком приводит к некоторой деформации. Возможно, за счет этого достигается выигрыш в энергии, большая стабильность структуры.
В итоге: во-первых, полярных взаимодействий меньше, чем неполярных.
Во-вторых, белок взаимодействует с фосфатами больше, чем с сахаром.
Возможно,то обусловлено тем, что фосфаты находятся снаружи спирали.
В-третьих, что касается большой и малой бороздки, то контактов больше с ао, направленными в сторону большой бороздки.
Возможно, это связано с глубиной большой бороздки.
Результаты, полученные от программы, несколько отличаются от моих результатов.
Одна из причин этого то, что по условию я рассматривала только цепь H, а программа все цепи белка.
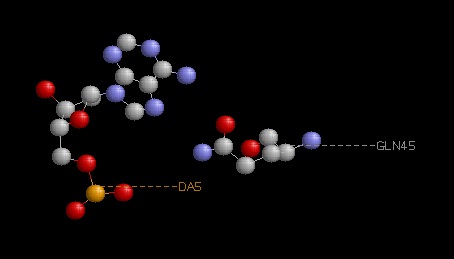
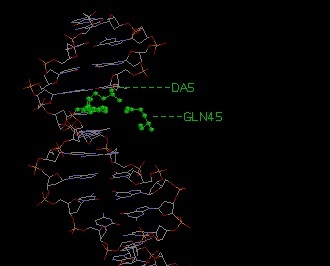
Распознающим является контакт A5:U - Gln45:A, так как мало того, что он образован между азотистым основанием
(а не фосфорным остовом)и аминокислотным остатком, так к тому же в его образовании участвуют 2 водородные связи. Изображение полной доменной структоры ДНК-связывающего белка RNA polymerase sigma factor
Название Днк-связывающего домена IPR007630 RNA polymerase sigma-70 region 4.
Аннотация в InterPro:
цепь T [1] CGGTATCACCGCCAGTGCTTGACATGG [27]
|||||||||||||||||||||||||||
цепь U [27] GCCATAGTGGCGGTCACGAACTGTACC [1]
1 и 27 - номера первого и последнего нуклеотида.
Функции белка, структура которого представлена в файле 1rio.pdb
Исследование структуры ДНК
Исследование природы ДНК-белковых контактов
Контакты разного типа в комплексе 1rio.pdb
Контакты атомов белка с
Полярные
Неполярные
Всего
остатками 2'-дезоксирибозы
0
22
22
остатками фосфорной кислоты
24
11
35
остатками азотистых оснований со стороны большой бороздки
16
35
51
остатками азотистых оснований со стороны малой бороздки
1
1
2
Получение популярной схемы ДНК-белковых контактов с помощью nucplot
Возможный распознающий контакт
Характеристика ДНК-связывающего домена IPR007630 RNA_pol_sigma70_r4 Q9EZJ8_THEAQ

The bacterial core RNA polymerase complex, which consists of five subunits, is sufficient for transcription elongation and termination
but is unable to initiate transcription. Transcription initiation from promoter elements requires a sixth, dissociable subunit called a
sigma factor, which reversibly associates with the core RNA polymerase complex to form a holoenzyme [1]. RNA polymerase recruits alternative
sigma factors as a means of switching on specific regulons. Most bacteria express a multiplicity of sigma factors. Two of these factors,
sigma-70 (gene rpoD), generally known as the major or primary sigma factor, and sigma-54 (gene rpoN or ntrA) direct the transcription of a
wide variety of genes. The other sigma factors, known as alternative sigma factors, are required for the transcription of specific subsets of genes.
With regard to sequence similarity, sigma factors can be grouped into two classes, the sigma-54 and sigma-70 families. Sequence alignments
of the sigma70 family members reveal four conserved regions that can be further divided into subregions eg. sub-region 2.2, which may be involved
in the binding of the sigma factor to the core RNA polymerase; and sub-region 4.2, which seems to harbor a DNA-binding 'helix-turn-helix' motif involved
in binding the conserved -35 region of promoters recognised by the major sigma factors [2, 3].
Region 4 of sigma-70 like sigma-factors is involved in binding to the -35 promoter element via a helix-turn-helix motif [4].
Due to the way Pfam works, the threshold has been set artificially high to prevent overlaps with other helix-turn-helix families.
Therefore there are many false negatives.