|
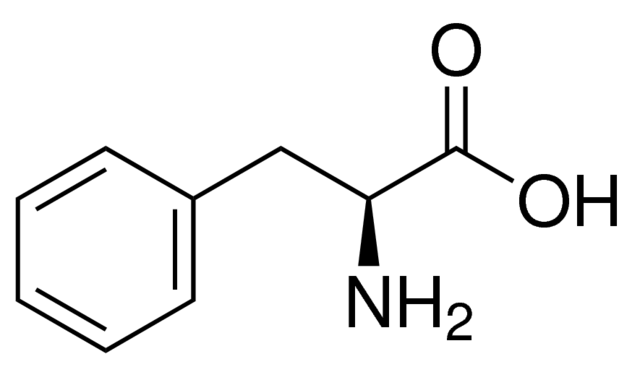
На рисунке справа представлена двумерная структура L-фенилаланина, который относится к ароматическим α-аминокислотам [2]. Как видно, радикалом этой аминокислоты является
-CH 2-C 6H 5. В силу того, что радикалом является бензильная группа, которая проявляет гидрофобные и инертные свойства, сама аминокислота является
нейтральной молекулой. Фенилаланин является прекурсором множества молекул, таких как тирозин, норадреналин, адреналин... Фенилаланин является незаменимой аминокислотой, поэтому
не синтезируется de novo в организме человека. Что касается синтеза аминокислоты, сейчас большой популярностью пользуется коммерческий синтез фенилаланина геномодифицированными бактериями
E. coli [5].
|
Последовательность скрипта Titles.
| Таблица 1. Некоторые свойства L-фенилаланина [3] |
| Физико-химические свойства | | Общая информация | |
| Плотность | 0.754 г/см3 | Название на русском | Фенилаланин |
| Химическая формула | C6H5-CH2-СH(NН2)-СООН | Трехбуквенный код | Phe |
| Брутто-формула | C9H11NO2 | Однобуквенный код | A |
| Молярная масса | 165.18914 г/моль | Кодирующие кодоны РНК | UUU, UUC |
| Растворимость в воде | 26.9 г/л | Название по номенклатуре IUPAC | 2-амино-3-фенилпропановая кислота |
| Стандартное состояние | Белое кристаллическое | Идентификатор PubChem | CID 6140 |
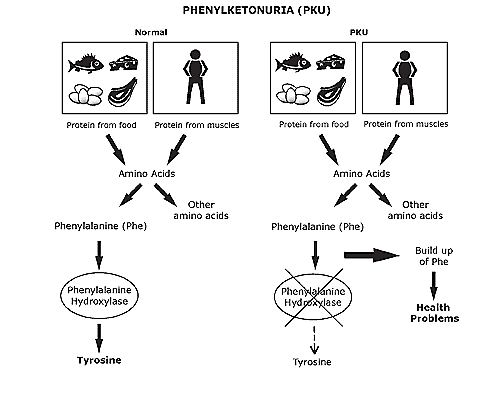 |
| Рис. 1. Схема фенилкетонурии (Источник).
|
Справа приведена схема развития фенилкетонурии (ФКУ)
[1]. Это врождённое заболевание, возникающее при полном или частичном отсутствии активности фермента фенилаланин гидроксилазы.
Таким образом еда богатая протеинами является опасной для людей, болеющих ФКУ.
|
Некоторый очерк о pH L-фенилаланина.
Протонированная форма аминокислоты наблюдается при значении pH < 1.83, при этом наблюдается заряд по NH3+-группе, COOH-группа остаётся незаряженной. При pH = 1.83 у L-фенилаланина
заряжены NH3+-группа и COO--группа, то есть молекула находится в состоянии цвиттер-иона. Заряд только по COO--группе характерен для L-фенилаланина, начиная со
значения pH 9.13.
|
Последовательность скрипта pKa 1.83.
Последовательность скрипта pKa 9.13.
Последовательность скрипта pH < 1.83.
|
| Таблица 2. Белок-белковые взаимодействия |
| Водородные связи | Пептидные связи/гидрофобные взаимодействия |
| Связывание через остовный H | Связывание через остовный O | Остов/остов |
|
|
|
|
|
|
|---|
| Scriptmegafile! |
|---|
|
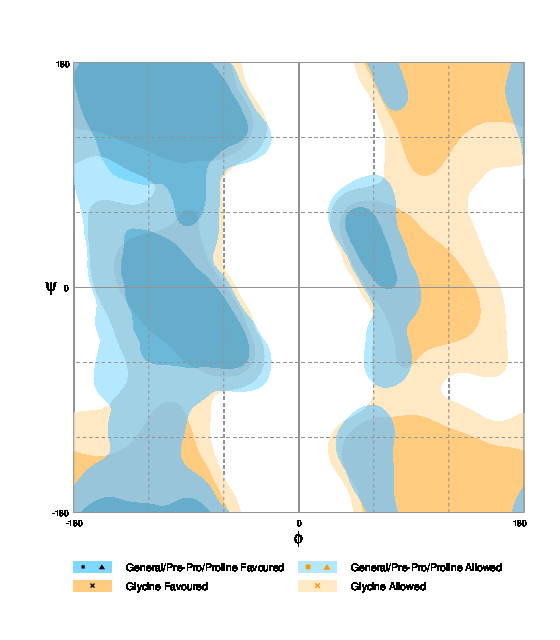 |
| Рис. 2. Карта Рамачандрана для фенилаланина (Источник).
|
Белок-белковый контакт является специфическим физическим контактом между 2 и более белками, возникающий как результат
биохимических реакций и/или электростатических взаимодействий. Яркими примерами белок-белковых контактов являются: гомо-олиго(поли)меры/гетеро-олиго(поли)меры,
стабильные комплексы, ковалентные/нековалентные комплексы.
Факторы, которые регулируют белок-белковые взаимодействия:
- Концентрация белка
- Аффинность белка
- Концентрация лиганда
- Электрические поля вокруг белка
- Присутствие других белков, ионов, нуклеиновых кислот...
Радикал фенилаланина не способен образовывать водородные, ионные связи. Однако, способен участвовать в образовании гидрофобных связей, благодаря отсутствию в структуре радикала
сильно электроотрицательных атомов. Также можно отметить наличие бензильной группы в составе радикала, что говорит о принадлежности данной аминокислоты к аромтаическим аминокислотам.
Взаимодействие радикала фенилаланина и молекулы ДНК не обнаружено. Это также подтверждается и теорией. Радикал фенилаланина гидрофобен, неполярен, значит
не способен взаимодействовать с заряженным молекулой ДНК.
Источники информации:
[1]: Toxnet
(Источник)
[2]: Wikipedia
(Источник)
[3]: PubChem
(Источник)
[4]: RCSB
(Источник)
[5]: NCBI
(Источник)