
|
Учебный сайт Алены Корягиной |

|
Главная |
Oбо мне |
Cеместры |
Cсылки |
Лиганды в структуре белка VirB4 АТФазы (идентификатор PDB 4AG5)
В биологическую единицу белка VirB4 АТФазы, содержащей цепи В и С, помимо молекул белка входят еще молекула АДФ, ионы магния, молекулы глицерола и воды. (рис.1). Рисунок взят из прaктикума "Jmol. Трехмерная структура белка АТФазы VirB4 из генома бактерии Thermoanaerobacter pseudethanolicus, штамм ATCC 33223".
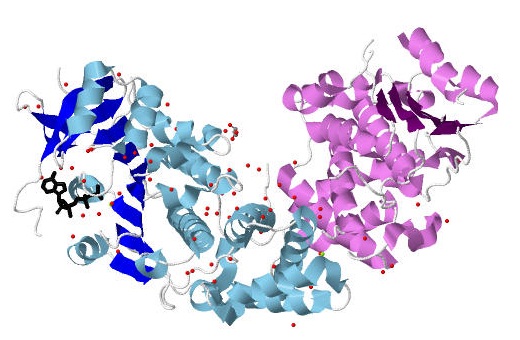
|
Рис.1. Графическое представление биологической единицы, состоящей из цепей B и C. Цепь В — голубая, С — сиреневая. Более светлым оттенком покрашены α-спирали, более темным — β-листы, серым выделены участки цепи белка, которые не имеют вторичной структуры. Черной проволочной моделью представлена молекула АДФ. Атомы молекул глицерола, воды, ионов магния и сульфат-ионов представлены в виде уменьшенных и раскрашенных в соответствии с химической природой сфер, между которыми показаны химические связи. Рисунок получен с помощью программы Jmol.
Наш белок VirB4 АТФазы относится к группе ферментов класса гидролаз, катализирующих отщипление с освобождением энергии одного или двух остатков фосфорной кислоты от аденозинтрифосфата (АТФ). Также вспомним, что этот белок является компонентом секреторной системы IV типа, то есть принимает участие в секреции бактерии T. Pseudethanolicus. А собственно для секреции, то есть для переноса белков через цитоплазматическую мембрану, необходима энергия. Следовательно, наш фермент играет роль «добытчика» энергии для секреции бактерии.
Чаще всего АТФ связан в комплексе с ионом магния, то есть для ферментов в качестве субстрата выступает не молекула АТФ, а комплекс Mg2+—ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента [1].
Для рассматриваемой структуры белка субстратом является комплекс аденозиндифосфата или АДФ (англ. adenosine diphosphate, ADP) с ионом магния (Mg2+). Поэтому далее будет рассмотрена область контакта c лигандом (AДФ—Mg2+) в структуре белка VirB4 АТФазы.
Область контакта c лигандом AДФ—Mg2+ в структуре белка VirB4 АТФазы (идентификатор PDB 4AG5)
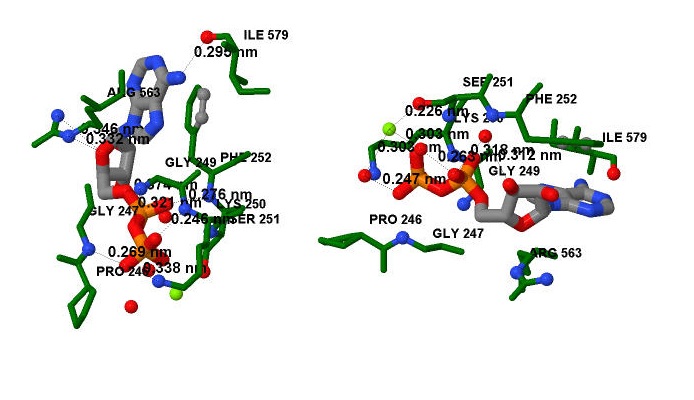
Лиганд АДФ окружают 8 аминокислот: pro 246, gly 247, gly 249, lys 250, ser 251, phe 252, arg 563, ile 579. Они входят в состав активного центра фермента. Активный центр — совокупность аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата, и принимающая прямое участие в акте катализа. На рисунке 1 эти аминокислоты показаны зеленым цветом в проволочной модели, а атомы непосредственно учавствующие в образовании связи (атомы пролина не образуют связь с лигандом) — в шариковой модели с окраской по типам атомов. Так же с остатками фосфорной кислоты в молекуле АТФ связан ион магния (салатовый шарик). Помимо этого с нуклеотидом взаимодействуют три молекулы воды (красные шарики).
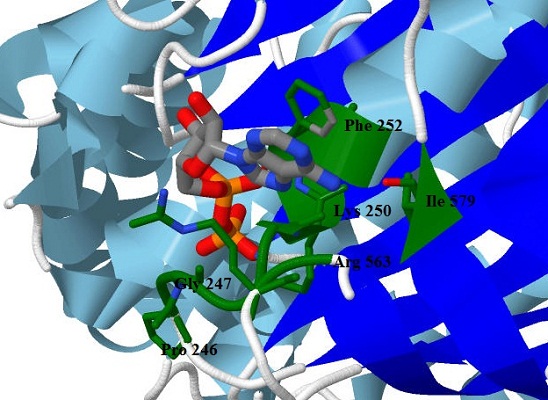
На рисунке 2 видно, к каким вторичным структурам остносятся взаимодействующие аминокислоты. Аминокислота ile 579 расположена в начале тяжа β-листа, аминокислоты ser 251, phe 252 и lys 250 учавствуют в образовании α-спирали, а все остальные аминокислоты (pro 246, gly 247, gly 249, arg 563) не принимают участие в формировании втроричных стуктур.
Стоит обратить внимание, что молекула субстрата «ложится» в углубление образованное аминокислотами 249-251, а по бокам как бы «обхватывается» 246, 247 , 252 и 563 аминокислотами.
|
|
Рис.1. Субстрат (АДФ—Mg2+) и аминокислоты из белка VirB4 АТФазы взаимодействующие с ним. На комплексе, расположенном левее, показаны все связи, образованные между аминокислотами и АДФ, на косплексе, расположенном правее, - связи с водой и ионом магния. Молекула АДФ показана в толстой проволочной модели, с окраской по типу атомов. Ион магния представлен салатовым шариком. Аминокислоты взаимодействующие с субсратом представлены в проволочной модели с зеленой окраской, а атомы непосредственно образующие связь — в полноатомной модели с окраской по типу атомов. Черным пунктиром обозначены водородные связи. Рисунок получен с помощью программы Jmol. |
Рис.2. Остов белка представлен в виде ленточной модели. Раскраска цепей: цепь А — оранжевая, цепь В — голубая, С — сиреневая и D — зеленая. Более светлым оттенком покрашены α-спирали, более темным — β-листы, серым выделены участки цепи белка, которые не имеют вторичной структуры.Рисунок получен с помощью программы Jmol. |
Для визуализации перовго рисунка использовался скрипт: посмотреть, скачать, для визуализации второго рисунка использовался скрипт: посмотреть, скачать.
Источники:
[1] http://www.biochemistry.ru/biohimija_severina/B5873Part15-83.html
Дата последнего изменения: 29.05.2014