
|
Учебный сайт Алены Корягиной |

|
Главная |
Oбо мне |
Cеместры |
Cсылки |
Мембранные белки
Мембранные белки – белки встроенные или ассоциированные с клеточной мембраной или мембраной клеточной органеллы. В зависимости от вторичной структуры белка трансмембранные белки делятся на несколько классов. Далее будет рассмотрен представитель класса поли α-спиральных белков Ca2+-АТФаза Е2 (идентификатор 4uu0). Этот белок (рис.1) был получен из Oryctolagus cuniculus (дикого кролика), он располагается в мембране эндоплазматического ретикулума (ЭПР). Толщина липидного бислоя 30.4 Å. Среднее количество остатков в трансмембранной части белка 10 α-спиралей из 218 остатков. Ca2+-АТФаза Е2 принимает участие в транспорте ионов кальция и через мембрану ЭПР и требует затраты энергии АТФ.
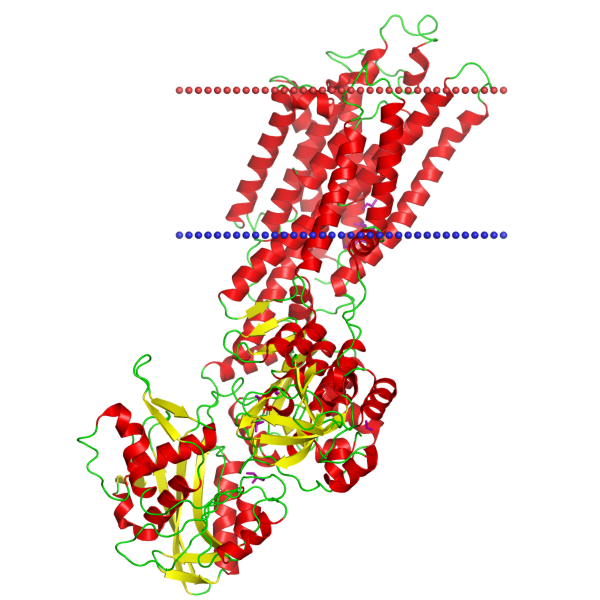
|
Рис.1. Белок Ca2+-АТФаза Е2 (идентификатор 4uu0) Красными шариками обозначена внешняя или р-сторона мембраны ЭПР, синими – внутренняя или n-сторона мембраны. Рисунок получен с сайта БД ОРМ.
С помощью алгоритма pblast на сайте NCBI был проведен поиск гомологов белка Ca2+-АТФазы. Поиск проводился по БД Swissprot по трем доменам (Bacteria, Archaea, Eukaryotes). При поиске среди эукариот был исключен тип Chordata, в который входит Oryctolagus cuniculus. Из 10 белков эукариот, 6 белков бактерий и 2 белков архей была составлена репрезентативная выборка гомологов для рассматриваемого белка (скачать файл с последовательностями гомологов). Каждый белок имеет разумное значение E-value и значение Ident не ниже 35%. Для полученной выборки с помощью программы muscle на сервере kodomo было построено множественное выравнивание (рис.3,4). Все последовательности выровнены хорошо, кроме последней. Она соответствует белку Сu+-АТФазе В из археи Archaeoglobus fulgidus DSM 4304.
С последовательностью исследуемого белка была ассоциирована его трехмерная структура (рис.5). На основании получившейся связи, а также, используя информацию, полученную с сайта БД ОРМ, в дополнительной аннотации TM_REAL были отмечены символом «М» участки выравнивания, отвечающие трансмембранным участкам спиралей в белке, а символом «h» продолжение этих же спиралей, расположенные вне мембраны. Также для одного из гомологов, а именно для белка из растения Arabidopsis thaliana (Резуховидка Таля), последовательность которого пятая сверху, с помощью программы TMHMM было получено предсказание трансмембранных участков спиралей: 66-83, 93-115, 265-283, 316-338, 797-819, 858-880, 984-1006, 1021-1040 (рис.2). В аннотацию TM-PREDICTED были внесены эти предсказания.
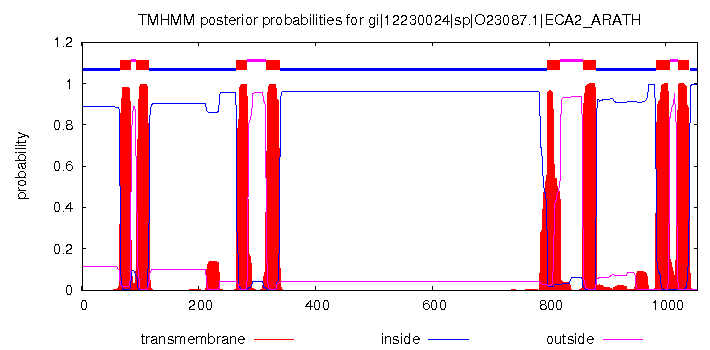
|
Рис.2. График предсказания трансмембранных участков для одного из гомологов для белка Ca2+-АТФазы Е2. Рисунок получен с сервера TMHMM.
Шесть трансмембранных спиралей гомолога с небольшим различием в границах были предсказаны довольно достоверно. Граница одной из спиралей (4 по счету слева) различается довольно сильно: предсказано на 14 аминокислот (позиции 393-406), входящих в трансмембранное пространство, больше. При более подробном рассмотрении было выявлено, что аминокислоты этих позиций принадлежат спирали, которая в структуре первоначального белка находится в пространстве внутри клетки, но в силу возможных различий в структуре между исследуемым белком и его гомологом, можно предположить, что данная предсказанная спираль может принимать трансмембранное положение. Обилие гидрофобных остатков в этой спирали не противоречит возможности вхождения этой спирали в трансмембранное пространство. Еще одна спираль предсказана как объединение двух спиралей из реальной структуры (позиции 1105-1129). Одна спираль, позиции которой 1263-1282, предсказана не была. Причины этого мне неизвестны.

|
Рис.3. Выравнивание гомологов белка Ca2+-АТФазы Е2 из Oryctolagus cuniculus. Первая строчка соответствует последовательности самого белка. Цветовая схема: Clustalx. В аннотации TM_REAL символом «М» обозначены участки выравнивания, отвечающие трансмембранным участкам спиралей в белке Ca2+-АТФазы Е2, а символом «h» продолжение этих же спиралей, расположенные вне мембраны. В аннотации TM_PREDICTED – символом «М» предсказанные с помощью программы TMHMM трансмембранные участки спиралей для одного из гомолога (5 последовательность). Рисунок получен с помощью Jalview.

|
Рис.4. Выравнивание гомологов белка Ca2+-АТФазы Е2 из Oryctolagus cuniculus. Первая строчка соответствует последовательности самого белка. Цветовая схема: Hydrophobicity. Значение Above Identity Threshold 4035%. В аннотации TM_REAL символом «М» обозначены участки выравнивания, отвечающие трансмембранным участкам спиралей в белке Ca2+-АТФазы Е2, а символом «h» продолжение этих же спиралей, расположенные вне мембраны. В аннотации TM_PREDICTED – символом «М» предсказанные с помощью программы TMHMM трансмембранные участки спиралей для одного из гомолога (5 последовательность). Рисунок получен с помощью Jalview.
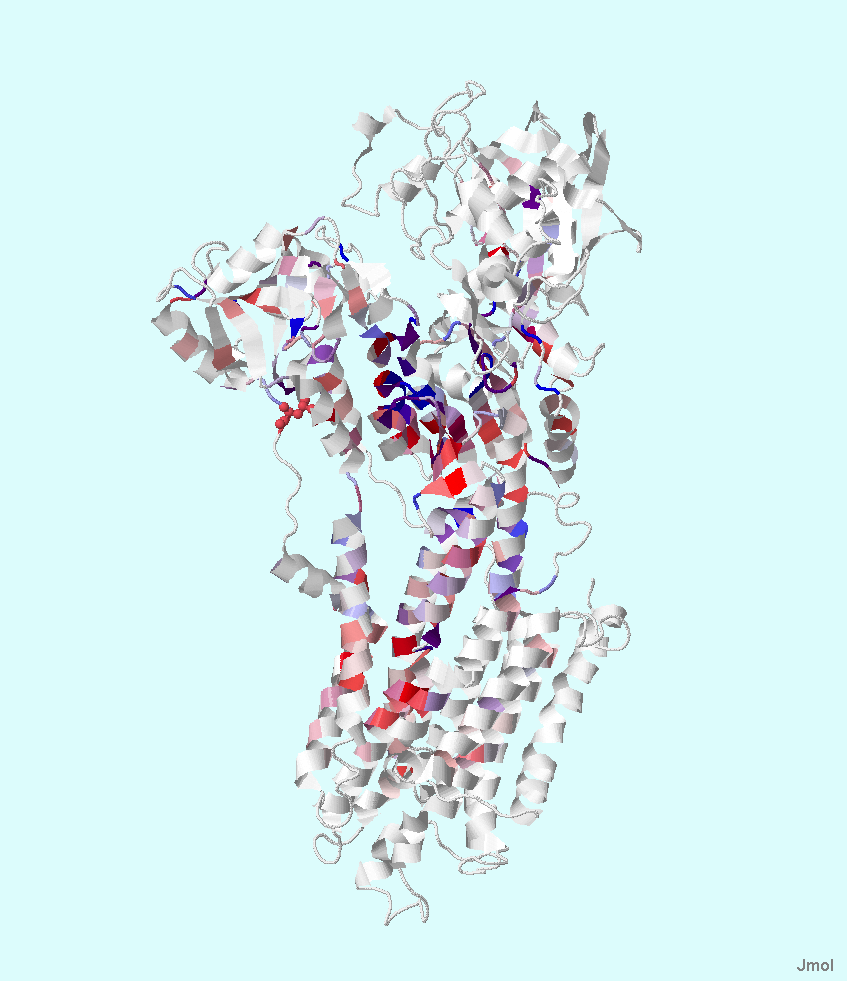
|
Рис.5. Структура белка Ca2+-АТФаза Е2. Цвета соответствуют цветовой схеме Hydrophobicity. Значение Above Identity Threshold 4035%. Часть белка, ориентированная в n-сторону направленна вверх, а в p-сторону – вниз. Рисунок получен с помощью Jalview.
При общем анализе выравнивания (рис.3,4) и полученных данных о вхождении некоторых участков в трансмембранное пространство можно сделать следующие выводы. Для четырех α-спиралей участки, относящиеся к трансмембранным спиралям относительно консервативны: позиции 93-103, 158-170, 331-349, 384-406 (рис. 5), а для оставшихся консервативность не наблюдается. Между спиралями есть консервативные участки, например, 207-251, 279-312, 322-349, 411-448, 904-952, 1008-1091.
Мембрана предоставляет гидрофобное окружение молекулам, погруженным в нее, поэтому в основном трансмембранные спирали составляют гидрофобные остатки, чаще валин (V), анилин (A), лейцин (L) и изолейцин (I). Но заряженные или просто полярные остатки также встречаются, причем по некоторым позициям они даже консервативны. Например, позиции 133, 1358, 1374, 1375 консервативны по отрицательно заряженным остаткам: аспарагиновой (D) и глутаминовой (E) кислотам, а 1170 по положительно: лизину (K) и аргинину (R), позиции 394, 1104, 1120, 1275 консервативны только по Е остатку, позиция 1095 по R, а позиция 1378 только по К. Среди незаряженных, но полярных остатков встречаются аспарагин (N), относительно консервативные позиции: 164, 1101, 1131, 1366, глутамин (Q): 1126, серин (S) и треонин (T): 336, 401, 402, 1183, 1265, 1269, 1313, 1366. Содержание внутри мембраны групп, способных образовывать водородные связи, энергетически невыгодно, поэтому для того, чтобы скомпенсировать их водородные связи образуются внутри трансмембранного домена, между спиралями, помещая таким образом полярные и заряженные остатку вглубь домена, и, окружая их гидрофобными остатками.
Скачать проект в формате .jvp.
Дата последнего изменения: 03.04.15