Учебный сайт Алены Корягиной |

|
Главная |
Oбо мне |
Cеместры |
Cсылки |
Интерпретация ЯМР структуры
Для сравнения структур, расшифрованных с помощью ренгено-структурного анализа (РСА) и с помощью ядерного магнитного резонанса (ЯМР), была выбрана структура сериновой протеазы из Bacillus subtilis. Идентификатор для структуры, исследованной методом РСА — 1IAV(разрешение 1.8Å), ЯМР — 1AH2 (18 моделей).
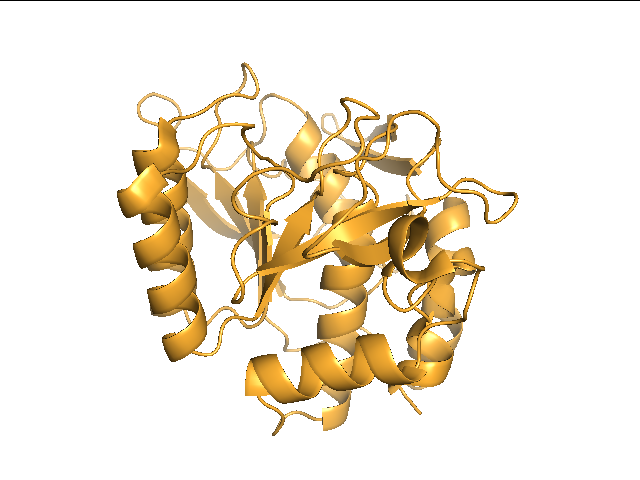
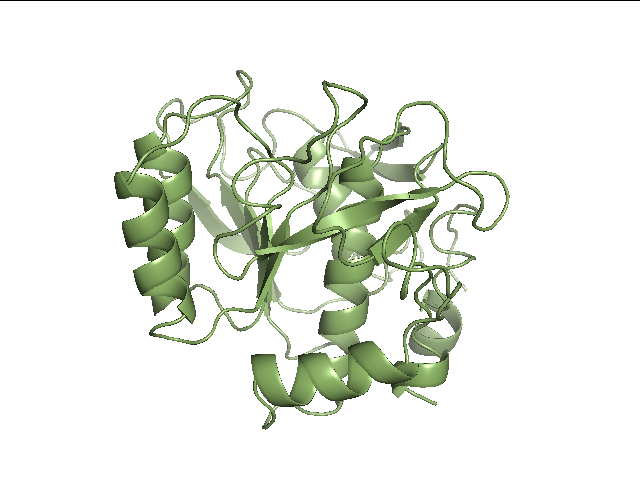
На взгляд укладки РСА (рис.1) и ЯМР (рис.2) структур сходны, заметны только различия в неструктурированных областях белка, а основные элементы вторичных структур похожи.
|
|
Рис.1. Структура сериновой протеазы из Bacillus subtilis, расшифрованная методом РСА (1IAV). Разрешение структуры 1.8Å.Изображение получено с помощью программы pymol. |
Рис.2. Структура сериновой протеазы из Bacillus subtilis, расшифрованная методом ЯМР (1AH2). Изображена первая модель из 18. Изображение получено с помощью программы pymol. |
Далее было проведено сравнение трех различных водородных связей:
1) остовной водородной связи в α-спирали в ядре белка между валином 244 и аспарагином 248 (рис.3),
2) водородной связь неструктурированного участка в ядре белка между лейцином 75 и аспартатом 41 (рис.4),
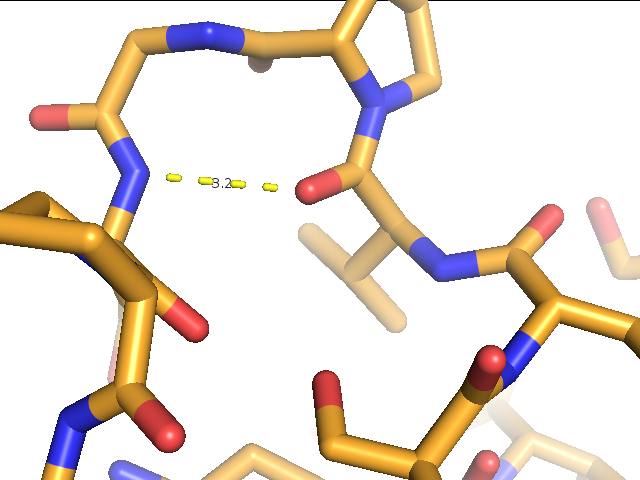
3) водородной связи в петлях, выходящих на поверхность глобулы, глутаматом 54 и валином 51 (рис.5).
Связь третьего типа не обнаружена ни в одной ЯМР структуре белка.
А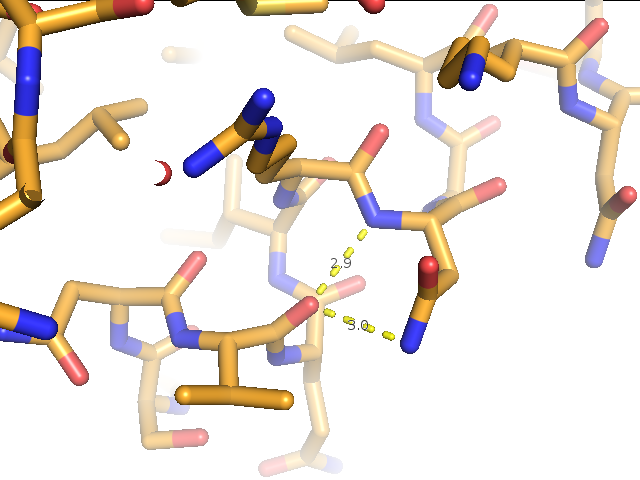 Б Б 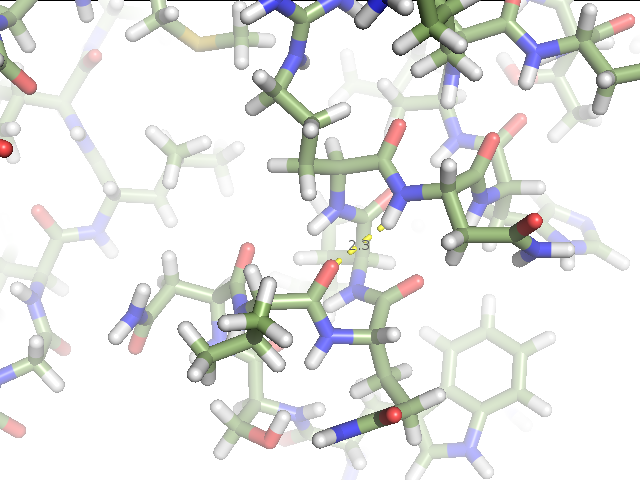
|
|
Рис.3. Остовная водородная связь в α-спирали в ядре белка между валином 244 и аспарагином 248. (А) Водородная связь в структуре, расшифрованной методом РСА (1IAV). (Б) Водородная связь в структуре, расшифрованной методом ЯМР (1AH2). Изображение для первой модели. Изображение получено с помощью программы pymol. |
А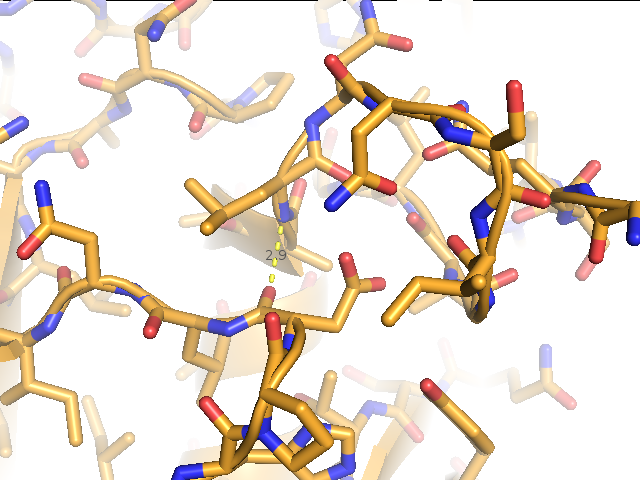 Б Б 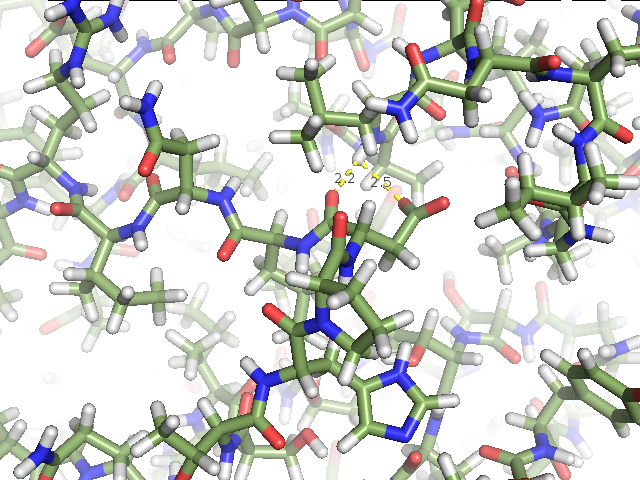
|
|
Рис.4. Водородная связь неструктурированного участка в ядре белка между лейцином 75 и аспартатом 41. (А) Водородная связь в структуре, расшифрованной методом РСА (1IAV). (Б) Водородная связь в структуре, расшифрованной методом ЯМР (1AH2). Изображение для первой модели. Изображение получено с помощью программы pymol. |
|
|
Рис.4. Водородная связь в петлях, выходящих на поверхность глобулы, между глутаматом 54 и валином 51. Водородная связь в структуре, расшифрованной методом РСА (1IAV). Изображение получено с помощью программы pymol. |
В таблице 1 приведены данные о длинах водородных связей в структурах, определенных методами ЯМР и РСА.
Таблица 1. Данные о длинах водородных связей в структурах, определенных методами ЯМР и РСА
| Донор связи | Акцептор связи | Положение связи | Расстояние между атомами (Å) | Встречаемость в моделях ЯМР (%) | |||
| РСА | ЯМР | ||||||
| минимум | медиана | максимум | |||||
| O VAL244 | NH-группа ASN248 | остов белка в α-спирали | 2.9 | 2.1 | 2.2 | 2.3 | 100 |
| O ASP41 | NH-группа LEU75 | неструктурированный участок в ядре белка | 2.9 | 2.1 | 2.2 | 2.6 | 94 |
| O VAL51 | NH-группа GLU54 | петля, выходящая на поверхность глобулы | 3.2 | - | - | - | 0 |
Известно, что ЯМР позволяет определять атомы водорода, поэтому можно рассчитывать, что водородные связи будут значительно более точно описаны именно в структуре, расшифрованной ЯМР. В методе РСА же атомы водорода не определяется, поэтому наличие водородной связи приходится предполагать, основываясь на средних значениях длин и углов водороных связей. На основе анализа полученных данных можно сделать некоторые выводы. Во-первых, водородные связи во вторичных структурах внутри белка наиболее стабильны, они имеют примерно одинаковую длину во всех моделях ЯМР и в РСА-структуре. Связи образующиеся в петлях на поверхности структуры между конкретными остатками высоко подвижны. В данном случае была выбрана водордная связь, которая была найдена только в структуре РСА, и ни в одной из моделей ЯМР. При более подробном рассмотрении структур других неструктурированых участков можно заметить высокую вариабельность расположения остатков в этих структурах. Это связано с тем, что эти участки не стабилизированы окружающей жесткой структурой, и поэтому боковые группы могут занимать различные положения. Связи между остатками, не входящими в элементы вторичной структуры, в ядре белка занимают некоторое промежуточное положение по подвижности по сравнению с двумя ситуациями, рассмотренными выше.
Дата последнего изменения: 12.01.17