Атлас контактов ацетон-карбоксилазы Xanthobacter autotrophicus
| RCSB-код | 5M45 |
| Uniprot ID | ACXB_XANP2 |
| Классификация | Лигаза |
| Имя исходного файла | 5m45.pdb |
| Цепи | 12 |
| Аминокислотные остатки | 6544 |
| Лигандные остатки | 52 |
| Атомы | 51564 |
| Гетероатомы | 244 |
Введение
Ацетон-карбоксилазы (АК) катализируют превращение ацетона и HCO3− в ацетоацетат. Этот процесс является ключевым этапом ассимиляции токсичного ацетона, молекулы которого образуются в ходе метаболизма некоторых анаэробных бактерий, а также распада кетоновых тел млекопитающих [1]. В общем случае бикарбонат-зависимые карбоксилазы катализируют двухэтапную дегидратацию H2CO3, сохраняя в CO2 виде аддукта биотина. Однако АК не содержат биотин, поэтому механизм трансформации ацетона был неизвестен до недавнего времени. Ситуация изменилась после открытия структуры ацетон-карбоксилазы Xanthobacter autotrophicus[3].
АК – это гетеромультимерийный комплекс, состоящий из субъединиц αβγ, соединенных в димерное ядро через α-субъединицу.
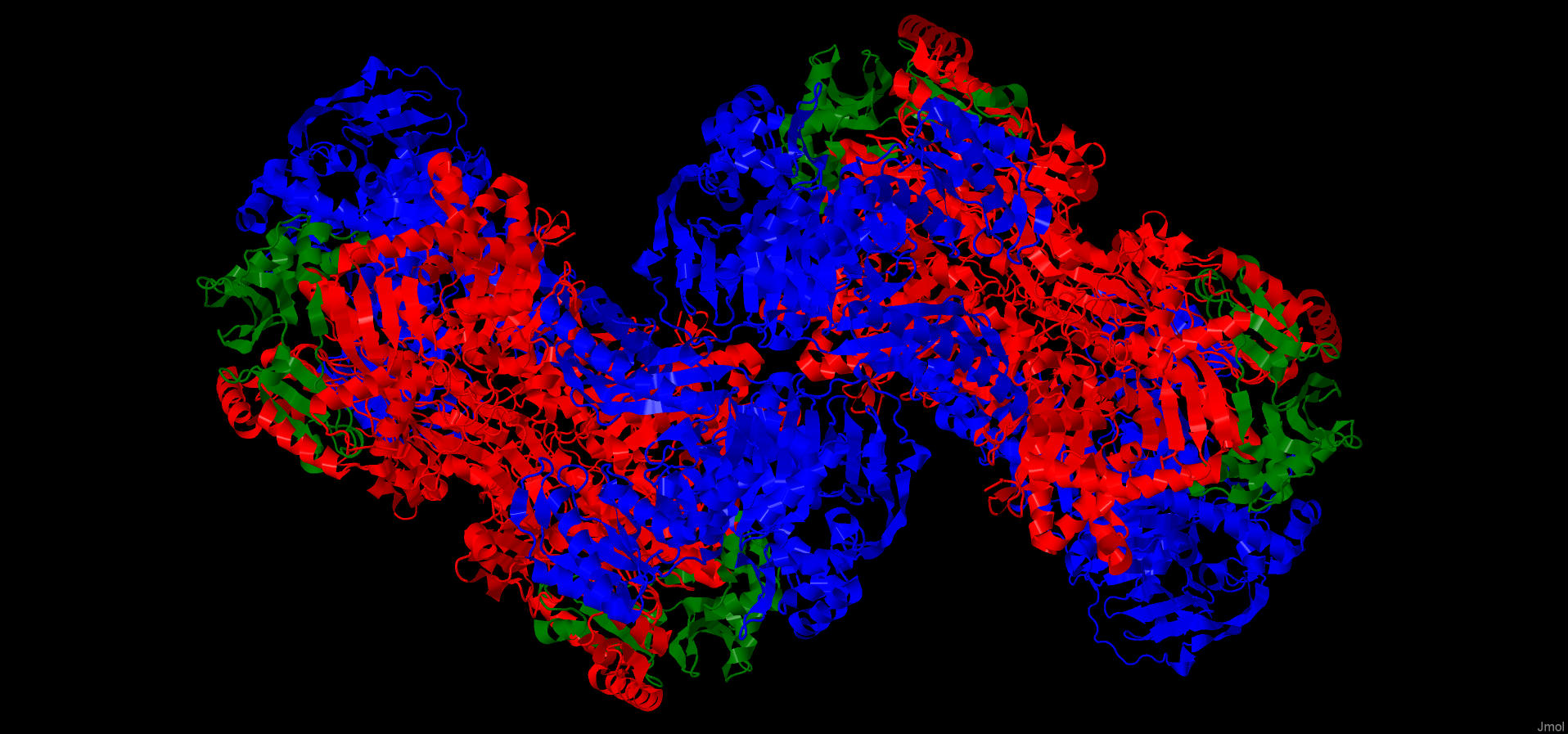
Субъединицы обладают разным уровнем консервативности: структура α–субъдиницы схожа с родственной ацетофенон-карбоксилазой (АФК), β-субъединица имеет общие нуклеотид-связывающие остатки с гомологичной субъединицей АФК. γ–субъединица, в свою очередь, содержит консервативные остатки цистеина, окружающие Zn2+ в активном сайте (Рис. 7). Роль γ–субъединицы не до конца ясна.
Структурной особенностью АК является наличие восьми полиглициновых спиралей второго типа, организованных в сэндвич-подобные структуры[7]. Этот тип спиралей был обнаружен в синтетическом полиглицине. Только четыре структуры в базе данных PDB имеют в своем составе полиглициновые спирали второго типа (шесть или восемь в зависимости от молекулы)[8]. Предполагается, что спирали в –субъединице АК играют роль якорного домена многокомпонентного комплекса[3].
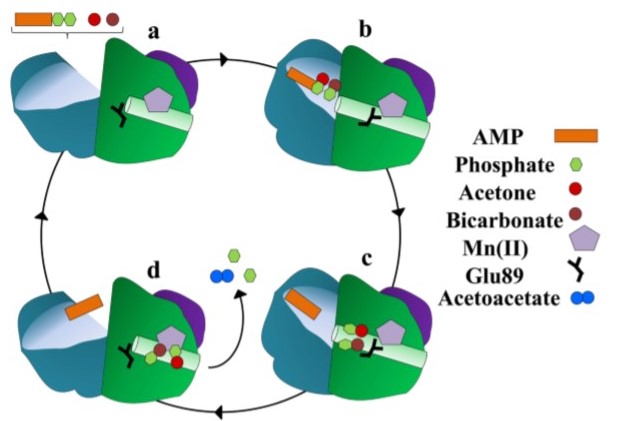
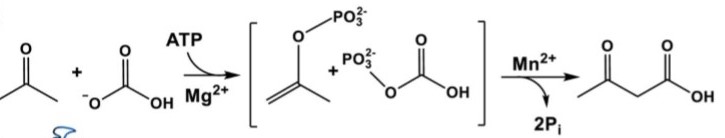
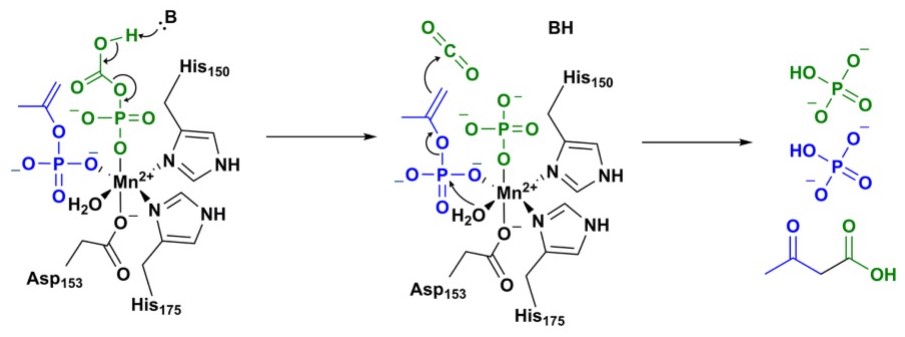
Рисунок выше показывает основные этапы АТФ-зависимого карбоксилирования ацетона. Ацетон и бикарбонат проникают в связывающий центр через субстратный канал в β-субъединице. Связывание субстрата приводит к закрытию канала и открытию нового в α-субъединице. Этот канал содержит АМФ-связывающий участок и соединяет сайт, в котором происходит фосфорилирование ацетона и HCO3-, с марганецсодержащим активным центром, где совершается карбоксилирование ацетона. На следующей стадии цикла работы субстратных каналов внутренний канал закрывается, а субстратный снова открывается. После этого ацетоацетат может покинуть димер[3].
Водородные связи
Водородные связи играют важную роль в формировании вторичной и третичной структур белка. Мы наблюдали эти типы взаимодействий, используя команду 'within' в апплете Jmol. Были вычислены длины водородных связей для 4_13 альфа-спиралей в разных цепях α-субъединицы, а также в месте контактов между α и γ и между α и β субъединицами. Водородных связей между димерными субъединицами обнаружено не было.
Длина водородных связей внутри одной субъединицы варьируется в пределах 3.1Å (для цепей: A - 3,09; D - 3,07; G - 3,17; J - 3,07). В случае взаимодействия двух субъединиц – в пределах 2.93Å. Эти значения близки к описанным в литературе[9].
Первый апплет
Лиганды
| IUPAC | Magnesium (2+) |
| Брутто-формула | Mg2+ |
| PubChem ID | 888 |
| Молярная масса | 24,3 г/моль |
| IUPAC | Manganese (2+) |
| Брутто-формула | Mn2+ |
| PubChem ID | 27854 |
| Молярная масса | 54.938 г/моль |
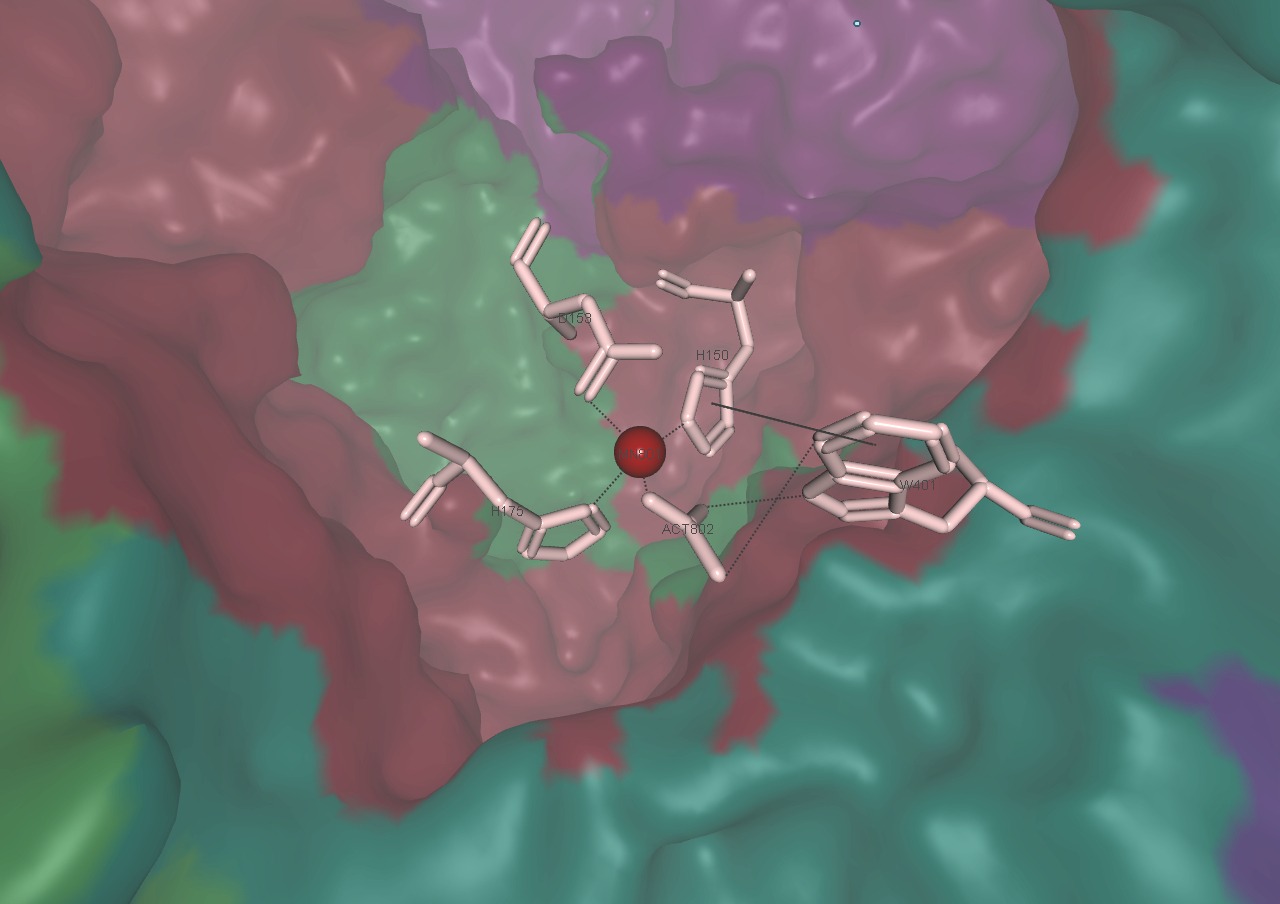
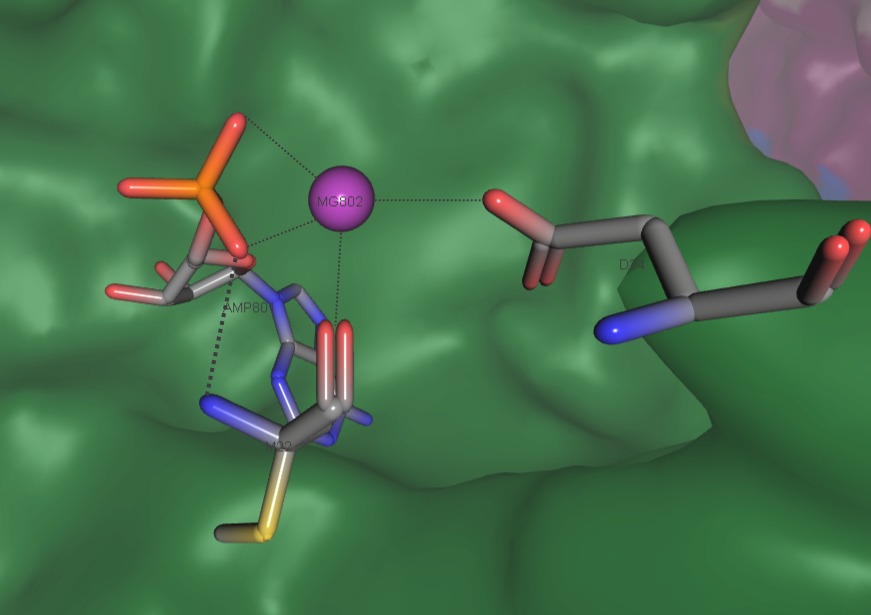
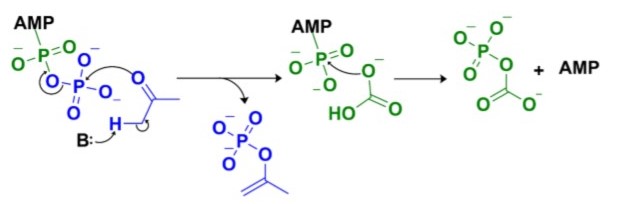
Предполагается, что промежуточные продукты - фосфоенолацетон и карбоксифосфат - реагируют в марганецсодержащем активном центре α-субъединицы, создавая ацетоацетат и две молекулы неорганического фосфата (Рис. 6)[3].
| IUPAC | Zinc ion |
| Брутто-формула | Zn2+ |
| PubChem ID | 32051 |
| Молярная масса | 65.38 г/моль |
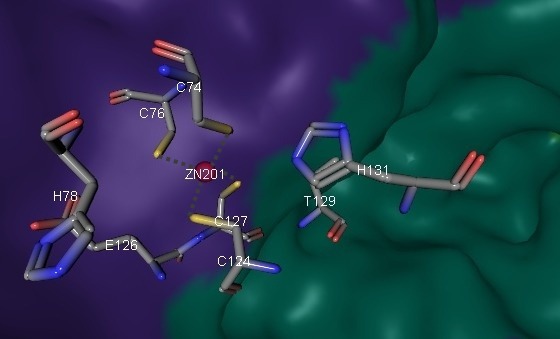
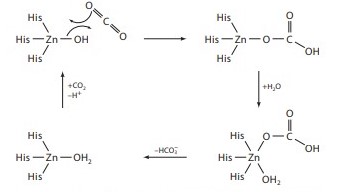
pKa иона цинка не превосходит физиологического значения pH, поэтому он может быстро активировать молекулу воды и образовать [Zn-OH]+. Возможный механизм захвата CO2 с участием Zn2+ представлен на Рис. 8. Роль γ-суьъединицы АС неясна, и, согласно предварительным данным, ион цинка не участвует в катализе.
| IUPAC | [(2R,3S,4R,5R)-5-(6-Amino -9H-purin-9-yl)-3,4-dihyd roxytetrahydro-2-furanyl] methyl dihydrogen phosphate |
| Брутто-формула | C10H14N5O7P |
| PubChem ID | 6083 |
| Молярная масса | 347.224 г/моль |
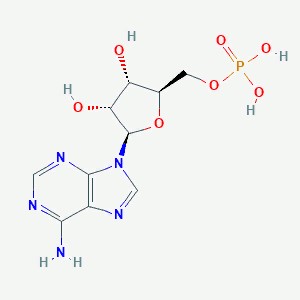
Процесс образования АМФ начинается с активации ацетона с помощью АТФ, в результате чего образуются промежуточный фосфоенолацетон и АДФ, который затем реагирует с бикарбонатом с образованием карбоксифосфата и АМФ. АМФ служит индикатором текущего состояния белка: связанные им структуры вызывают значительные изменения в β-субъединице, переводя ее в лиганд-независимое состояние (Рис. 10).
| IUPAC | Acetate ion |
| Брутто-формула | C2H3O2 |
| PubChem ID | 175 |
| Молярная масса | 59.04 г/моль |
| IUPAC | 2-[2-[2-[2-(2-ethoxyethoxy)ethoxy] ethoxy]ethoxy]ethanol |
| Брутто-формула | C12H26O6 |
| PubChem ID | 78058 |
| Молярная масса | 266.33 г/моль |
Это таргетная молекула митохондриальной Малонил-СоА-ацил-трансацилазы, которая катализирует перенос остатка малонила с малонил-СоА на свободную триольную группу фосфопантеинового домена митохондриального ацилпереносящего белка[6]. Ее функция в ацетон-карбоксилазе неизвестна.
Второй апплет
Дисульфидных мостиков в белке обнаружено не было (проверка проводилась с помощью команды 'restrict cys').
Гидрофобные взаимодействия
Так как найденные статьи не содержат никакой информации о внутрибелковых взаимодействиях, а вычислительные способности сайта, проводящего подобные вычисления (http://pic.mbu.iisc.ernet.in/job.html) оказались недостаточными для целей данного исследования, все последующие примеры были найдены и рассчитаны вручную. Триптофан-438 из α-субъединицы и его окружение выбраны в качестве примера гидрофобного взаимодействия. Оно начинает проявляться на расстоянии больше 3Å, а после 5Å окружение центрального остатка становится настолько плотным, что его невозможно различить за соседними молекулами. Согласно проведенным измерениям, среднее расстояние между соседними несвязанными ковалентно атомами примерно равно 3.54Å. Ван-дер-ваальсовые радиусы атомов, составляющих аминокислотные остатки, больше 1.4Å, т.е. расстояние между ними не больше 0.74Å, что не позволяет молекуле воды (и вообще любому атому) поместиться внутри гидрофобного ядра - электростатические силы вытолкнут их наружу.
Солевые мостики
В качестве примера приведена связь между остатками аргинина (339) и глутамина (746) α-субъединицы. Характеристики взаимодействия показаны с помощью команды 'measure' и совпадают со средней длиной ионных связей.
Стэкинг
T-стэкинг был обнаружен между двумя остатками фенилаланина (334 и 352) в α-субъединице. Согласно показанным на следующем апплете вычислениям, расстояние между ароматическими кольцами примерно равно 3.77Å.
Третий апплет
Личный вклад
Дарья Ногина выбрала белок, написала литературный обзор его свойств и функций, проанализирована водородные связи и лиганды. Анжелика Додонова безуспешно пыталась найти дисульфидные мостики, описала стэкинг, солевые мостики и гидофобные взаимодействия, оформила html-страницу, а также перевела проект на русский язык.
Источники
[1] http://www.jbc.org/content/279/45/46644.short
[2] Tong, L. Structure and function of biotin-dependent carboxylases. Cell Mol. Life Sci. 70, 863–891 (2013)
[3] Mus, Florence Structural Basis for the Mechanism of ATP-Dependent Acetone Carboxylation. Scientific Reports, 7234, 7, 1 (2017)
[4] Chovancova, E. et al. CAVER 3.0: a tool for the analysis of transport pathways in dynamic protein structures. PLoS Comput. Biol. 8 (2012)
[5] Ivano Bertini Biological Inorganic Chemistry Structure and Reactivity. UNIVERSITY SCIENCE BOOKS Sausalito, California
[6] DrugBank http://www.drugbank.ca/drugs/DB07344#targets
[7] https://www.sciencedirect.com/science/article/pii/S0969212618302636
[8] https://www.rcsb.org
[9] Arunan, E., Desiraju, G., Klein, R., et al. (2011). Definition of the hydrogen bond (IUPAC Recommendations 2011). Pure and Applied Chemistry, 83(8), pp. 1637-1641. Retrieved 4 Mar. 2019, from doi:10.1351/PAC-REC-10-01-02