- DNA LIGASE I (POLYDEOXYRIBONUCLEOTIDE SYNTHASE [ATP]) - ДНК-лигаза I (АТФ-зависимая полидезоксирибонуклеотид-синтетаза) - 1 цепь (А);
- DIDEOXY TERMINATED DNA (дидезокси- на последнем нуклеотиде ДНК) - 1 цепь (B);
- 5'-PHOSPHORYLATED DNA (фосфорилированная на 5' конце ДНК) - 1 цепь (C);
- TEMPLATE DNA (ДНК-матрица) - 1 цепь (D);
- ADENOSINE MONOPHOSPHATE (AMP) - аденозин-монофосфат - 1 молекула;
- SELENOMETHIONINE (селенометионин C5H11NO2Se) - 6 молекул.
Для исследования были выбраны цепь А белка и цепи В, С и D, представляющие собой ДНК со следующей последовательностью:
цепь В [3] 5' - GCTGATGCGT DOC - 3' [13], цепь С [1] 5' - GTCGGACTG - 3' [9]
|||||||||| | |||||||||
цепь D [26] 3' - CGACTACGCA G - 5' [16], цепь D [15] 3' - CAGCCTGAC - 5' [7],
где 3-13, 1-9 и 7-26 - номера первых и последних нуклеотидов, а DOC - 2',3'-дидезоксицитидин-5'-монофосфат.Для упрощения работы с ДНК был создан отдельный файл только с координатами нуклеиновой кислоты (без координат белка): 1x9n_d.pdb.
Затем я импортировал содержащиеся в выходном файле значения торсионных углов в Excel и рассчитал среднее значение каждого угла, чтобы затем посчитать отклонение каждого нуклеотида от среднего значения и выявить самые "кривые" нуклеотиды. Найдя для каждого торсионного угла среднее значение, я просуммировал модули отклонений углов от средних значений для каждого нуклеотида. Для цепей В и С средние значения я считал вместе, ведь, по сути, они друг друга дополняют. Тем более, так было удобнее посмотреть, будет ли наблюдаться "кривизна" для комплементарного нуклеотида в цепи D, если она проявится у нуклеотида в цепи С или В. Нуклеотиды, суммы отклонений углов которых превзошли 600, я покрасил красным цветом, а те, суммы углов которых превзошли 500 - оранжевым. Я немного удивился, когда увидел, что в результате в получившейся таблице гипотеза о "кривизне" нуклеотида при условии "кривизны" комплементарного ему подтвердилась всего два раза (в случае 12-го и 14-го нуклеотидов). В остальных же случаях напротив "кривого" нуклеотида располагался вполне нормальный, не сильно "деформированный", но зато его сосед зачастую оказывался "кривым". Я думаю, что это можно объяснить тем, что засчет спиральной конформации ДНК при "деформации" в одной из цепей одного нуклеотида нуклеотиду другой цепи, расположенному рядом с комплементарным, приходится также "деформироваться", чтобы комплементарный сосед смог пространственно "подстроиться" под своего "кривого" напарника. Таким образом, если мы рассматриваем 2 цепи, зачастую "деформации" чередуются для большей стабильности молекулы (если в одном и том же месте двух цепей будут располагаться "деформированные" комплементарные нуклеотиды, молекула будет менее стабильна, чем если они будут располагаться по очереди).
С помощью скрипта my_dna.def было подсчитано количество различных контактов между белком и нуклеиновой кислотой в изучаемом комплексе. Результат представлен в таблице:
Таблица. Контакты разного типа в комплексе 1X9N.pdb
| Контакты атомов белка с | Полярные | Неполярные | Всего |
| остатками 2'-дезоксирибозы | 13 | 74 | 87 |
| остатками фосфорной кислоты | 40 | 54 | 94 |
| остатками азотистых оснований со стороны большой бороздки | 0 | 0 | 0 |
| остатками азотистых оснований со стороны малой бороздки | 3 | 3 | 6 |
После изучения пространственной ориентации комплекса в программе RasMol результаты, приведенные в таблице, оказались вполне ожидаемыми. Действительно, белок окружает цепи ДНК, в основном, именно с краев, взаимодействуя таким образом с сахарофосфатным остовом, не погружаясь в пространство бороздок. Самые близкие контакты фермент образует с остатками фосфорной кислоты, это очень хорошо видно из рисунка, представленного ниже. Конечно, гидрофобных взаимодействий белок и ДНК образуют больше, чем полярных связей, что связано прежде всего с большим количеством гиброфобных атомов (прежде всего атомов углерода) по сравнению с полярными атомами (кислорода и азота). Впрочем, стоит заметить, что полярных контактов белка с остатками фосфорной кислоты почти столько же, сколько неполярных. Это объясняется, как раз, близким расположением цепи белка и атомов кислорода при фосфате.
Рис.1. Пространственная ориентация ДНК-белкового комплекса
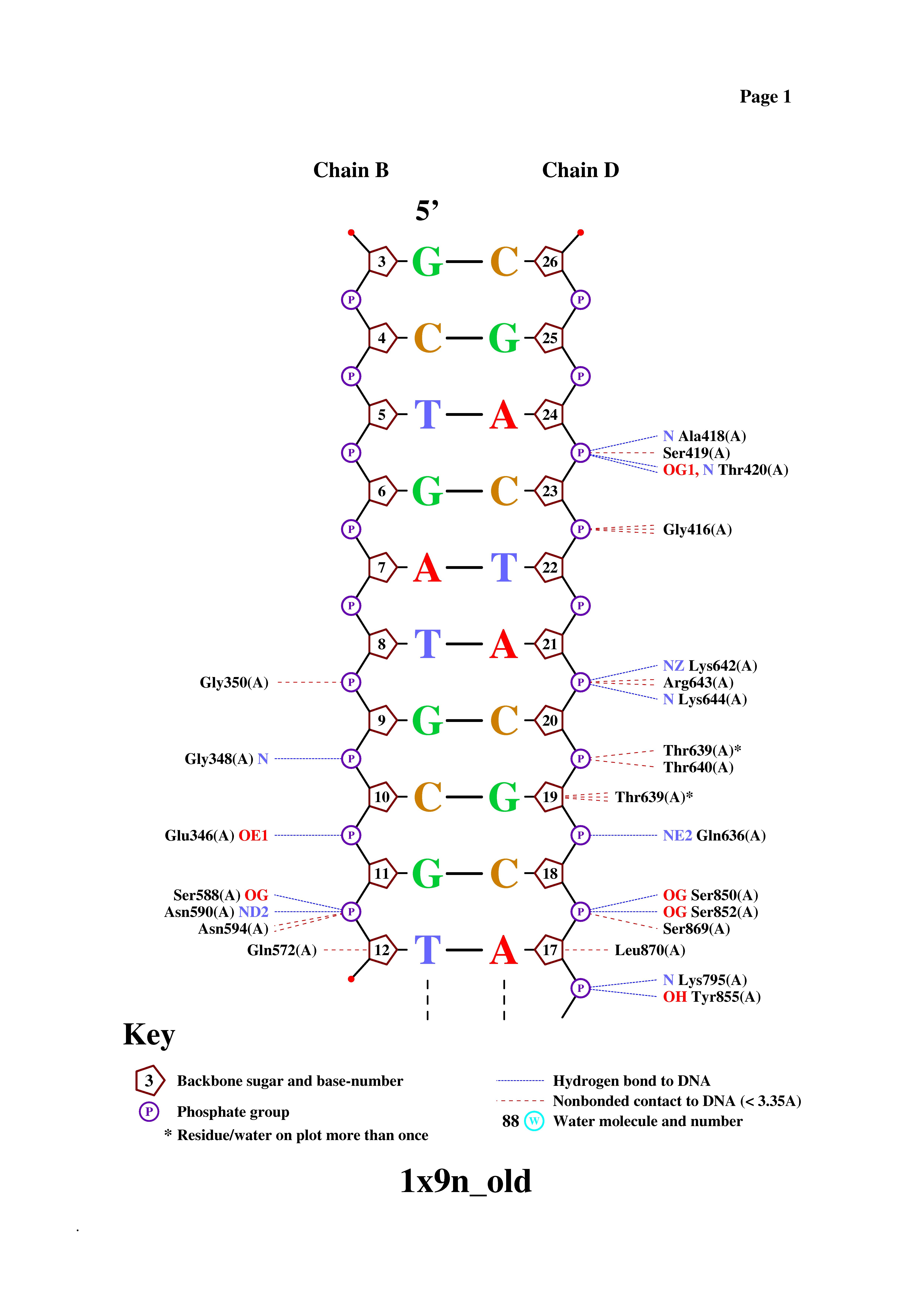
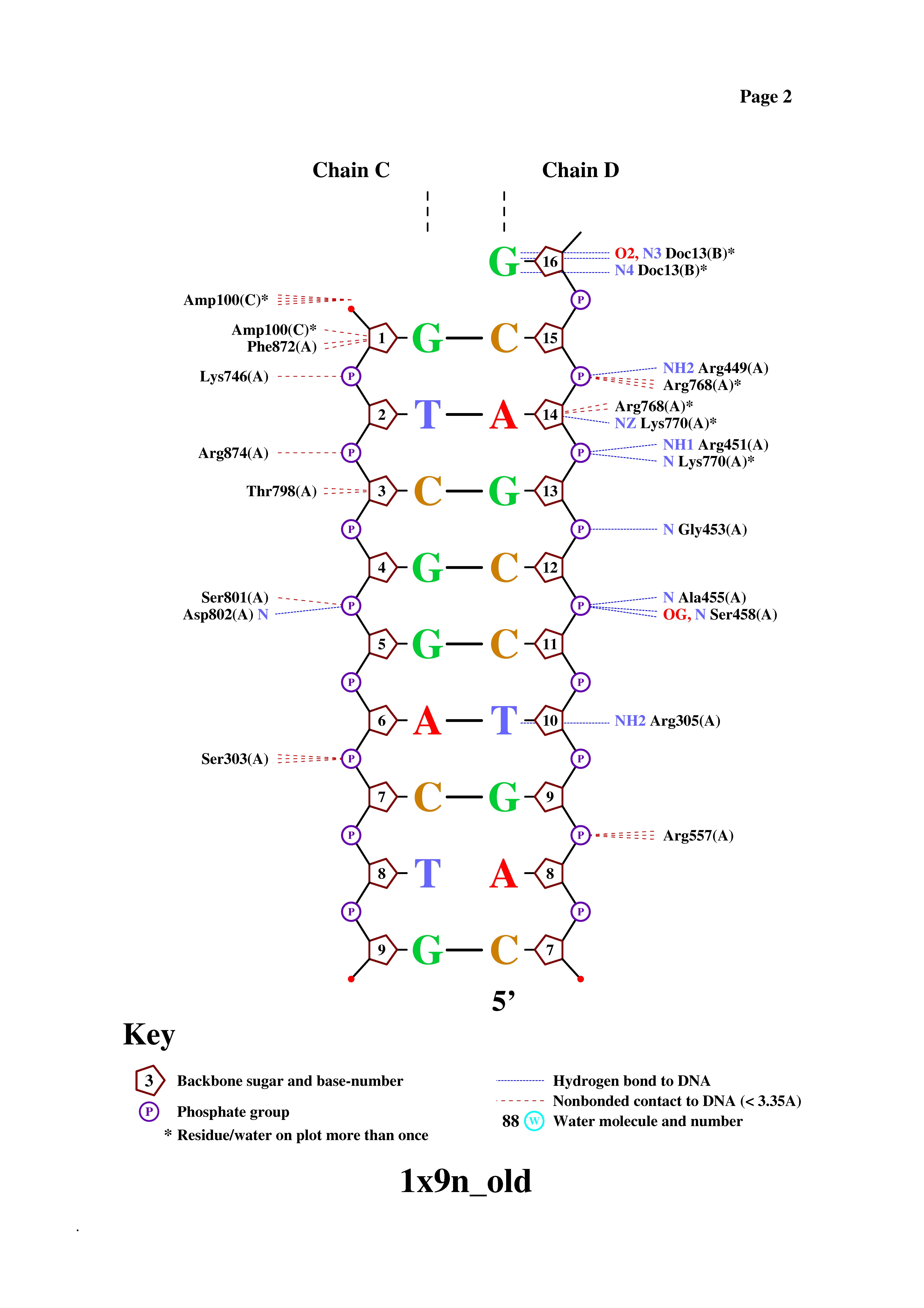
Рис.2. Схема ДНК-белковых контактов
Как видно из схемы, белок и ДНК образуют много контактов. Причем, как я уже заметил в прошлом пункте, основное число контактов со стороны нуклеиновой кислоты образуют остатки фосфорной кислоты, чуть меньше - атомы дезоксирибозы, а атомы азотистых оснований, исходя из схемы, образуют всего один контакт с атомами белка (контакт между DТ10 и NH2-группой Arg305. Может показаться, что контакт образует еще азотистое основание DG16, но это взаимодействие не с белком, а с 13-м нулеотидом B-цепи ДНК, который в схему не попал (он не связан с 12-м нуклеотидом в pdb-файле)).
Остатки фосфорной кислоты, как видно, в большинстве своем контактируют с атомами азота белка, что есть образуют полярные взаимодействия (с помощью расположенных при фосфоре атомов кислорода). Дезоксирибоза же, напротив, образует с аминокислотными остатками почти только гидрофобные взаимодействия.
Кстати, интересно заметить, что для цепей В и С, в основном, наблюдается отсутствие контактов с белком "кривых" нуклеотидов (хотя, безусловно, есть исключения), а для цепи D, наоборот, все имеющиеся там "кривые" нуклеотиды связаны не одним, а сразу несколькими контактами с аминокислотными остатками (включая единственный нуклеотид DT10, образующий контакт азотистым основанием). Это говорит о том, что взаимодействию с белком подвергается, скорее всего, в основном, цепь D ДНК, в связи с чем и появляется пространственная "деформация" нуклеотидов.
В качестве аминокислотного остатка, образующего больше всего контактов с ДНК, я выбрал Lys770. Вообще максимальное число взаимодействий аминокислотного остатка с ДНК в изучаемом комплексе - 2. Я выбрал остаток Lys770, потому что он единственный образует две полярные связи (одну с атомом кислорода фосфатного остатка, а вторую с 4' атомом кислорода дезоксирибозы). Ниже представлено изображение этого взаимодействия:
Рис.3. Взаимодействие Lys770 и DG14
Рис.4. Взаимодействие Arg305 и DТ10

| Source | Domain | Start | End |
|---|---|---|---|
| PfamB | Pfam-B_22419 | 1 | 131 |
| PfamB | Pfam-B_44457 | 133 | 261 |
| PfamA | DNA_ligase_A_N | 287 | 465 |
| PfamA | DNA_ligase_A_M | 542 | 746 |
| PfamA | DNA_ligase_A_C | 771 | 836 |
Среди представленных доменов ДНК-связывающий - DNA_ligase_A_N. Его полное название - DNA ligase N terminus.
Этот домен можно обнаружить не во всех АТФ-зависимых ДНК-лигазах (EC:6.5.1.1). Вероятно, он участвует в связывании с ДНК и в катализе. В человеческой ДНК лигазе I (P18858) и в Saccharomyces cerevisiae (P04819) этот домен необходим для катализа, в то время как в Vaccinia virus (P16272) этот домен для него не существенен. Но делеция этого участка уменьшает сродство к разрезанной ДНК и уменьшает скорость присоединения цепи на стадии, следующей за формированием фермент-аденилата.