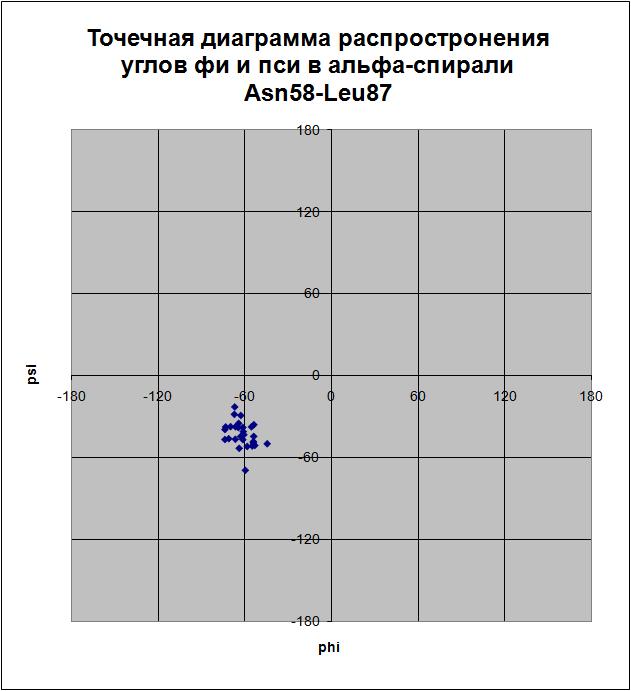
Открыть рисунок в отдельном окне
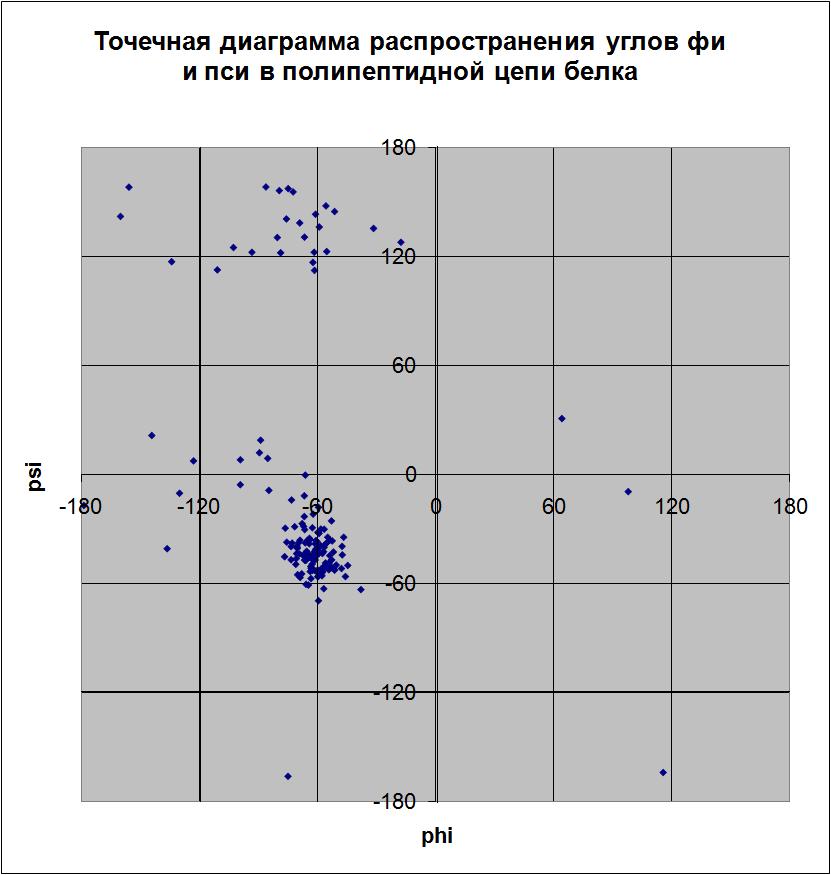 �
� пси = 120). Наиболее распространенные торсионные углы: фи = -56,8; -60; -66,9; пси = -43,4. Точки, не соответствующие ни углам альфа-спиралей, ни углам бета-тяжей, относятся к остаткам глицинов, радикалы которых, вследствие своих маленьких размеров, не создают препятствий для вращения вокруг связей, вследствие чего значения торсионных углов глицинов могут быть весьма разнообразными, в то время как эти же значения запрещены для других аминокислотных остатков.
Открыть рисунок в отдельном окне �