Сравнение ЯМР- и РСА-структур одного белка
Задача: сравнить 3 водородные связи в структурах белка, расшифрованных с помощью ЯМР и РСА.
Для работы выбрана низкомолекулярная тирозин фосфатаза (low molecular weight protein-tyrosine phosphatase), структура которой расшифрована обоими методами. Молекулярная масса 17.95 KDa, длина 157 АА.
- Структура расшифрованная методом ЯМР: 1bvh. 15 моделей ЯМР.
- Структура расшифрованная методом РСА: 1dg9. Разрешение 1.9 Å
Сначала визуализировали все водородные связи в структуре, полученной методом РСА. Чтобы показать водородные связи в PyMOL использовали следующие команды:
distance hbond, name N*, name O*, 3.5, mode=2 # показать все водородные связи (критерий – расстояние между атомами менее 3.5 Å distance hbond, name N* &bb., name O* &bb., 3.5, mode=2 # водородные связи только между атомами остова distance hbond, name N* & (not bb.), name O* & (not bb.), 3.5, mode=2 # водородные связи только между атомами боковых цепей.Для анализа выбрала несколько водородных связей и затем вручную мерила расстояния между теми же атомами в 15 структурах, полученных методом ЯМР (Wizard --> Measurement). Данные вносила в таблицу. Сводная таблица представлена внизу страницы (Таблица 1).
Водородная связь в бета-листе.
Я выбрала связь ILE88(O) - GLU114(N) между атомами остова в бета-листе. Эта связь есть во всех ЯМР структурах.
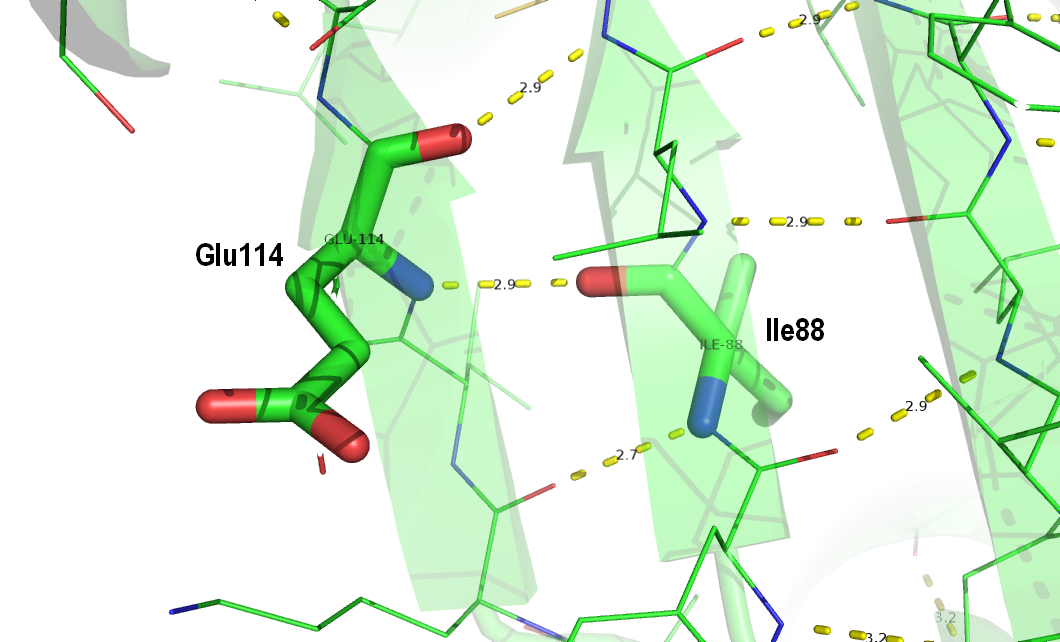
Рисунок 1. Водородная связь в бета-листе между атомами остова остатков ILE88(O) и GLU114(N) в структуре полученной методом РСА. На картинках, полученных в PyMOL, здесь и далее расстояние между атомами показано желтым пунктиром, интересующие остатки показаны палочками.
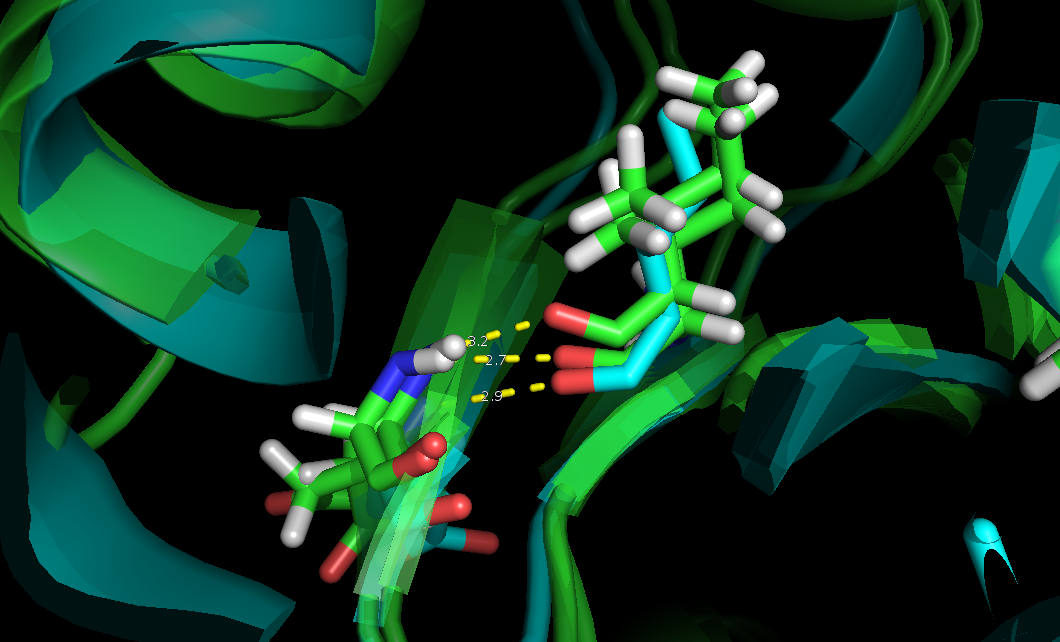
Рисунок 2. Водородная связь в бета-листе ILE88(O) - GLU114(N) сохраняется в структурах полученных методом ЯМР (покрашены зеленым). Для сравнения эти остатки и водородная связь в РСА модели (покращина голубым).
Водородная связь в альфа-спирали.
Водородная связь в альфа-спирали (GLU23 (O)-ARG27(N)) также сохраняется во всех стуктурах, расшифрованных методом ЯМР. Интересно, что в структуре, полученной методом РСА есть также водородная связь между атомами боковой цепи (GLU23(OE1)-ARG27(NH2)), но эта связь не сохраняется в ЯМР моделях.
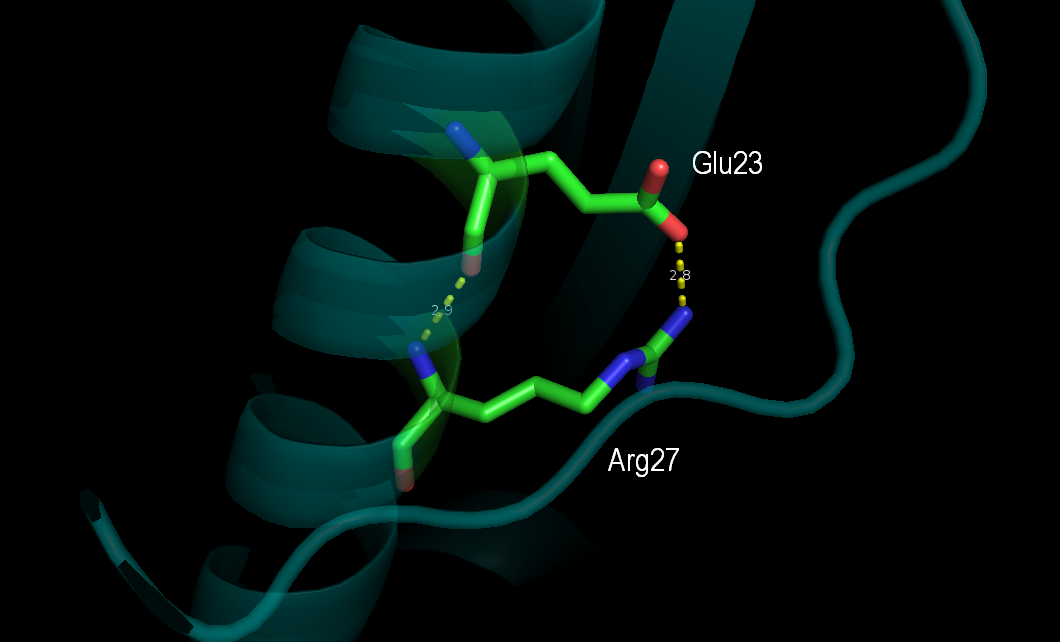
Рисунок 3. Водородная связь в альфа спирали между атомами остова остатков GLU23 (O)-ARG27(N) в структуре полученной методом РСА. Также в кристалле есть водородная связь между атомами боковых цепей этих остатков GLU23(OE1)-ARG27(NH2).
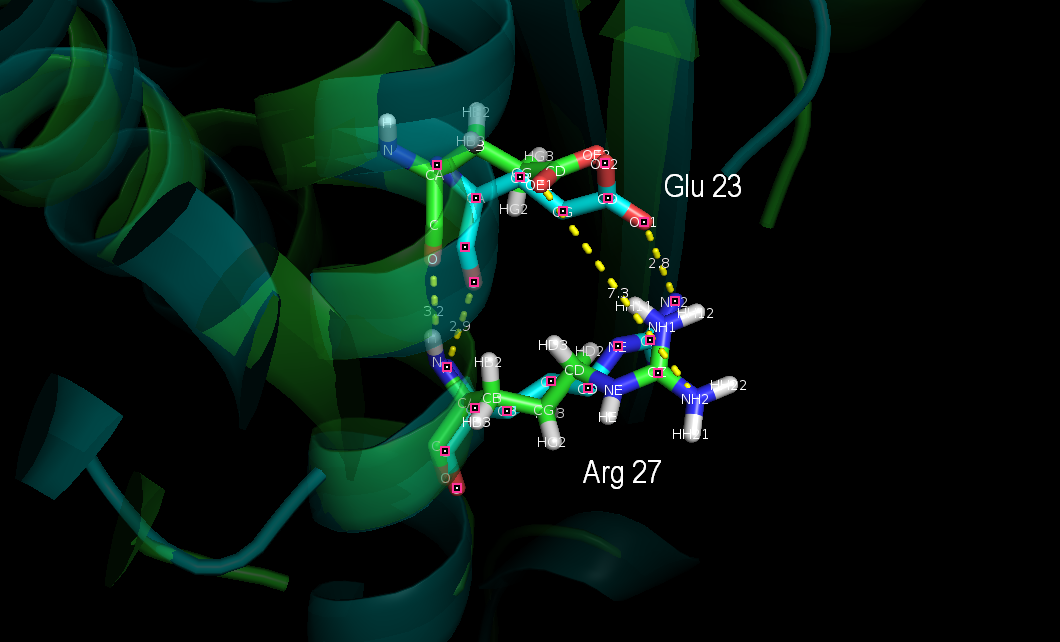
Рисунок 4. Водородная связь в альфа спирали между атомами остова остатков GLU23 (O)-ARG27(N) в структурах полученных методом ЯМР. Водородная связь между атомами боковых цепей этих остатков GLU23(OE1)-ARG27(NH2) не сохраняется ни в одной из структур, полученных методом ЯМР. На рисунке голубым остатки GLU23 и ARG27 в кристалле, зеленым – в растворе (из ЯМР модели 12).
Водородные связи между атомами боковых цепей в ядре белка.
Боковые цепи аминокислотных остатков более подвижны в растворе, чем остов, поэтому водородные связи между атомами боковых цепей в кристалле могут быть артефактом кристаллизации. На картинках ниже показаны водородные связи между атомами боковых цепей остатков ASN15, SER19, SER43, HIS72 в ядре глобулы в модели РСА. Из водородных связей существующих в кристалле в моделях ЯМР сохраняется только одная из связей, и то только в 33% случаев.
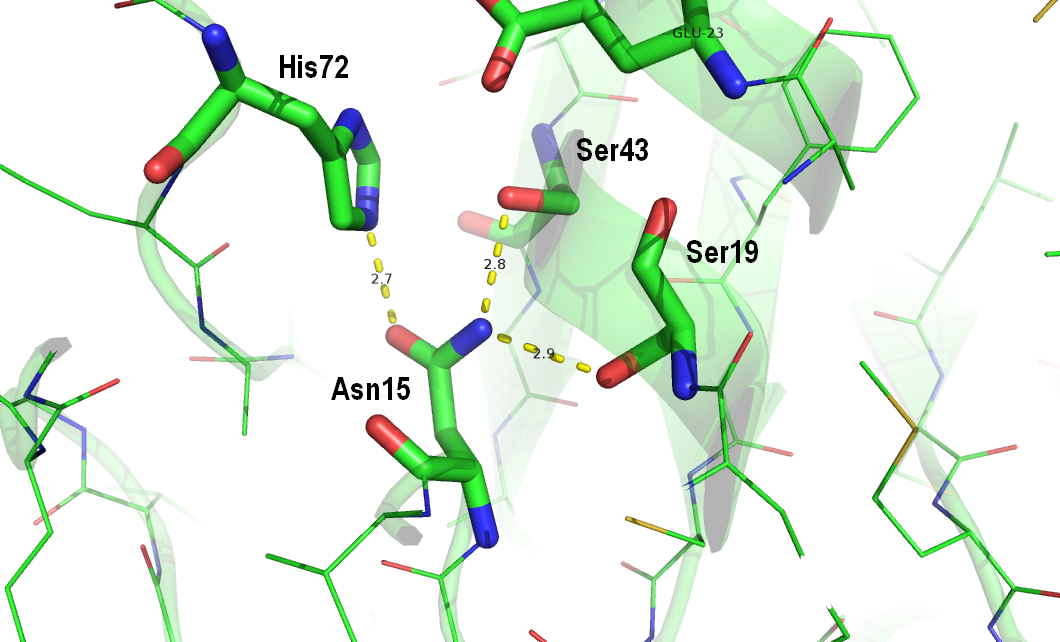
Рисунок 5. Водородные связи между атомами боковых цепей остатков ASN15, SER19, SER43, HIS72 в кристалле.
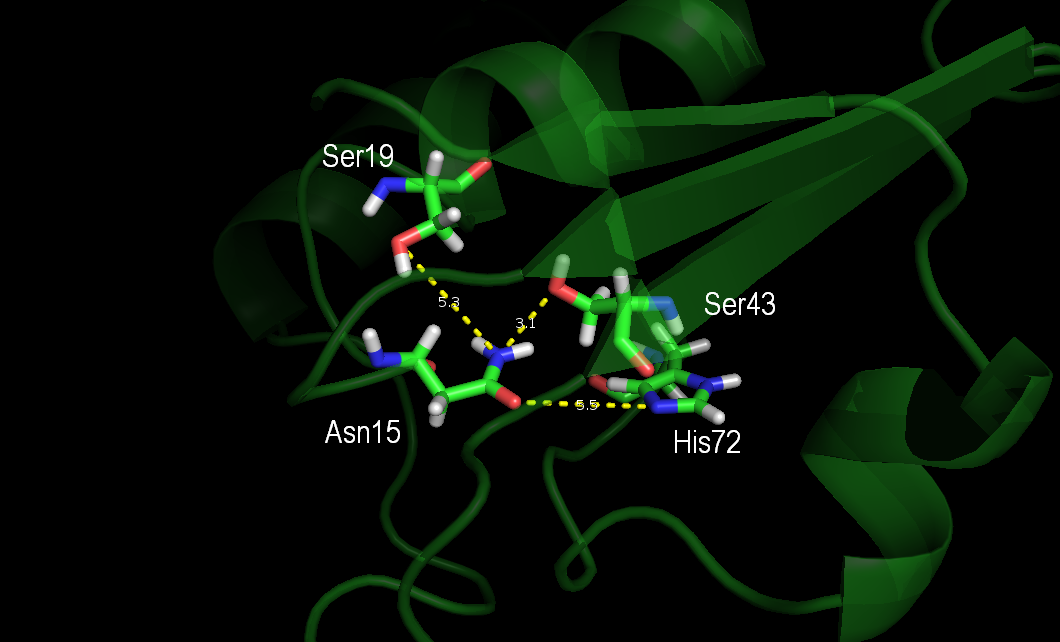
Рисунок 6. Водородные связи между атомами боковых цепей остатков ASN15, SER19, SER43, HIS72 в 8-ой модели ЯМР. Сохраняется только водородная связь SER43(OG)-ASN15(ND2).
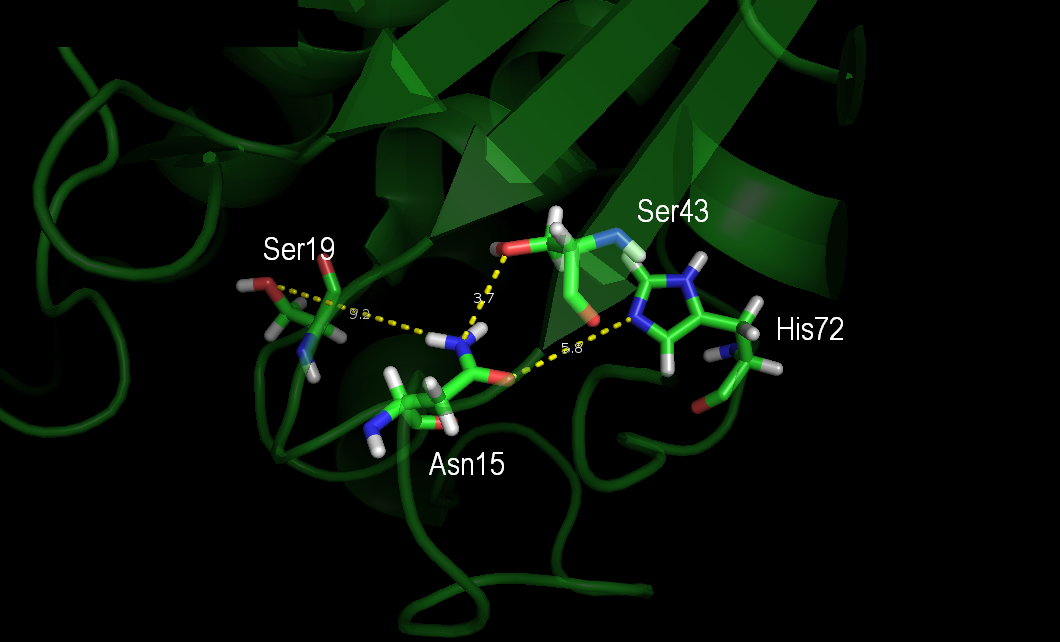
Рисунок 7. Водородные связи между атомами боковых цепей остатков ASN15, SER19, SER43, HIS72 в 10-ой модели ЯМР. Водородных связей нет.
Водородная связь в петле, выходящей на поверхность глобулы
Для анализа выбрала водородную связь между атомами остова остатков ASP48(N) и VAL51(O), входящих в экспонированную петлю. Данная водордная связь сохраняется только в одной модели ЯМР.
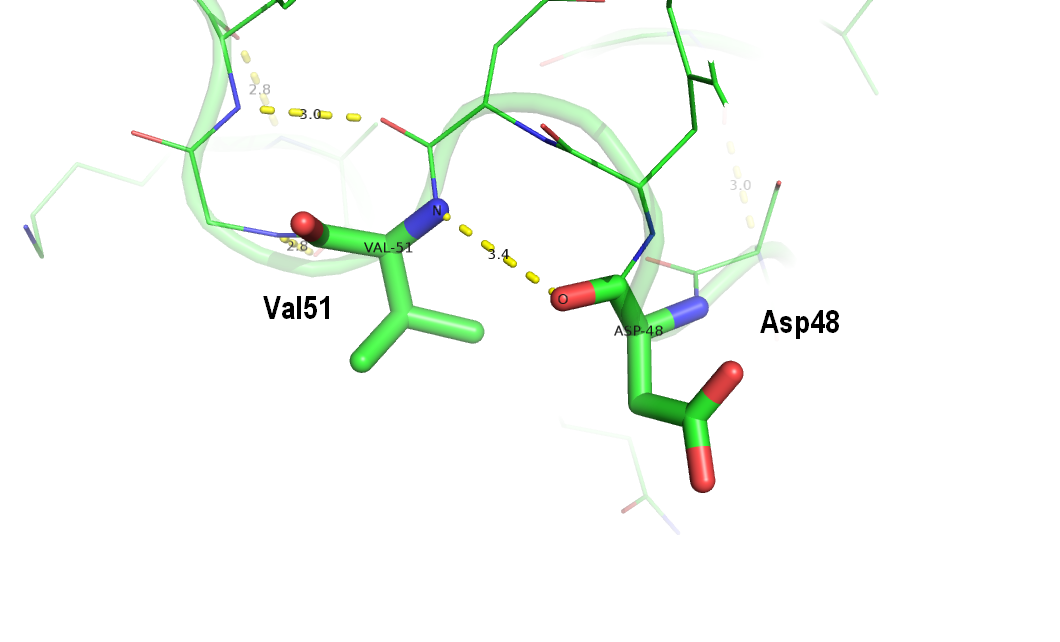
Рисунок 8. Водородная связь в петле, выходящей на поверхность глобулы в кристалле ASP48(N) - VAL51(O).
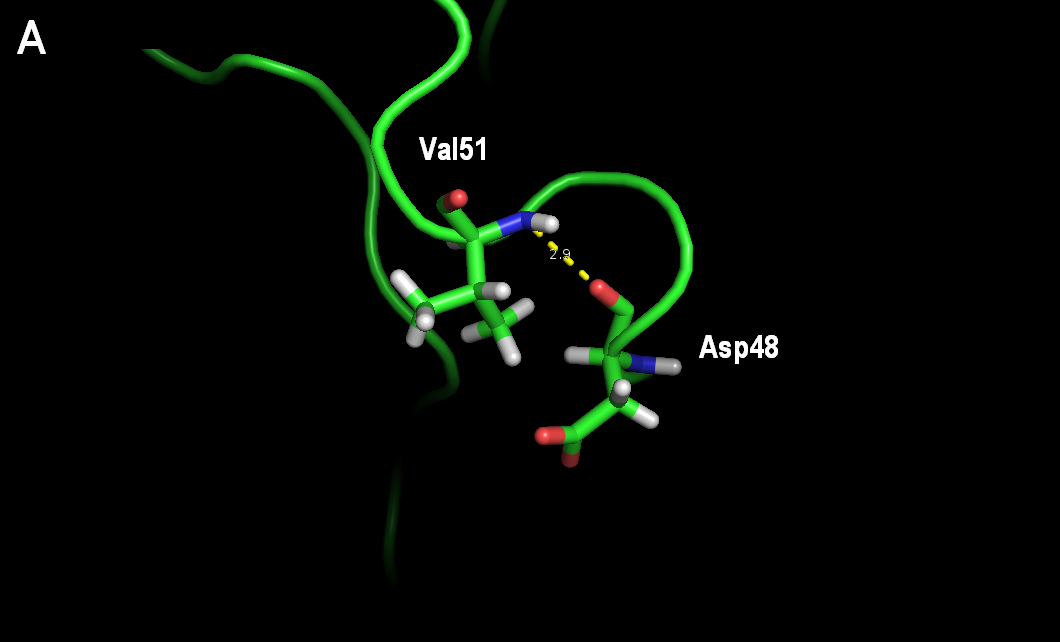
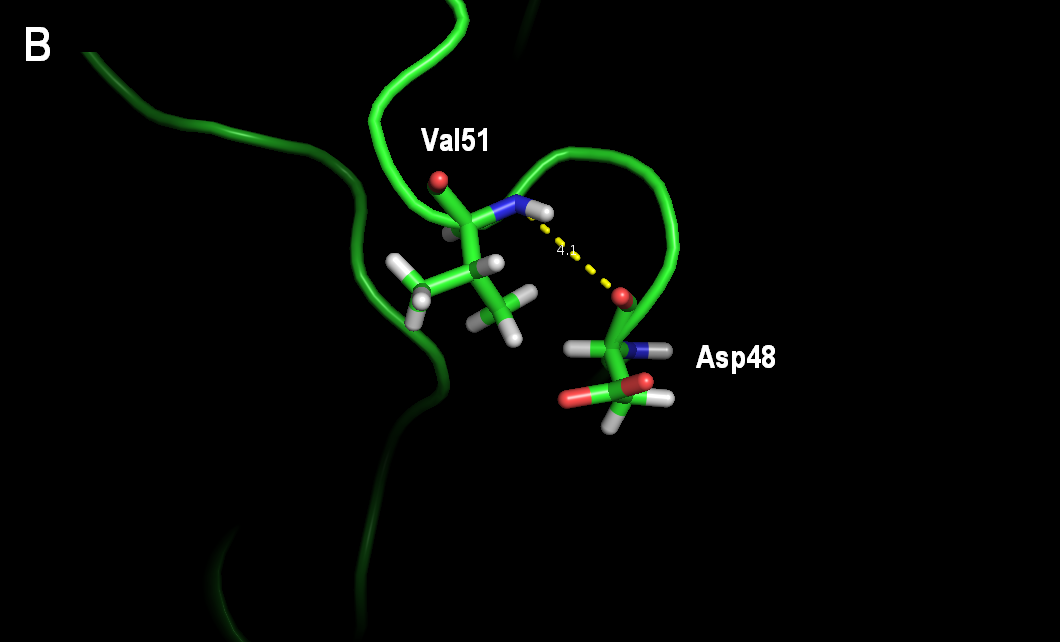
Рисунок 9. Водородная связь в петле, выходящей на поверхность глобулы в кристалле ASP48(N) - VAL51(O) видна только в одной модели ЯМР – в 6-ой (рисунок А). В других расстояние между этими атомами больше (рисунок В)
Сводная таблица
Полученные данные проанализированы и собраны в таблицу 1.Таблица 1. Сравние водородных связей в структурах белка, расшифрованных с помощью ЯМР и РСА.
| Связь, образованная остатками боковых цепей |
|||||||||
|---|---|---|---|---|---|---|---|---|---|
| Положение связи | β-лист внутри глобулы |
α-спираль внутри глобулы |
боковые цепи остатков, образующих альфа-спираль |
боковые цепи остатков внутри ядра | в гибкой петле на поверхности глобулы |
||||
| Обозначение | beta | alfa | sc_alpha | sc_core1 | sc_core2 | sc_core3 | loop | ||
| Остатки формирующие водородную связь |
ILE88(O) - GLU114(N) | GLU23(O)-ARG27(N) | GLU23(OE1)-ARG27(NH2) | ASN15(OD1)-HIS72(NE2) | SER43(OG)-ASN15(ND2) | SER19(OG)-ASN15(ND2) | ASP48(N)-VAL51(O) | ||
| Расстояние в РСА (Å) |
2,9 | 2,9 | 2,8 | 2,7 | 2,8 | 2,9 | 3,4 | ||
| Число моделей ЯМР, где есть водородная связь |
15 | 15 | 0 | 0 | 5 |
0 | 1 | ||
| % моделей ЯМР, где есть водородная связь |
100% | 100% | 0% | 0% | 33% | 0% | 7% | ||
| расстояния в ЯМР между остатками | есть водородная связь |
median | 3,1 | 3,2 | - | - | 2,8 | - | 2,9 |
| min | 2,7 | 3,1 | - | - | 2,7 | - | 2,9 | ||
| max | 3,3 | 3,3 | - | - | 3,5 | - | 2,9 | ||
| нет водородной связи |
median | - | - | 7,8 | 6,3 | 4,25 | 7,8 | 4,25 | |
| min | - | - | 5,5 | 4,5 | 3,7 | 5,5 | 3,8 | ||
| max | - | - | 11,8 | 9,4 | 7,6 | 11,8 | 5,3 | ||
Более подробную информацию можно получить из таблицы Excel, в которой собраны все полученные мной данные и в которой велись рассчеты:
Полная таблица
Выводы:
- Водородные связи в альфа-спиралях и бета-листах между электроотрицательными атомами остова устойчивы и сохраняются как в кристалле, так и в растворе;
- Водородные связи в петлях, которые есть в кристалле в моделях ЯМР могут не наблюдаться, так как эти участки подвижны;
- Водородные связи, образованные остатками боковых цепей, могут быть артефактами кристаллизации, хотя некоторые водородные связи есть и в РСА-структуре, и в ЯМР структуре.
