АТЛАС КОНТАКТОВ АЛКОГОЛЬДЕГИДРОГЕНАЗЫ I ДРОЖЖЕЙ |
РЕЗЮМЕ
Данная страница посвящена составлению атласа контактов алкогольдегидрогеназы I - ферментативного комплекса
пекарских дрожжей (Saccharomyces cerevisiae), участвующего в процессе ферментации глюкозы [1] . В состав атласа входит описание:
- Низкомолекулярных лигандов в составе комплекса
- Белок-белковых контактов (ковалентные связи, водородные связи, солевые мостики, гидрофобные ядра)
- Лиганд-биомолекулярных контактов
Информация обо всех контактах сопровождается графическими иллюстрациями, полученными при помощи программы Jmol. Изображения доступны в виде Jmol-апплетов,
по ссылкам также возможен доступ к соответствующим скриптам.
В случае, если апплеты не работают, для ознакомления с ними можно перейти по ссылке :http://kodomo.fbb.msu.ru/~polina.shpudeiko/term2/atla..
Также доступна Англоязычная версия.
|
ВВЕДЕНИЕ |
|
Рассматриваемый в данной работе комплекс встречается у пекарских дрожжей (Saccharomyces cerevisiae штамм ATCC 204508 / S288c)[2], широко используемых
в производстве хлебопекарной и алкогольной продукции, а также служащих популярным модельным объектом в различных научных исследованиях[3].
Алкогольдегидрогеназа I участвует в процессе ферментации глюкозы: преобразует ацетальдегид в этанол (Рис.1)[1].
Данный изофермент катализирует реакцию превращения первичных неразветвленных спиртов до соответствующих альдегидов, также проявляет активность в отношении
вторичных спиртов. Его каталитическую активность можно проиллюстрировать следующей реакцией:
Спирт + НАД + <=> альдегид или кетон + НАДН[3]
Алкогольдегидрогеназа I относится к классу оксидоредуктаз[1] (ферментов, катализирующих реакции биологического окисления,
сопровождающиеся переносом электронов с одной молекулы на другую[4]),
представляет собой гомотетрамер (белковый комплекс, состоящий из четырех одинаковых субъединиц, связанных не ковалентно [5]).
Четыре различные белковые субъединицы расположены в аналогичных димерах, называемых AB и CD. Субъединицы A и C, расположенные в различных димерах
структурно похожи (аналогичным сходством обладают B и D), однако между структурой этих двух димеров существует ряд различий, образующих асимметрию в их строении.
Вероятно, данная асимметрия играет важную роль в работе каталитического механизма фермента [1].
В состав комплекса входят также низкомоллекулярные лиганды: трифторэтанол, ионы цинка и НАД. Подробнее с ними можно ознакомиться в разделе,
посвященным описанию низкомолекулярных лигандов (см. ниже) [1].
Общая информация об алкогольдегидрогеназе I собрана в таблице 1.
|
Таблица 1. Общая информация[1]
| Название белка | Алкогольдегидрогеназа 1 |
| Идентификатор базы данных PDB (PDB ID) | 4W6Z |
| Идентификатор базы данных Uniprot (Uniprot ID ) | P00330 (ADH1_YEAST) |
| Организм | Saccharomyces cerevisiae |
| Тип фермента | Оксидоредуктаза |
| Общий вес структуры | 149543,72 |
| Число cубъединиц в составе белка | 4 |
| Длина cубъединиц (в аминокислотных остатках) | 347 |
| Структура субъединиц | Гомотетрамер |
| Название гена | ADH1 |
| Расположение в клетке | Цитоплазма |
| Рис.1 Схема ферментации[6] 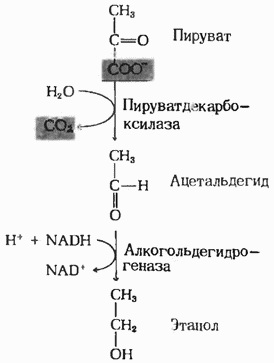 |
|
| |
НИЗКОМОЛЕКУЛЯРНЫЕ ЛИГАНДЫ
В состав алкогольдегидрогеназы входят лиганды трех типов:
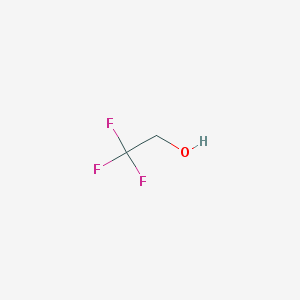
ТрифторэтанолПо одной молекуле располагается на каждой из четырех цепей, при этом соединение субъединиц А, С
c лигандом отличаются от соединения аналогичных молекул лиганда с цепями B и D (см. раздел о лиганд-биомолекулярных контактах) Ион цинкаВ состав белкового комплекса входит восемь ионов цинка, по два на каждую субъединицу. Асимметрия в строении субъединиц одного из димеров относительно друг друга
наблюдается в связях между белковыми цепями и трифторэтанолом, а также в связях ионов цинка с цепями белка из одной субъединицы. При этом асимметрии в
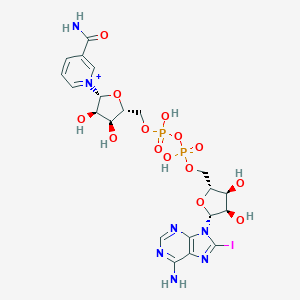
в строении двух димеров не наблюдается. Никотинамид-8-иод-аденин-динуклеотид (НАД) Всего в белковом комплексе две молекулы данного соединения, они симметрично
располагаются на цепях A и С.
Информация о физико-химических свойствах лигандов представлена в таблице 2.
Таблица 2. Физико-химичесике свойства лигандов
| НАЗВАНИЕ ЛИГАНДА (по IUPAC) | 2,2,2-Трифторэтанол | Ион цинка | Никотинамид-8-иод-аденин-динуклеотид |
| ХИМИЧЕСКАЯ ФОРМУЛА | C2H3F3O | Zn2+ | C21H27IN7O14P2 |
| МОЛЕКУЛЯРНАЯ МАССА (г/моль) | 100,04 | 65,38 | 790.334 |
| PubChem СID | 6409(PubChem) | 32051(PubChem) | 9543524(PubChem) |
|  |  |  |
|
| |
|
БЕЛОК-БЕЛКОВЫЕ КОНТАКТЫ
Гидрофобные ядра. При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом
свободной энергии. Поэтому гидрофобные радикалы аминокислот стремятся к объединению внутри глобулярной структуры растворимых в воде белков.
Между ними возникают так называемые гидрофобные взаимодействия, а также силы ван дер Ваальса между близко прилегающими друг к другу атомами.
В результате внутри белковой глобулы формируется гидрофобное ядро. Гидрофильные группы пептидного остова при формировании вторичной структуры
образуют множество водородных связей,
благодаря чему исключается связывание с ними воды и разрушение внутренней, плотной структуры белка.
В данном белковом комплексе присутствуют 2 крупных идентичных гидрофобных ядра, расположенных на соседних димерах. Эти гидрофобные ядра пронизывают
практически весь димер, и достаточно обширной чатью выходит на поверхность. При этом НАД частично располагается в гидрофобном ядре, в то время как остальные
лиганды практически полностью в него погружены. Исходя из этого, можно сделать предположение, что гидрофобное ядро может играть важную роль в связывании
белка с субстратом, однако вероятно, это крупное гидрофобное ядро очень важно для поддержания структуры димера, в частности осуществления белок-белковых взаимодействии
и поддержании структуры димера и, возможно, связывания лиганда НАД (см. лиганд-биомолекулярные взаимодействия).
Помимо этого в белке также присутствуют 19 более мелких гидрофобных ядер, наиболее крупное из которых состоит из 43 атомов. Ни одно из этих ядер не связано
с лигандами и в целом в их расположении наблюдается свойственная для данного гомотетрамера симметрия между димерами. Однако самое крупное из этих небольших ядер,
расположенное на цепи С, существенно больше аналогичного на симметричной ему цепи А.
Общее число атомов, входящих в гидрофобные ядро - 2782, при общем числе атомов, равном 10601.Что приблизительно составляет 26%. То есть около четверти
всех атомов входят в состав гидрофобных ядер. Однако учитывая, что наиболее крупное ядро пронизывает почти весь белок, можно сделать вывод, что
атомы, входящие в состав ядер, расположены достаточно рыхло.
- Ковалентные связи - химическая связь, образованная перекрытием пары валентных электронных облаков.
Обеспечивающие связь электронные облака называются общей электронной парой
[7].
Дисульфидные мостики - ковалентная связь между двумя атомами серы (—S—S—), входящими в состав серосодержащей
аминокислоты цистеина. Образующие дисульфидную связь аминокислоты могут находиться как в одной, так и в разных
полипептидных цепях белка. Дисульфидные связи образуются в процессе посттрансляционной модификации белков и служат
для поддержания третичной и четвертичной структур белка
[8].
В данном белке два дисульфидных мостика, соединяющий цепи A и B и соединяющий C и D. В силу того, что белковые цепи
расположены в аналогичных димерах, мы визуализировали лишь один, находящийся между цистеинами цепей A и B, который
выполняет функцию связывания и стабилизации этих цепей.
Водородные связи - форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с
другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи
могут быть межмолекулярными или внутримолекулярными.
[9].
Водородная связь обусловлена электростатическим притяжением атома водорода к атому электроотрицательного элемента,
имеющего отрицательный заряд. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного
притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная
связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной
химической связи. Угол между атомами во фрагменте (А-Н...В) обычно близок к 180°.
[10].
В данном белке мы изучили следующие водородные связи:
Водородные связи внутри α-спирали.
α-спираль — типичный элемент вторичной структуры белков, который имеет форму правозакрученной винтовой линии и в
котором каждая аминогруппа (-NH) в каркасе образует водородную связь с карбонильной группой (-C=O) аминокислоты,
находящейся на 4 аминокислоты раньше
[11].
В апплете представлен небольшой участок молекулы белка, в котором присутствуют α-спирали, обуславливающие
вторичную структуру белка.
Водородные связи внутри ß-тяжа.
ß-тяжи состоят из ß-цепей, связанных с боков 2-мя или 3-мя водородными связями, образуя слегка закрученные,
складчатые листы. Более высокоуровневые структуры, образованные множеством ß-тяжей, приводят к образованию белковых
агрегатов и фибрилл, наблюдаемых при многих заболеваниях человека и животных
[12].
В апплете представлен небольшой участок молекулы белка, в котором присутствуют ß-тяжи, соединяющие две цепи A и B
между собой.
Солевые мостики, в химии, представляют общее сочетание двух нековалентных взаимодействий: образование
водородных связей и электростатических взаимодействий. Чаще всего наблюдаются в белках, характеризующихся
низким значений энтропии. Несмотря на то что нековалентные взаимодействия считаются относительно слабыми,
даже столь малый вклад в стабилизацию структуры белка способен поддержать всю молекулу.
Солевой мостик чаще всего возникает путем
взаимодействия аниона карбоксильной группы от аспарагиновой или
глутаминовой кислот и аммино-группы лизина, гуанидина аргинина или гистидина. Очень важно расстояние между
заряженными остатками, оно должно составлять не более 4Å
[13].
В данном апплете представлен солевой мостик между глутаминовой кислотой и аргинином различных цепей, которые
способствуют связыванию двух цепей.
Cтэкинг взаимодействия - это гидрофобные связи, которые возникают при таком расположении ароматических молекул,
которое напоминает расположение монет в стопке и поддерживается ароматическими взаимодействиями.
Ароматическое взаимодействие (или π-π взаимодействие) — это нековалентное взаимодействие между органическими
соединениями, содержащими ароматические компоненты. π-π взаимодействия вызываются межмолекулярным перекрыванием
p-орбиталей в π-сопряженных системах, так что они становятся сильнее, поскольку число π-электронов возрастает
[14].
Мы изучили различные ароматические аминокислотные остатки и обнаружили стэкинг взаимодействие в цепи A в двух местах
между различными остатками гистидинов. Причем в одном стэкинг взаимодействии ароматические кольца расположены
точно друг над другом, а в другом - они симметрично развёрнуты в пространстве. |
| |
|
ЛИГАНД-БИОМОЛЕКУЛЯРНЫЕ КОНТАКТЫ |
|
Как уже отмечалось ранее, в состав алкогольдегидрогеназы I входят 8 ионов цинка, 2 молекулы НАД, и 4 молекулы Трифторэтанола. Все лиганды равномерно распределены по соответствующим цепям двух аналогичных димеров.
Таким образом, все контакты лиганда с белком в одном димере идентичны таковым в другом димере. Исходя из этого, мы в нашей работе рассматривали лишь контакты лигандов с цепями А и В одного из димеров.
Молекула трифторэтанола из цепи А ([ETF]404:A) связана с ионом цинка, располагающимся на расстоянии 1,78Å от нее. Помимо этого ион цинка ([ZN]401:A.)
образует координационные связи также с располагающимся на расстоянии 1,95Å атомом азота из молекулы гистидина ([HIS]66:A.NE2) и двумя атомами серы ([CYS]153:A.SG;[CYS]43:A.SG).
Наиболее интересно расположение молекулы трифторэтанола из цепи B. Располагающийся рядом с ней ион цинка все так же связан с двумя атомами серы из цистеинов ([CYS]153:В.SG;[CYS]43:В.SG),
атомом азота из гистидина ([HIS]66:B.NE2 ). Однако на этой цепи цинк образует координационную связь с кислородом из глутаминовой кислоты ([GLU]67:B.OE2), а связи с кислородом трифторэтанола не образуется.
При этом атом кислорода находится на большем удалении от иона цинка, в отличие от цепи А, в то время, как кислород из глутаминовой кислоты наоборот располагается ближе (2,31Å и 3.11Å).
Выяснить какие же именно связи удерживают этот лиганд в составе белка пока не удалось. Не были найдены ни ковалентные связи, ни водородные, ни солевые мостики не были обнаружены.
Еще один ион цинка образует координационные связи с четырьмя атомами серы из цистеинов, располагающихся на расстоянии не более 2.33Å.
Молекулы НАД располагаются на цепях А и С. По нашим предположениям, с цепью лиганд соединяют три солевых мостика, возникающих между атомами азота в молекуле НАД и атомами азота гистидина, лизина и аргинина ([8ID]403:A.O2N - [ARG]340:A.NH1; [8ID]403:A.O3B - [LYS]206:A.NZ; [8ID]403:A.O3' - [HIS]48:A.NE2).\
Вероятно также особую роль в поддержании этой структуры играют гидрофобные взаимодействия. Как описывалось в разделе, посвященном гидрофобным взаимодействиям, часть молекулы НАд
погружена в крупное гидрофобное ядро, другая же часть свободно просматривается с поверхности. |
| |
|
|
ПОИСК КОНТАКТОВ
Для выполнения данной работы мы использовали программу JMol, с помощью
которой были визуализированы взаимодействия между различными атомами в данной молекуле белка. С результатами
визуализации вы можете ознакомиться на данной странице.
Для поиска контактов в белке производились следующие операции:
Для обнаружения водородных связей внутри ß-тяжей α-спиралей были использованы такие команды, как
'select helix' - для α-спиралей; 'select sheet' - для ß-тяжей; 'hbonds on' - для непосредственного
обозначения водородных связей между атомами различных аминокислотных остатков.
Дисульфидные мостики мы обнаружили, выделив остатки цистеинов ([CYS]), между которыми и возможно её возникновение.
Поиск гидрофобных ядер осуществлялся с помощью ресурса
CluD, который точно отображает все ядра,
характерные для данной молекулы.
Чтобы исследовать окружение соответствующих низкомолекулярных лигандов, мы определяли атомы, расположенные
вокруг них на расстоянии 4Å. А затем выделяли аминокислотные остатки, с которыми ковалентно связаны лиганды,
и создавали соответствующий апплет.
Для идентификации солевых мостиков, образующихся между заряженными аминокислотными остатками, мы искали
противоположно заряженные остатки, радикалы которых расположены на небольшом расстоянии. При этом были выбраны
две группы остатков: положительно заряженные ([LYS], [HIS], [ARG]) и отрицательно ([ASP], [GLU]); и каждая группа
была помечена своим цветом, в результате мы смогли выделить конкретную пару, образующую солевой мостик.
Стэкинг-взаимодействия были найдены с помощью последовательного анализа взаимного расположения различных
ароматических аминокислотных остатков ([HIS], [PHE], [TRP], [TYR]) и поиска параллельно расположенных ароматических
колец на небольшом расстоянии. |
ЛИЧНЫЙ ВКЛАД
Страница с отчетом, в том числе: разработка дизайна, подача информации, редактирование текстов, создание таблиц с общими данными,
создание апплетов и редактирование скриптов; а также отображение гидрофобных и лиганд-белковых взаимодействий в молекуле,
описание лигандов и гидрофобных ядер было выполнено
Анной Камышевой.
Создание скриптов, посвященных белок-белковым взаимодействиям, лигандам и их взаимодействиям с белками;
описание белок-белковых взаимодействий и процесса поиска контактов, а также перевод данной работы
на английский язык было выполнено
Полиной Шпудейко.
|
ИСТОЧНИКИ
- http://www.rcsb.org/pdb/explore.do?structureId=4W6Z
- http://www.uniprot.org/uniprot/P00330
- https://ru.wikipedia.org/wiki/Saccharomyces_cerevisiae
- https://ru.wikipedia.org/wiki/Оксидоредуктазы
- https://ru.wikipedia.org/wiki/Гомотетрамер
- Ленинджер А. Основы биохимии: В 3-х т. Т. 2. Пер. с англ.-М.: Мир. 1985.-368 с.
- https://ru.wikipedia.org/wiki/Ковалентная_связь
- https://ru.wikipedia.org/wiki/Дисульфидная_связь
- https://ru.wikipedia.org/wiki/Водородная_связь
- http://www.alhimik.ru/stroenie/gl_14.html
- https://ru.wikipedia.org/wiki/Альфа-спираль
- http://hpc.mipt.ru/wp-content/uploads/2012/05/Lecture..
- https://en.wikipedia.org/wiki/Salt_bridge
- https://ru.wikiversity.org/wiki/Стэкинг_взаимодействия
|
| Главнaя страница |



